慢病毒介导BTLA转染未成熟树突状细胞的研究
2015-01-04王萱易寰刘佳李敏彭福华
王萱 易寰 刘佳 李敏 彭福华
基础研究论著
慢病毒介导BTLA转染未成熟树突状细胞的研究
王萱 易寰 刘佳 李敏 彭福华
目的 探讨构建携带B和T淋巴细胞衰减因子(BTLA)基因的慢病毒载体转染未成熟树突状细胞(DC)的可行性。方法根据GeneBank公布的小鼠BTLA的mRNA序列构建ORF慢病毒表达质粒,合成BTLA基因的重组慢病毒载体。原代分离培养CL57/BL小鼠骨髓来源的未成熟DC,用包含BTLA基因的重组慢病毒载体以感染复数为15转染至未成熟DC。采用免疫荧光、反转录PCR检测BTLA基因的表达。结果成功构建有活性的慢病毒载体LPP-Mm26645-Lv203-400,慢病毒滴度为3.25×109TU/ml。以重组慢病毒LPP-Mm26645-Lv203-400转染未成熟DC 96 h后在荧光倒置显微镜下可观察到被感染的阳性细胞有绿色荧光蛋白表达,反转录PCR检测到感染的DC中BTLA基因的表达量比未感染的DC的表达量高(P<0.05),提示转染成功。结论构建携带BTLA基因的慢病毒载体可成功转染BTLA至小鼠骨髓来源的未成熟DC。
B和T淋巴细胞衰减因子;慢病毒;树突状细胞;基因转染
B和T淋巴细胞衰减因子(BTLA)是免疫球蛋白超家族的一员,是CD28家族被发现的第3个抑制性分子,与相应受体疱疹病毒侵入介质(HVEM)结合提供抗原特异性T淋巴细胞活化的第二信号,在免疫反应早期阶段发挥重要的协同抑制作用[1]。树突状细胞(DC)是体内最强的专职抗原提呈细胞(APC),在免疫系统中起中心调节作用[2]。DC不同表型对T淋巴细胞接受抗原刺激的反应状态有决定性作用,未成熟DC因缺乏共刺激分子表达,不能提供T淋巴细胞活化必需的第二信号,往往导致T淋巴细胞无能或凋亡,诱导免疫耐受,因此成为近年来研究的热点[3]。未成熟DC诱导抗原特异性免疫耐受并维持其耐受状态,对自身免疫性疾病和移植后排斥反应的预防和治疗具有重要意义,但是单纯的DC治疗难以达到理想效果[4]。BTLA负性共刺激分子修饰未成熟DC,抑制T淋巴细胞的活化过程,可增强免疫耐受。在本研究中,我们构建了BTLA慢病毒表达载体转染未成熟DC,以探讨此法转染BTLA至未成熟DC的可行性,从而为进一步研究BTLA修饰的未成熟DC的免疫耐受作用提供实验基础。
材料与方法
一、材料与动物
含葡萄糖、谷氨酰胺、丙酮酸钠的DMEM培养基,含L-谷氨酰胺和25mM4-羟乙基哌嗪乙磺酸(HEPES)的RPMI1640培养基、NQBB胎牛血清、青霉素-链霉素双抗、IL-4(IL-4Pepro Tech)、粒细胞-巨噬细胞集落刺激因子(GM-CSF Pepro Tech)、小鼠抗小鼠MHC-Ⅱ、CD80、CD86、CD11c单克隆抗体(eBioscience)。6周雌性CL57/BL小鼠。
二、方 法
采用实时PCR(qPCR)测定重组慢病毒载体滴度。采用免疫荧光、反转录PCR(RT-PCR)检测未成熟DC上BTLA基因的表达情况。
1.慢病毒载体LPP-Mm26645-Lv203-400的构建与活性检测
根据GeneBank公布的小鼠BTLA的mRNA (NM_001037719.2),委托广州GeneCopoeia公司合成引物,构建ORF慢病毒表达质粒LV-BTLA并构建慢病毒LPP-Mm26645-Lv203-400,采用qPCR测定慢病毒LPP-Mm26645-Lv203-400滴度。用此慢病毒感染H1299细胞,培养48 h。使用荧光显微镜进行增强型绿色荧光蛋白观察,有绿色荧光表示慢病毒有活性。将慢病毒液冻存于-80℃。
2.小鼠骨髓源性未成熟DC的分离培养与流式检测
2.1 DC的分离培养
颈椎脱臼处死CL57/BL小鼠,用无菌手术取出股骨、胫骨,剪去骨两端,吸取PRMI1640培养基(含20%胎牛血清、1%青霉素-链霉素双抗、10 ng/μl的IL-4、10 ng/μl的GM-CSF)反复冲洗骨髓腔,将骨髓细胞冲至培养基中,反复吹打培养基,得到骨髓细胞悬液。收集骨髓细胞悬液至15 ml离心管后离心(1 500 rpm,5 min),弃上清液收集骨髓细胞沉淀。以适量RPMI1640培养基充分重悬细胞后以每孔1.5 ml将细胞悬液转移至6孔细胞板中,水平轻摇后将细胞板放入37℃、5%二氧化碳培养箱中。培养第4日进行半量换液。
2.2 DC的收集与流式检测
培养DC的第6日,于显微镜下观察细胞生长情况并拍照。收集细胞悬液至15 ml离心管后离心(1 000 rpm,8 min),收集细胞沉淀后以适量RPMI1640培养基重悬细胞。取部分细胞与PE-Cy5.5标记的CD11c、FITC标记的CD80、PE标记的CD86、APC标记的MHC-Ⅱ分子在4℃反应30 min,经磷酸盐缓冲液(PBS)冲洗2次后用流式细胞仪检测。
3.重组慢病毒LPP-Mm26645-Lv203-400转染DC
按上述方法培养的DC培养至第5日,收集DC并接种于12孔细胞板,每个孔内接种3×104个DC,铺板时细胞的融合率为50%左右,每孔培养基体积为600 μl,水平轻摇后将细胞板放入37℃、5%二氧化碳培养箱中。24 h后取出构建的慢病毒LPP-Mm26645-Lv203-400液并稀释至0.5× 108TU/mL,进行病毒感染时细胞的融合度约为70%,以感染复数为15分别加入重组慢病毒LPPMm26645-Lv203-400,补充完全RPMI1640培养基至终体积1 ml,加入Polybrene维持其终浓度于5 μg/ml,水平轻摇后将细胞板放入37℃、5%二氧化碳培养箱中。隔日补充新鲜RPMI1640培养基。96 h后使用荧光显微镜进行绿色荧光蛋白观察,有绿色荧光者为BTLA基因表达阳性。未感染慢病毒的DC为对照组(DCN)。
4.RT-PCR检测BTLA在DC中的表达
根据NCBI数据库中基因BTLA-F、BTLA-R、GAPDH-F、GAPDH-R的序列分别设计合成的引物序列,收集重组慢病毒LPP-Mm26645-Lv203-400转染的DC,提取RNA,以DNaseI消化,电泳检测RNA完整性,反转录为互补DNA(cDNA),进行RT-PCR检测。
5.重组慢病毒LPP-Mm26645-Lv203-400转染的DC的表型检测
取重组慢病毒LPP-Mm26645-Lv203-400转染成功的DC与PE-Cy5.5标记的CD11c、FITC标记的CD80、PE标记的CD86、APC标记的MHC-Ⅱ分子在4℃反应30 min,经PBS冲洗2次后用流式细胞仪检测。
三、统计学处理
采用SPSS 20.0处理数据,计量资料组间比较采用t检验,P<0.05为差异有统计学意义。
结 果
一、慢病毒载体LPP-Mm26645-Lv203-400的构建、滴度与活性检测
重组慢病毒颗粒由高纯度ORF表达质粒(基因:BTLA、启动子:CMV、C-flag标签)、Endo-Fectin-LentiTM和Titer BoostTMreagents生成,并在Lenti-PacTMHIV packaging mix(Cat#:HPK-LvTR-20)作用下被包装于293Ta细胞(Cat#:CLv-PK-01)中,转染后48 h收集细胞,qPCR检测本次病毒制备的滴度为3.25×109TU/ml。1 μl的LPPMm26645-Lv203-400转染H1299细胞,3 d后在荧光显微镜下观察,结果见图1,重组慢病毒LPPMm26645-Lv203-400活性正常。
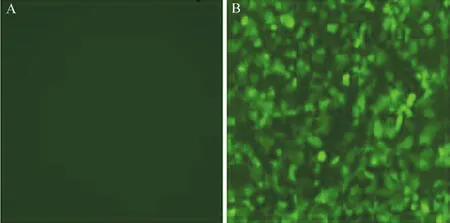
图1 重组慢病毒LPP-Mm26645-Lv203-400转染H1299细胞3 d后荧光显微镜观察(×250)
二、体外培养DC的光镜观察与流式细胞仪检测结果
CL57/BL小鼠的骨髓细胞在RPMI1640培养基体外培养24 h后,培养瓶底部可见半贴壁细胞,细胞呈圆形。培养第4日,细胞形态逐渐由圆形变为不规则形,个别细胞形成突起,可见细胞聚集现象,以粒细胞集落居多,集落由3~4个细胞组成,其后细胞直径逐渐增大,集落中的细胞数可达8~9个。换液时倾去的培养基中的悬浮细胞主要为T淋巴细胞、B淋巴细胞、粒细胞、死细胞、细胞碎片及少量单核细胞和DC。培养第6日,细胞集落继续增多,可见细胞逐渐呈悬浮状态。收集培养5 d后(第6日)的DC进行流式细胞检测,CD11c、CD86、CD80、MHC-Ⅱ是鉴别DC的主要标志物,其阳性表达率分别为73.59%、94.45%、47.84%、39.74%,为未成熟DC的表现。
三、重组慢病毒LPP-Mm26645-Lv203-400转染DC结果
重组慢病毒LPP-Mm26645-Lv203-400以感染复数为15转染培养5 d后的DC,96 h后在荧光倒置显微镜下可观察到被感染的阳性细胞有绿色荧光蛋白表达(图2)。在光镜下观察DC呈类圆形,部分细胞可见突起,细胞体积增加不明显,大量DC呈悬浮状态(图3)。
四、RT-PCR检测BTLA的表达
电泳检测RNA完整,经过逆转录酶的作用得到cDNA,进行RT-PCR检测,基因表达情况见图4,与对照组相比,转染BTLA基因的慢病毒载体的DC上BTLA基因表达量明显提高。
五、转染BTLA基因的慢病毒载体的DC的表型鉴定
收集重组慢病毒LPP-Mm26645-Lv203-400转染96 h后的DC,流式细胞仪检测CD11c--PE-Cy5.5、CD80--FITC、CD86--PE、MHC-Ⅱ-APC的阳性表达率分别为83.14%、89.06%、38.9%、41.28%,仍为未成熟DC的表现。
讨 论
免疫抑制是当前治疗自身免疫性疾病和移植后排斥反应的主要有效方法。特异性阻断某些免疫反应而非全面地抑制免疫显得尤为重要,近年来已有大量关于DC与T淋巴细胞作为配受体相互反应的研究[1]。抗原特异性T淋巴细胞的活化需要两个信号,第一信号来自于APC主要组织相容性复合体(MHC)-抗原肽复合物与T淋巴细胞受体-CD3复合物,第二信号由APC表面的共刺激分子与T淋巴细胞上相应受体结合作用产生。BTLA是重要的负性抑制共刺激分子,包含免疫受体酪氨酸抑制基序(ITIM)。当BTLA与其配体HVEM结合,ITIM磷酸化,激活酪氨酸蛋白酶SHP-1和SHP-2,则会对T淋巴细胞增殖活化起抑制作用[5]。目前有研究表明,在一些自身免疫性疾病模型中,缺失BTLA-HVEM信号会引发严重的炎症反应。BTLA基因敲除鼠诱导出的实验性过敏性脑脊髓膜炎模型的发病率更高,病情更严重[6]。DC作为体内最强的APC,在免疫系统中起中心调节作用。Melton等[2]的研究表明DC对抗原的传递及其提呈的抗原肽的周转均可影响实验性自身免疫性疾病的结局。未成熟DC可以通过多种机制诱导对T淋巴细胞特异性抗原的耐受,但是单纯的DC并不能完全抑制免疫反应。

图2 重组慢病毒LPP-Mm26645-Lv203-400转染DC 96 h后荧光显微镜观察(×250)
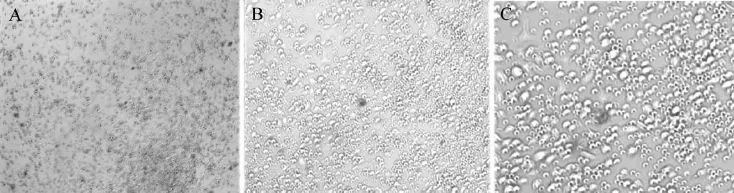
图3 重组慢病毒LPP-Mm26645-Lv203-400转染DC 96 h后倒置显微镜观察
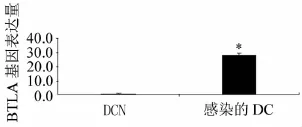
图4 RT-PCR检测感染的DC及DCN中BTLA基因表达与DCN组比较,*为P<0.05
慢病毒表达载体可以包装、转染、稳定整合所需要的遗传信息,可以将外源基因有效整合到宿主染色体,从而达到持久性表达的目的,并且具有无插入致突变性、转染率高、免疫反应小的特点。BTLA低表达于未成熟DC,故本研究根据Gene-Bank公布的小鼠BTLA的mRNA构建含有外源基因的重组载体,将测序正确、不含内毒素的重组质粒与复能基共转染而得到高质量的病毒液LPPMm26645-Lv203-400液,并将其以感染复数为15转染至原代培养至第6日的未成熟DC,经检测证实未成熟DC有BTLA基因表达[7]。未成熟DC表面几乎不表达BTLA,但本研究以慢病毒介导的BTLA成功转染了DC,提高了未成熟DC上BTLA的表达量,而且感染的未成熟DC的表型并无变化。因此,构建携带BTLA基因的慢病毒载体可成功转染BTLA至小鼠骨髓来源的未成熟DC,这为研究BTLA修饰的未成熟DC的免疫耐受作用甚至将其用于治疗自身免疫性疾病或移植后排斥反应提供了实验基础。
致谢:感谢中山大学中山医学院余新炳教授为本研究提供了技术性帮助。
[1]Del Rio ML,Lucas CL,Buhler L,Rayat G,Rodriguez-Barbosa JI.HVEM/LIGHT/BTLA/CD160cosignaling pathways as targets for immune regulation.J Leukoc Biol,2010,87(2):223-235.
[2]Melton AC,Bailey-Bucktrout SL,Travis MA,Fife BT,Bluestone JA,Sheppard D.Expression of αvβ8 integrin on dendritic cells regulates Th17 cell development and experimental autoimmuneencephalomyelitis in mice.J Clin Invest,2010,120(12):4436-4444.
[3]Said A,Weindl G.Regulation of dendritic cell function in inflammation.J Immunol Res,2015,2015:743169.
[4]Ilarregui JM,Rabinovich GA.Tolerogenic dendritic cells in the control of autoimmune neuroinflammation:an emerging role of protein-glycaninteractions.Neuroimmunomodulation,2010,17(3):157-160.
[5]Steinberg MW,Cheung TC,Ware CF.The signaling networks of the herpesvirus entry mediator(TNFRSF14)in immune regulation.Immunol Rev,2011,244(1):169-187.
[6]Shui JW,Steinberg MW,Kronenberg M.Regulation of inflammation,autoimmunity,and infection immunity by HVEM-BTLA signaling.J Leukoc Biol,2011,89(4):517-523.
[7]Murphy KM,Nelson CA,Sedy JR.Balancing co-stimulation and inhibition with BTLA and HVEM.Nat Rev Immunol,2006,6(9):671-681.
Study of immature dendritic cells transfected with lentiviral-mediated B and T lymphocyte attenuator
Wang Xuan,Yi Huan,Liu Jia,Li Min,Peng Fuhua.Department of Neurology,the Third Affiliated Hospital of Sun Yat-sen University,Guangzhou 510630,China
Objective To construct lentiviral vector expressing B and T lymphocyte attenuator(BTLA)gene and evaluate the feasibility of transfecting immature dendritic cells by this vector.Methods According to the mRNA sequence of mouse BTLA published by GeneBank,the ORF lentiviral plasmid was constructed and the recombinant lentiviral vector expressing BTLA was synthesized.Immature dendritic cells were subjected to primary isolation and culture from C57BL/6 mouse bone marrow.Immature dendritic cells were transfected with recombinant lentivial vector expressing BTLA at a multiplicity of infection of 15.The expression level of BTLA was assessed by immunofluorescence and RT-PCR.Results The lentiviral vector LPPMm26645-Lv203-400 was successfully constructed at a titer of 3.25×109TU/ml.At 96 h after immature dendritic cells transfected by the lentiviral vector LPP-Mm26645-Lv203-400,positive cells expressing green fluorescent protein were observed under inverted fluorescent microscope.The expression level of BTLA in the transfected immature dendritic cells was significantly higher compared with that in the non-transfected cells(P<0.05),indicating the successful transfection.Conclusion The lentiviral vector expressing BTLA gene can be successfully transfected into the mouse marrow-derived immature dendritic cells.
B and T lymphocyte attenuator;Lentivirus;Dendritic cell;Transfection
2015-07-15)
(本文编辑:洪悦民)

10.3969/j.issn.0253-9802.2015.12.004
国家自然科学基金(81271327);广东省科技计划项目(2011B03I8O0015)
510630广州,中山大学附属第三医院神经内科
,彭福华,E-mail:pfh93@163.com
