草酸辅色黑米花色苷热降解及抗氧化特性研究
2015-01-04蒋益花蒋新龙蔡成岗郑晓宇
蒋益花 蒋新龙 蔡成岗 郑晓宇
(浙江树人大学生物与环境工程学院,杭州 310015)
草酸辅色黑米花色苷热降解及抗氧化特性研究
蒋益花 蒋新龙 蔡成岗 郑晓宇
(浙江树人大学生物与环境工程学院,杭州 310015)
为提高黑米色素的稳定性,用草酸对黑米花色苷进行辅色处理,并应用动力学参数分析辅色对热降解特性及抗氧化活性的影响。结果表明,添加草酸后,花色苷的吸光度明显增大,说明有辅色作用;当黑米花色苷原始吸光度与草酸摩尔浓度之比为291时,辅色效果最佳。草酸辅色黑米花色苷的热降解及抗氧化活性变化均符合动力学一级反应规律,线性关系良好(R>0.95),两者的动力学参数分析结果也极为相似。pH 3.0环境下,相对未辅色黑米花色苷,相应的活化能显著增大,半衰期显著延长。草酸辅色对黑米花色苷热降解及抗氧化活性的温度系数Q10的变化规律影响不大,在70~80℃花色苷降解速率较快,在80~90℃花色苷抗氧化活性降低速率较快。抗氧化活性降低的程度较相同条件下花色苷含量降低的程度小。草酸辅色处理能提高黑米花色苷热降解和抗氧化活性的稳定性,有利于在热处理条件下的应用及保存。
黑米 花色苷 草酸 辅色 降解 抗氧化 动力学
花色苷属于植物多酚中类黄酮类化合物[1],其活泼的酚羟基结构是良好的氢供体,有很强的抗氧化活性,具有预防心血管类疾病、糖尿病和抗肿瘤等医疗价值[2],但花色苷的稳定性受到pH、存储温度、光照、氧气、金属离子等诸多因素的影响[3]。一般高pH、高温、见光易使花色苷降解[4]。花色苷的降解不仅会产生对人体有害的物质,同时也影响色泽[5],从而限制了其使用范围。
黑米表皮呈黑色,富含花色苷,其主要成分为矢车菊-3-葡萄糖苷、矢车菊-3,5-二葡萄糖苷、天竺葵-3,5-二葡萄糖苷和锦葵素[6]。已有学者对黑米花色苷的提取、稳定性及抗氧化活性等作了研究[6-8],但为提高黑米色素的稳定性,对黑米花色苷进行辅色并研究其对热降解和抗氧化活性的影响,至今未见报道。本研究以黑米花色苷为研究对象,以吸光度作为花色苷浓度指标,以DPPH·清除活性作为抗氧化活性检测指标,用其他学者研究较少、但较常见、且安全无毒、价格便宜的草酸(oxalic acid,简称OA)为辅色剂,对黑米花色苷进行辅色,并对其热降解及抗氧化活性作动力学分析,为提高黑米色素的稳定性提供新途径,也为黑米色素在加工和贮藏过程中的质量控制提供理论依据和方法指导。
1 材料与方法
1.1 材料与仪器
供试黑米品种为“龙锦黑米1号”:浙江省农科所。取黑米种子,烘干,过60目筛,备用。
UV-9100紫外可见光谱仪:北京瑞利pHS-3B型精密pH计:上海精密科学仪器有限公司。
DPPH·:Sigma公司;大孔吸附树脂AB-8(净品级):天津海光化工有限公司。
1.2 试验方法
1.2.1 花色苷母液的制备
根据李莉蓉等[7]制备方法并稍做改动:黑米用60%乙醇液按1∶4的料液比,用1 mo1/L盐酸调至pH 3,避光浸提2 d。过滤,收集滤液,于50℃下减压浓缩,浓缩液用等体积的石油醚萃取3次后过AB-8大孔树脂,再用70%酸性乙醇液洗脱,将所得洗脱液于50℃下减压浓缩,得黑米花色苷母液,再将母液真空冷冻干燥,得粉末状深黑色黑米花色苷(black rice anthocyanin,简称 BRA,下同)。
1.2.2 辅色花色苷制备
pH值直接决定了花色苷在水溶液中的存在形式。在pH大于2的酸性介质中,花色苷开始由2-苯基-苯并吡喃阳离子水解为无色醇型假碱[9]。有学者研究表明,在较高pH条件下,2-苯基苯并吡喃阳离子含量低,辅色剂对花色苷的辅色作用较有效,辅色剂更有利于花色苷烊阳离子的方向进行[10-11]。参考励建荣等[3]试验方法来确定2-苯基苯并吡喃阳离子与无色醇型假碱水解平衡点。试验结果表明:黑米花色苷水解平衡点约为pH 3.0[12]。
吸取一定量pH 3.0的已纯化花色苷浓缩液10份,加入0.01 mol/L草酸作为辅色剂,使草酸浓度为0.0、0.5、1.0、2.0、3.0、4.0、5.0、6.0、7.0、8.0mmol/L,用磷酸氢二钠-柠檬酸缓冲液调节pH 3.0,测得最大吸收峰时的吸光值分别为1.457、1.652、1.700、1.844、2.008、2.022、2.202、2.208、2.213、2.215。添加草酸后,花色苷的吸光度增大,且随草酸浓度增大,溶液最大吸光值逐渐增大,说明有辅色作用[11,13]。草酸浓度为 5.0 mmol/L时,吸光值接近最大。此时黑米花色苷原始吸光度为1.457,与5.0×10-3mol/L草酸浓度之比为291。后面试验所用辅色花色苷即为黑米花色苷原始吸光度与草酸浓度(mo1/L)之比为291的花色苷溶液(pH 3.0)。
1.2.3 热降解试验及动力学参数分析
将所制备的辅色花色苷溶液,分别置于50、60、70、80、90℃恒温水浴中10 h,每隔2 h测定吸光度值,以未辅色花色苷溶液作空白对照,重复3次。假设草酸辅色花色苷的热降解反应与许多学者研究结果相符[14-15],符合一级反应动力学,则可根据下式计算热降解反应速率常数(k)、热降解活化能(E0)、热降解半衰期(t1/2)、温度系数(Q10)等参数。
k、E0由 Arrhenius方程确定[14]:

式中:C0为色素加热前最初浓度;C为色素加热后的终浓度;t为反应时间;k0为频率常数;E0为活化能/kJ/mol;T为绝对温度/K;R为气体常数(8.314×10-3kJ·mol-1·K-1)。
根据朗伯比尔定律,溶液的吸光值A与其浓度C成正比,故式(1)可表示为 ln(A/A0)=-kt。式中 A0为处理前原始吸光度。
热降解半衰期 t1/2=0.693/k,热降解率/%:

Q10为温度系数,kl、k2分别为温度 t1、t2时的速率常数。Q10值越大,表示热降解反应速率对温度变化越敏感[16]。

1.2.4 抗氧化活性试验
根据文献[17]方法并加以改进来测定计算对DPPH·的清除率Y:用无水乙醇配制2×10-4mol/L的DPPH·溶液。在10 mL具塞试管中加入2 mL DPPH·溶液(2×10-4mol/L)和2 mL一定浓度的色素溶液,总体积4 mL。混合均匀,黑暗下室温避光反应30 min后,以无水乙醇调零点,于光径1 cm比色皿中测定DPPH·混合溶液在517 nm处的吸光度。

式(5)中,Ai为2 mL DPPH·溶液+2 mL色素溶液的吸光度,Aj为2 mL色素溶液+2 mL无水乙醇的吸光度,Ac为2 mL DPPH·溶液+2 mL无水乙醇的吸光度。
分别测定花色苷热处理前后对DPPH·的清除率Y%,再按式(6)计算对DPPH·的清除率Y的保存率(%):

式(6)中,Y为热处理后对 DPPH·的清除率/%;Y0为热处理前对DPPH·的清除率/%。
将所制备的辅色花色苷溶液,分别置于50、60、70、80、90℃恒温水浴中24 h,每隔2 h取样测定一次,计算对DPPH·的清除率,并以未辅色花色苷溶液作空白对照,重复3次。根据1.2.3方法,计算不同温度下DPPH·自由基清除活性变化的动力学模型,计算速率常数(k)、活化能(E0)、半衰期(t1/2)、温度系数(Q10)等参数。
1.3 数据处理
采用DPSV3.01专业版软件进行处理和分析。
2 结果与分析
2.1 花色苷热降解动力学参数分析
根据1.2.3方法,图1为辅色前后pH 3.0时花色苷色素液热稳定性A~t的对应试验数据。图1显示,辅色后花色苷的吸光度增加,说明有辅色作用;随着温度升高,花色苷的热稳定性都降低,说明花色苷对热表现出不稳定的特性,与许多学者研究结果相吻合[18]。图2表明,除了90℃恒温水浴中保温10 h的样品,其他在相同条件下,辅色花色苷的降解率都比未辅色的要低,且在较低温度50、60、70℃时,两者有显著差异(P<0.05)。说明草酸辅色能提高黑米花色苷的稳定性。辅助成色作用是改善富含花色苷食品颜色和稳定性的一种十分有价值的、纯天然的方法[19]。
根据 -ln(A/A。)-t进行线性回归,结果见表1。结果表明线性关系良好(相关系数R>0.98),辅色前后花色苷热降解均符合动力学一级反应规律,与许多学者研究结果相符[20-21]。
根据Arrhenius方程,用花色苷降解的ln k对1/T进行线性回归,可得到复相关系数R(R>0.99)和活化能。表1显示,在一定温度下,以活化能计,草酸辅色BRA>未辅色BRA,说明辅色花色苷的热稳定性较好,有利于色素在热处理条件下的应用及保存。Dangles等[11]认为,富电子的辅色剂和带正电荷的花色苷烊阳离子通过氢键等分子间作用力,可形成辅色剂-花色苷电子转移复合物,该复合物使平衡向更有利于花色苷烊阳离子的方向进行,增加了其稳定性。Eiro等[22]认为,辅色剂-花色苷电子转移复合物可避免水分子对2位黄烊阳离子的进攻,防止花色苷形成查耳酮的形式,随后阻止部分颜色损失,从而对花色苷产生了增色和稳定效应。

图1 加热时间对花色苷降解的影响

图2 加热时间对花色苷降解率的影响
从半衰期来看,添加草酸与未添加草酸的花色苷溶液随温度升高,花色苷的热稳定性都降低。在较低温度50、60℃时,辅色前后的花色苷热降解的半衰期有显著差异(P<0.05)。添加草酸对黑米花色苷在90℃条件下辅色不显著。这是由于黑米花色苷色素受热后,其结构向查耳酮转变,导致生色结构2-苯并吡喃盐和醌式假碱减少。
从温度系数Q10可知,pH 3.0条件下,辅色前后花色苷在70~80℃的Q10值明显大于其他温度范围的Q10值,说明当热处理温度从70℃提高到80℃时,降解速率变化敏感,花色苷降解速率迅速加快。

表1 花色苷热降解动力学及降解参数
2.2 花色苷抗氧化活性变化的动力学参数分析
根据1.2.4方法,辅色前后pH 3.0时花色苷对DPPH·清除率Y~t的对应试验数据见图3。图3显示,辅色后较辅色前对DPPH·清除率有所提高;随着温度升高,对DPPH·清除率都降低。图4表明,除了90℃恒温水浴中24 h样品,其他在相同条件下,辅色花色苷对DPPH·的清除能力的保存率都比未辅色的要高,且在较低温度50、60、70℃时,两者有显著差异(P<0.05)。说明草酸辅色能提高黑米花色苷抗氧化活性的热稳定性。
比较表1和表2,两者的动力学参数分析结果极为相似。辅色前后花色苷抗氧化活性同样符合动力学一级反应规律(R>0.95)。辅色前后的花色苷的抗氧化热稳定性也不同。以活化能计,草酸辅色BRA>未辅色BRA,说明辅色花色苷的抗氧化热稳定性较好。从半衰期来看,添加草酸与未添加草酸的花色苷溶液随温度升高,花色苷的抗氧化热稳定性都降低。但相同温度,辅色前后对应的半衰期差异极显著(P<0.01)。
加热以后,辅色前后花色苷对DPPH·的清除率均有不同程度的下降,且温度越高,加热时间越长,降低幅度越大。这是因为,加热促进花色苷热降解,使花色苷含量不断降低。本研究发现,50、60、70℃处理1~8 h后,黑米花色苷的DPPH·自由基清除率无显著变化,这与张镜等[23]研究结果相似;尤其是草酸辅色花色苷,50、60℃处理1~24 h,DPPH·自由基清除率变化也不显著。这说明草酸辅色对保护黑米花色苷的抗氧化活性极有效。
此外,虽然加热使花色苷清除DPPH·自由基能力降低,但加热过程,降低的幅度较相同加热条件下花色苷含量降低的幅度小,清除率变化相对于花色苷降解相对平稳。这可能是由于花色苷降解是一个相对复杂的体系,如加热矢车菊素-3-葡萄糖苷芸香苷和矢车菊素-3-芸香苷,先发生糖苷键的断裂生成矢车菊素-3-葡萄糖苷,糖苷键进一步水解生成矢车菊素,矢车菊素进一步生成更不稳定的a-二酮,最终生成醛和苯甲酸类化合物[24]。
从温度系数Q10可看出,pH 3.0条件下,辅色前后花色苷在80~90℃的Q10值明显大于其它温度范围内的Q10值,说明当热处理温度从80℃提高到90℃时,花色苷抗氧化活性降低速率迅速加快。但花色苷在80℃和90℃短时间加热是稳定的,这也说明花色苷在经过如喷雾干燥、高温瞬时杀菌、短时蒸煮之类的处理时,抗氧化活性仍然稳定。辅色前后黑米花色苷在50~70℃都具有良好的抗氧化稳定性,说明花色苷作为抗氧化剂添加到食品中,经过诸如巴氏杀菌的热处理仍能保持良好的抗氧化活性。因此,在生产过程中应该按照黑米花色苷热稳定的温度和时间选择合适的加热条件。

图3 加热时间对DPPH·清除率影响
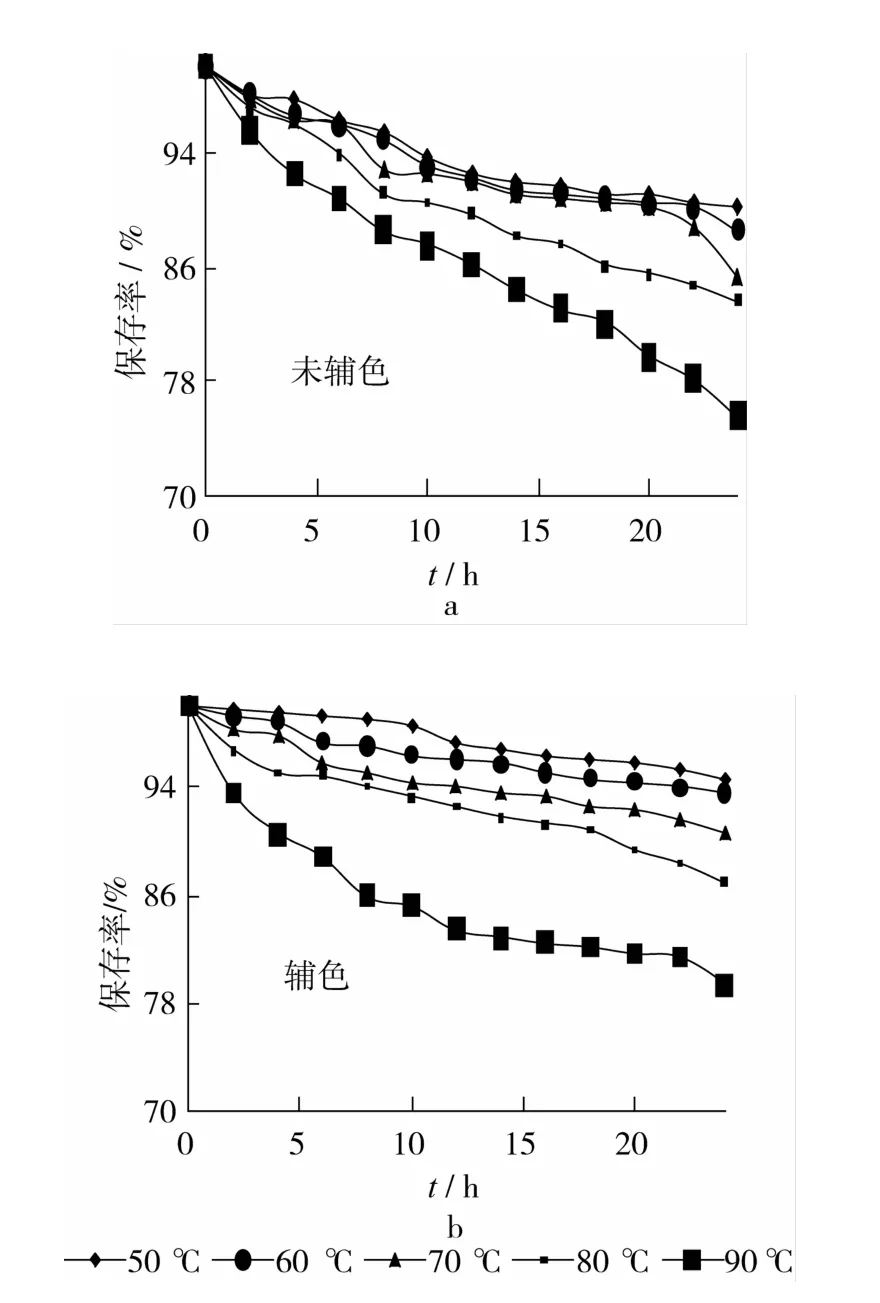
图4 加热时间对花色苷清除DPPH·的活性保存率的影响

表2 花色苷热降解动力学及降解参数
3 结论
用草酸对黑米花色苷进行辅色处理后,花色苷的吸光度明显增大。pH 3.0条件下,黑米花色苷原始吸光度与草酸摩尔浓度之比为291时,辅色效果最佳。
草酸辅色黑米花色苷的热降解动力学符合动力学一级反应规律,且线性关系良好(R>0.98)。辅色前后花色苷在70~80℃,降解速率较快。以活化能计,草酸辅色BRA>未辅色BRA。从半衰期来看,在较低温度50、60℃时,辅色前后的花色苷热降解的半衰期有显著差异(P<0.05)。pH 3.0环境下,相对未辅色黑米花色苷,热降解活化能显著增大,半衰期显著延长,辅色效果较显著。
草酸辅色黑米花色苷的抗氧化活性变化同样符合动力学一级反应规律,且线性关系良好(R>0.95)。辅色对花色苷抗氧化活性降低速率的温度系数Q10变化规律影响也不大。在80~90℃,花色苷抗氧化活性降低速率迅速加快。以活化能计,草酸辅色BRA>未辅色BRA;相同温度,辅色前后对应花色苷的抗氧化活性变化的半衰期差异极显著(P<0.01)。草酸辅色处理能提高黑米花色苷抗氧化活性的热稳定性。加工利用过程中可以根据实际需要选择适宜的处理条件,避免长时间、高温加热,以防止花色苷的降解和对抗氧化能力的破坏。
[1]Timberlake C F,Henry B S.Anthocyanins asnatural food colorants[J].Progress in Clinical and Biological Research,1988,280:107-121
[2]Tamura H,Yamagami A.Antioxidativeactivity ofmonoacylated anthocyanins isolated from muscat bailey a grape[J].FoodChemistry,1994,42(8):1612-1615
[3]励建荣,岑沛霖,蒋志刚,等.单宁对杨梅汁花色苷稳定性的影响[J].科技通报,2001,17(6):1-6
[4]Markakis P.Stability of anthocyanins in foods.In:anthocyanins as food colors[J].New York:Academic Press Inc,1982,163-178
[5]Mazza G.Recent developments in the stabilization of anthocyanins in food product[J].Food Chemistry,1987(25):207-225
[6]张名位,郭宝江,张瑞芬,等.黑米抗氧化活性成分的分离纯化和结构鉴定[J].中国农业科学,2006,39(1):153-160
[7]李莉蓉,张名位,刘邻渭,等.三种黑色粮油作物种皮花色苷提取物抗氧化能力的稳定性比较[J].中国农业科学,2007,40(9):2045-2052
[8]王艳龙,石绍福,韩豪,等.中国黑米花色苷研究现状及展望[J].中国生化药物杂志,2010,31(1):63-66
[9]Giris E F,Ferreira E A,Falcao LD,eta1.Caffeic acid copigmentation of anthocyanins from Cabernet Sauvignon grape extracts in model systems[J].Food Chemistry,2007,100(3):1289-1296
[10]Bobbio FO.Effect of light and tannic acid on the stability of anthocyanin in DMSO and in water[J].Food Chemistry,1994,51(2):183-185
[11]Dangles O,Brouillard R.Polypbenols interactions.The copigmentation case:thermodynamic data from temperature and relaxation kinetics.Medium effect[J].Canadian Journal of Chemistry,1992,70:2174-2189
[12]蒋新龙.黑米花色苷降解特性研究[J].中国粮油学报,2013,28(4):27-31
[13]王锋,邓洁红,谭兴和,等.花色苷及其共色作用研究进展[J].食品科学,2008,29:472-476
[14]朱洪梅,韩永斌,顾振新,等.单宁对紫甘薯花色苷的辅色作用研究[J].南京农业大学学报,2006,29(3):98-102
[15]彭常安,姜雯翔,袁哗,等.外源绿原酸对黑莓汁花色苷的辅色效果[J].江苏农业学报,2011,27(6):1357-1362
[16]邓洁红.刺葡萄皮色素的研究[D].长沙:湖南农业大学,2007
[17]李政,王国良,金珊,等.31种常见抗菌中药对DPPH自由基清除作用的分析[J].海洋水产研究,2005,26(1):39
[18]Dyrby M,Westergaard N,Stapelfeldt H.Light and heat sensitivity of red cabbage extract in soft drink model systems[J].Food Chemistry,2001,72:431-437
[19]Rein M J.Copigmentation reactions and color stability of berry anthocyanins[D].Helsinki(Finland):University of Helsinki.2005:87
[20]Kirca A,Cemeroglu B.Degradation kinetics of anthocyanins in blood orange juice and concentrate[J].Food Chemistry,2003,81:583-587
[21]Gradinaru G,Biliaderis C G,Kallithraka S,et a1.Thermal stability of Hibiscus sabdariffa L.anthocyanins in solution and in solid state:effect of copigmentation and glass transition[J].Food Chemistry,2003,83(3):423-436
[22]Eiro,M.J.,Heinonen M.Anthocyanin Color Behavior and Stability during Storage:Effect of Intermolecular Copigmentation[J].Journal of Agricultural and Food Chemistry,2002,50(25):7461-7466
[23]张镜,温思霞,廖富林,等.温度、光照及pH值对阴香花色苷清除 DPPH自由基活性的影响[J].食品科学,2009,30(13):120-123
[24]Sceram N P,Bonrquin L D,Nair M G.Degradation products of cyaniding glycosides from tart cherries and their bioactivities[J].Journal of Agricultural and Food Chemistry,2001,49:4924-4929.
Thermal Degradation and Antioxidant Properties About Oxalic Acid Copigmentation Anthocyanins of Black Rice
Jiang Yihua Jiang Xinlong Cai Chenggang Zheng Xiaoyu
(College of Biology and Environmental Engineering,Zhejiang Shuren University,Hangzhou 310015)
In order to improve the stability of pigment in black rice,anthocyanin has been taken co-pigmentation processing with oxalic acid.The effect of co-pigmentation has been treated on the thermal degradation properties and the activity of antioxidant has been studied by analysis of kinetic parameters.The results showed that after adding oxalic acid,the absorbance of anthocyanin increased significantly;the co-pigmentation started to take shape.When the black rice anthocyanin original absorbance and oxalic acid molar ratio was 290,the co-pigmentation was the best.Thermal degradation of co-pigmentation of black rice anthocyanin with oxalic acid and activity of antioxidant changed conformed to the first-order reaction kinetics regularity,and showed good linear relationship(R>0.95).The dynamic parameters analysis results were very similar.On the condition of pH 3,half-life was significantly prolonged and thermal degradation activation energy increased significantly compared that with no copigmentation.The temperature coefficientQ10was little changed in the degradation and antioxidantactivity.Reducing co-pigmentation anthocyanin with oxalic acid,anthocyanin degradation rate was faster at70~80℃ and antioxidant activity reducing rate was faster at 80~90℃.The decreased degree of the antioxidant activity was smaller than the decreased range of anthocyanin content.The results showed that the oxalic acid co-pigmentation processing can improve the stability of thermal degradation and antioxidantactivity of anthocyanin from black rice,It is beneficial to the application and stored in the heat treatment conditions.
black rice,anthocyanin,oxalic acid,co-pigmentation,degradation,antioxidation,kinetics
TQ914.1
A
1003-0174(2015)07-0091-06
大院名校共建创新载体项目(2012e80002),浙江树人大学应用化学省重点学科项目(YH2013S08)
2014-02-09
蒋益花,女,1965年出生,高级实验师,应用化学
