乌司他丁联合醒脑静注射液对脑出血模型兔神经特异性烯醇化酶、水通道蛋白4的影响*
2015-01-04佟丽妍金鑫胡才宝
佟丽妍金 鑫胡才宝
(1.浙江省杭州市中医院,浙江 杭州 310007;2.浙江省立同德医院,浙江 杭州 310000;3.浙江医院,浙江 杭州 310000)
·研究报告·
乌司他丁联合醒脑静注射液对脑出血模型兔神经特异性烯醇化酶、水通道蛋白4的影响*
佟丽妍1金 鑫2胡才宝3△
(1.浙江省杭州市中医院,浙江 杭州 310007;2.浙江省立同德医院,浙江 杭州 310000;3.浙江医院,浙江 杭州 310000)
目的观察乌司他丁注射液联合醒脑静注射液对脑出血模型兔血清神经特异性烯醇化酶 (NSE)、水通道蛋白4(AQP-4)的影响,探讨乌司他丁联合醒脑静注射液的脑保护作用。方法40只造模成功的新西兰兔随机平均分为4组,每组10只:脑出血模型组(模型组)、乌司他丁治疗组(乌司他丁组)、醒脑静注射液治疗组(醒脑静组)以及乌司他丁加醒脑静治疗组(联合组)。应用ELISA法测定各组兔造模前(0 d),造模后第1、3、5、7日动脉血中NSE、AQP-4的含量。结果造模成功后各组NSE及AQP-4水平均升高。与模型组比较,其他各组第1日NSE、AQP-4水平差异均无统计学意义(P>0.05);各组NSE水平第3~7日均下降(P<0.05);乌司他丁组第7日、醒脑静组第5~7日、联合组第3~7日AQP-4水平下降(P<0.05)。与联合组比较,乌司他丁组及醒脑静组第7日NSE水平较高(P<0.05);醒脑静组AQP-4第1~7日差异均无统计学意义(P>0.05);乌司他丁组第5日以后AQP-4水平较高(P<0.05)。结论乌司他丁联合醒脑静注射液治疗可使脑出血模型兔动脉血中NSE及AQP-4含量下降,对脑出血具有一定的脑保护作用。
乌司他丁 醒脑静 脑出血 兔 神经特异性烯醇化酶 水通道蛋白4
脑出血(ICH)占全部脑卒中发病率的12%~15%,具有高发病率、高死亡率、高致残率的特点,但ICH治疗近年来无明显进展[1]。乌司他丁是从人类尿液中提取精制而成的糖蛋白,具有抑制多种酶、稳定细胞膜和溶酶体膜、抑制溶酶体酶的活性及释放等作用。醒脑静注射液(XNJ)是ICH后被广泛应用的中药提取物注射液,众多临床及动物实验均提示其对ICH后脑细胞具有保护作用。迄今为止,临床上在ICH后继发性损伤治疗方案上一直缺乏突破性进展,有效的西医内科治疗药物局限[2]。众多研究表明,水通道蛋白4(AQP-4)是参与脑水肿形成的一个关键指标[3]。神经元特异性烯醇化酶(NSE)是目前临床上广泛用于早期检测脑损伤的指标,是神经元损伤的标志酶。本实验旨在探讨乌司他丁联合XNJ治疗ICH时在AQP-4及NSE方面的脑保护作用。现报告如下。
1 材料与方法
1.1 动物 选用健康成年新西兰兔,雌雄不限,体质量(3.06±0.29)kg,由浙江省农业科学院提供,许可证号:SCXK(浙)2010-0047。饲养期间给予啮齿类动物标准颗粒饲料及饮水,自主进食。温度(23.31±10.51)℃,湿度50%~70%,正常昼夜节律,噪音<50 dB,通风,单笼饲养。实验过程中对动物的处置符合动物伦理学标准。
1.2 药物及试剂 乌司他丁注射液 (规格为10万单位/2 mL,批号为031301064)产自广东天普生化医药股份有限公司。兔NSE酶联免疫检测试剂盒(R&D公司)(批号:Ra87451L)及兔AQP-4酶联免疫检测试剂盒(R&D公司)(批号:Ra37741L)均购买自杭州达文生物有限公司。XNJ(10 mL/支,批号:130125)产自无锡济民可信山禾药业股份有限公司。
1.3 模型制备 将符合实验标准的新西兰兔,参照文献[4]的方法加以改良:戊巴比妥钠(30 mg/kg)耳缘静脉麻醉,头部剃毛,俯卧位固定于兔脑立体定位仪上。手术暴露颅骨十字缝和人字缝。参照Sawyer兔脑立体定位图谱[5]确定内囊位置:AP 1 mm,R 6 mm,H 13 mm。选取十字缝交叉点为基点沿冠状缝向右旁开6mm再平行矢状缝向前1mm为穿刺进针点。在兔耳中央动脉采取自体未凝动脉血0.5 mL,用9号腰穿针快速垂直于颅骨穿入脑实质,进针深度13 mm,3 min之内缓慢注入,停针5 min后缓慢拔针。局部压迫止血,缝合皮肤,造模完成。将造模成功的40只新西兰兔按照随机数字表随机分为4组,每组10只:模型组、乌司他丁组、醒脑静组以及联合组。
1.4 给药方案 模型组造模成功后予以0.9%氯化钠注射液2 mL;乌司他丁组予以乌司他丁注射液1.7万U/kg(相当于成人用药量3倍剂量)加入2 mL 0.9%氯化钠注射液中;醒脑静组予以XNJ 2 mL;联合组予以乌司他丁注射液1.7万U/kg加入2 mL 0.9氯化钠注射液中,XNJ 2 mL,二者交替注射给药。各组均静脉注射给药,每日3次,连续7 d。
1.5 标本采集与检测 于造模前(0 d)及造模后第1、3、5、7日,分别为各组动物采集动脉血,离心后收集血清,严格按照试剂盒说明书采用ELISA法检测血清NSE及AQP-4的含量。
1.6 统计学处理 应用SPSS17.0统计软件。数据以(±s)表示,采用单因素方差分析及t检验法。P<0.05为差异有统计学意义。
2 结 果
2.1 各组脑出血模型兔不同时间NSE水平比较 见表1。造模成功后各组NSE水平均升高,与模型组比较,各组第1日差异均无统计学意义(P>0.05);而第3、5、7日各组NSE水平均下降(P<0.05)。与联合组比较,乌司他丁组及醒脑静组第1、3、5日NSE水平差异均无统计学意义(P>0.05);第7日,乌司他丁组及醒脑静组NSE水平均较高(P<0.05)。
表1 各组脑出血模型兔不同时间神经特异性烯醇化酶水平比较(ng/mL,±s)

表1 各组脑出血模型兔不同时间神经特异性烯醇化酶水平比较(ng/mL,±s)
与模型组同时间比较,*P<0.05;与联合组同时间比较,△P<0.05。下同。
组别 n 0 d 1 d 3 d 5 d 7 d模型组 1 0乌司他丁组 1 0醒脑静组 1 0 4 . 2 8 ± 0 . 0 7 4 . 2 9 ± 0 . 2 2 4 . 2 7 ± 0 . 3 1 6 . 0 2 ± 0 . 1 4 6 . 3 3 ± 0 . 5 8 6 . 0 9 ± 0 . 2 0 5 . 9 8 ± 0 . 4 0 5 . 8 7 ± 0 . 2 0 5 . 5 5 ± 0 . 2 2*5 . 3 1 ± 0 . 1 9*5 . 0 1 ± 0 . 1 6*△5 . 8 8 ± 0 . 2 2 5 . 6 3 ± 0 . 3 0*5 . 1 2 ± 0 . 2 1*5 . 3 6 ± 0 . 2 4*△联合组 1 0 4 . 2 8 ± 0 . 1 8 5 . 9 9 ± 0 . 3 1 5 . 2 8 ± 0 . 3 4*5 . 0 3 ± 0 . 2 2*4 . 4 4 ± 0 . 2 0*
2.2 各组脑出血模型兔不同时间AQP-4水平比较见表2。造模成功后各组AQP-4水平均升高,与模型组比较,联合组第1日,乌司他丁组第1、3、5日,醒脑静组第1、3日的AQP-4水平差异均无统计学意义(P>0.05);联合组第3、5、7日,乌司他丁组第7日,醒脑静组第5、7日的AQP-4水平下降(P<0.05)。与联合组比较,乌司他丁组第1、3日及醒脑静组第1、3、5、7日差异均无统计学意义(P>0.05);乌司他丁组第5、7日AQP-4水平较高(P<0.05)。
表2 各组脑出血模型兔不同时间AQP-4水平比较(ng/mL,±s)
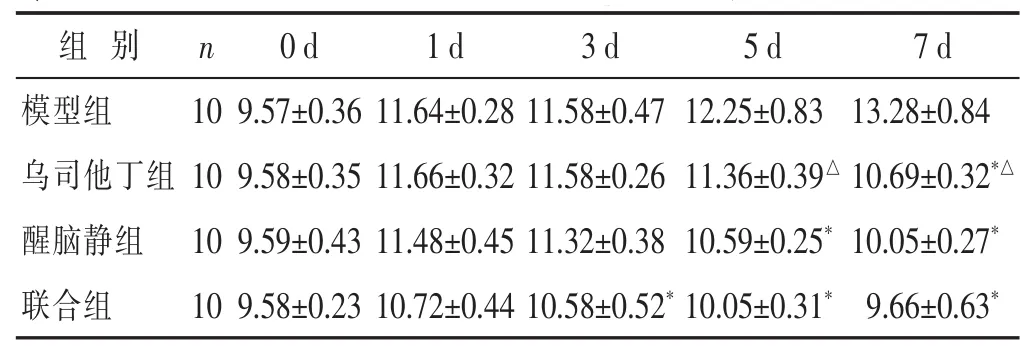
表2 各组脑出血模型兔不同时间AQP-4水平比较(ng/mL,±s)
组别 n 0 d 1 d 3 d 5 d 7 d模型组 1 0乌司他丁组 1 0醒脑静组 1 0 9 . 5 7 ± 0 . 3 6 9 . 5 8 ± 0 . 3 5 9 . 5 9 ± 0 . 4 3 1 1 . 6 4 ± 0 . 2 8 1 1 . 5 8 ± 0 . 4 7 1 2 . 2 5 ± 0 . 8 3 1 3 . 2 8 ± 0 . 8 4 1 1 . 6 6 ± 0 . 3 2 1 1 . 5 8 ± 0 . 2 6 1 1 . 3 6 ± 0 . 3 9△1 0 . 6 9 ± 0 . 3 2*△1 1 . 4 8 ± 0 . 4 5 1 1 . 3 2 ± 0 . 3 8 1 0 . 5 9 ± 0 . 2 5*1 0 . 0 5 ± 0 . 2 7*联合组 1 0 9 . 5 8 ± 0 . 2 3 1 0 . 7 2 ± 0 . 4 4 1 0 . 5 8 ± 0 . 5 2*1 0 . 0 5 ± 0 . 3 1*9 . 6 6 ± 0 . 6 3*
3 讨 论
ICH后脑损伤的病情进展不仅与出血量和出血部位(血肿的机械压迫和占位效应)有关,ICH的病理机制提示血肿对周围脑组织的压迫,血肿的分解产物,以及脑组织损害释放的多种血管活性物质是ICH后脑组织损伤的主要原因,可以导致脑水肿、颅内压增高、继发性血肿周围脑灌注不足以及凝血纤溶系统的改变。XNJ是由安宫牛黄丸减味制成的中药注射剂,组方包含冰片、麝香、栀子等[6]。它通过静脉给药可透过血脑屏障(BBB)直接作用于中枢神经系统。其中麝香气味芳香,善于走窜,具有良好的开窍通闭性能,可增进大脑功能,兴奋中枢神经系统。冰片具有清热解毒止痛功效,能协助麝香发挥兴奋中枢神经系统功能,诸药相配,起到醒脑止痉、清热凉血、行气活血和解毒止痛等功效[7]。现代研究表明麝香的有效成分是麝香酮,它可以减轻脑缺血大鼠超微结构的损伤和降低神经功能缺损程度[8],石菖蒲、冰片合用可以抑制颅脑损伤后脑内细胞黏附分子的表达,减轻脑组织的炎症反应、外伤性脑水肿和神经细胞缺氧性损伤[9]。乌司他丁是一种具有广谱蛋白酶抑制作用的糖蛋白,由肝脏分泌,属于人体内源性抑炎物质,代谢后进入尿液,它能够结合如粒细胞弹性蛋白酶和胰蛋白酶、α-糜蛋白酶等丝氨酸蛋白酶等多种酶类,结合后抑制酶的活性,并促进其降解;同时可稳定溶酶体膜,抑制体内多种蛋白酶,清除氧自由基,抑制机体的过度炎症反应,减少组织细胞损伤,改善组织循环灌注。有研究认为XNJ联合乌司他丁对重症胰腺炎大鼠脑损伤有较好的保护作用[10]。
水通道蛋白(AQPs)是一种膜蛋白,对水的通透性具有高度选择性,水分子可以通过水通道向高渗方向移动[11]。到目前为止,已从哺乳动物组织中鉴定出13种AQPs(AQP-0~12),其中AQP-4是脑组织中含量最多的水通道蛋白,主要分布于星形胶质细胞膜,特别是在紧密包绕毛细血管壁形成的一层胶质界膜上有着强烈的表达[12]。依据其分布特点我们可以推测AQP-4与BBB的功能及脑水肿的发生密切相关,可调节脑脊液及脑组织中的水液代谢。Manley等[13]研究认为,ICH后血肿周围AQP-4表达增高可导致BBB通透性受损,提示AQP-4的动态变化与脑水肿的发生和发展密切相关。研究认为[14],AQP-4表达升高可引起血管内水分通过BBB进入脑组织,导致BBB破坏,进而加重脑水肿。刘亚敏等[15]实验表明大鼠全脑缺血再灌注后,脑微血管的通透性增加,出现了以血管源性为主的脑水肿,证实了AQP-4参与了脑水肿的发展过程,抑制AQP-4的表达会减轻脑水肿的程度。张青等[16]研究表明在全血诱导的ICH周围脑组织出现不同程度的神经细胞水肿变性、坏死,间质水肿明显,且AQP-4表达明显增加,阳性细胞主要在星形胶质细胞足突上表达。范丽娜等[17]研究表明XNJ可以降低全脑缺血性昏迷大鼠模型AQP-4 mRNA水平。药理学研究[18-19]已证明XNJ能通过BBB,直接作用于中枢神经系统而发挥作用,有消除脑水肿、防止脑疝、改善大脑血氧供应、促进脑细胞康复等作用。XNJ的早期应用具有减轻脑水肿、保护神经细胞的作用,其作用机理可能与下调AQP-4的表达有关。研究表明[20],凝血酶是血液凝固过程中形成的一种具有毒性介质特性的蛋白水解酶,大量凝血酶的释放在诱导ICH周围组织损伤,特别是早期脑水肿的发生发展过程中发挥重要作用。ICH后血肿持续性释放的凝血酶在继发性脑损伤过程中发挥着重要的作用,可通过激活凝血酶受体(PAR),影响AQP-4的功能,从而加剧ICH后脑组织水肿[21]。UTI可抑制体内多种蛋白酶。陈珊等[22]研究显示UTI联合甘油果糖可降低大鼠ICH后脑组织AQP-4的表达,从而改善脑水肿。本研究显示,在降低AQP-4方面,治疗第1日,3组均无效;UTI组第7日出现疗效;醒脑静第5、7日显效;联合组第3、5、7日均有效,提示醒脑静在降低血清AQP-4方面优于乌斯他汀组,而二药联用效果更明显。
NSE属于糖酵解同工酶二聚体,在神经细胞的细胞质中浓度较高,颅脑损伤时血清中NSE含量会升高。目前研究认为NSE含量升高的主要原因是损伤导致神经元细胞膜功能与结构受损,NSE从神经元胞浆中释放出来,进入脑脊液和细胞间隙中,透过破损的血脑屏障NSE进入血液循环,因此,血清NSE与脑损伤的严重程度密切相关,具有较高特异性和敏感性,对脑损伤的诊断及伤势的评估具有重要的临床价值。有研究证实NSE和脑部损伤的严重范围及程度呈正相关,即 NSE越高,脑损伤包括亚临床损伤越严重[23]。Fassbender等[24]动态监测脑损伤患者血浆中NSE,结果显示血浆NSE含量与临床预后相关。于宗明等[25]研究提示乌司他汀可明显降低ICH患者的NSE水平,从而减轻脑损伤。李绵绵等[26]研究提示急司他汀的应用可减少婴幼儿体外循环术后血浆NSE和S100蛋白的释放,减轻脑损伤。韩潇等[27]实验研究提示乌司他汀能够降低体外循环家兔模型的NSE水平,对其有脑保护作用。涂悦等[28]研究表明醒脑静组血清中NSE水平明显低于模型组,提示XNJ对大鼠颅脑损伤具有保护作用,其作用机制可能与减轻颅脑损伤后脑水肿及抑制氧自由基反应、保护神经细胞有关。孟宜良等[29]研究发现应用XNJ治疗的ICH患者,其血清NSE水平较对照组下降明显,提示XNJ可有效抑制ICH后炎症反应,减轻神经损害,对急性ICH患者可发挥积极治疗作用。本研究结果显示在降低NSE方面,治疗第1日3组药物均无明显疗效;而第3~7日均显示有效;第3~5日3组疗效相仿,无明显统计学差异;治疗第7日时联合组比乌司他丁组及醒脑静组效果好,有统计学差异,提示乌司他丁联合XNJ在降低NSE方面比单药效果好。
综上所述,乌司他丁联合XNJ治疗可使ICH模型兔动脉血中NSE及AQP-4含量下降,能减轻血管源性脑水肿、保护神经元细胞膜功能及结构、维持血脑屏障完整,对ICH具有一定的脑保护作用。中西医结合治疗ICH方面的优势需要进一步深入研究。
[1] 邓平,吴晓牧.高血压脑出血的病理生理研究进展[J].中华脑血管病杂志:电子版,2010,4(4):267-278.
[2] Hua Y,Schallert T,Keep RF,et al.Behavioral tests after intracerebral hemorrhage in the rat[J].Stroke,2002,33(5):2478-84.
[3] Lee JK,Burckart GJ.Nuclear factor kappa B:important transcription factor and therapeutic target[J].J Clin Pharmacol,1998,38(11):981-993.
[4] 张建军,刘铁.兔脑出血模型的建立及其方法比较[J].浙江临床医学,2007,9(9):727-728.
[5] Sawyer CH,Everett JW,Green T.The rabbit diencephalon in stereo taxic coordinates[J].Comp Neurol,1954,101(3):801-824.
[6] 王拥军.神经病学临床评定量表[M].北京:中国友谊出版社,2005:283.
[7] 罗侃,刘苏中,徐润,等.临床应用醒脑静注射液的综合总结[J].中国中医急症,1997,6(3):119-120.
[8] 梁辉,陈虎,高颖,等.麝香酮抗局灶性脑缺血损伤的实验研究[J].中成药,2003,25(3):225-227.
[9] 蒋红兰,匡忠生,李翎,等.石菖蒲冰片对神经细胞缺氧性损伤的保护作用[J].广州中医药大学学报,2003,20(1):63-65.
[10]王小红,胡江鸿,沈云志.醒脑静联合乌司他丁对重症急性胰腺炎大鼠脑损伤的保护作用[J].天津医药,2013,41(4),349-352.
[11] Echevarria M,Munoz-cabello AM,Sanchezsilva R,et al. Development of cytosolic hypoxia and hypoxiainducible factor stabiliazation are facilitated by aquaporin-1 expression[J].J Biol Chem,2007,282(41):30207-30215.
[12]Borgnia M,Nielson S,Engel A,et al.Cellular and molecular biology of the aquaporin water channels[J].Annu Rev Biochem,1999,68(4):425-458.
[13]Man ley CT,Fujimura M,Ma T,et al.Aquaporin-4 delection in mice reduces brain edema after acute water intoxication and is chemic stroke[J].Nat Med,2000,6(2):159-163.
[14]Solenov E,Watanabe H,Manley GT,et al.Sevenfold-reduced osmotic water permeability in primary astrocyte cultures from AQP-4-deficient mice,measured by a fluorescence quenching method[J].American Journal of Physiology-Cell Physiology,2004,286(2):426-432.
[15]刘亚敏,张赐安,徐秋英,等.全脑缺血再灌注大鼠脑组织水通道蛋白-4 mRNA的表达及药物对其影响[J].中国中医急症,2002,11(6):474-475.
[16]张青,谢晓丽,王其新,等.醒脑静合生脉注射液对大鼠脑出血后脑组织内水通道蛋白表达的影响[J].中国实验方剂学杂志,2012,18(21):243-247.
[17]范丽娜,胡风云,王春芳,等.缺血性昏迷的实验研究[J].世界中西医结合杂志,2014,9(4):368-374.
[18]徐元虎.醒脑静注射液的药理药效学研究与临床应用现状[J].现代中西医结合杂志,2010,19(4):507.
[19]刘洪章,马志伟,刘毅,等.醒脑静注射液辅助治疗继发性脑损伤[J].中国实验方剂学杂志,2011,17(15):248.
[20]Keep RF,Xi G,Hua Y,et al.The deleterious or beneficial effects of different agents in intracerebral hem orrhage:think big,think small,or is hematoma size important[J].Stroke,2005,36(12):1594-1596.
[21] Tang Y,Cai D,Chen Y.Thrombin inhibits aquaporin 4 expression through protein kinase C-dependent pathway in cultured astrocytes[J].Journal of Molecular Neuroscience,2007,31(1):83-93.
[22]陈珊,徐国海,胡衍辉.乌司他丁联合甘油果糖对大鼠脑出血后水通道蛋白4的影响[J].临床麻醉学杂志,2012,28(3):278-281.
[23]Oh SH,Lee JG,Na SJ,et al.Prediction of early clinical severity and extent of neuronal damage in anterior circulation infaction using the initial serum neuron-specific enolase level[J].Aach Neurol,2003,60(1);37-41.
[24] Fassbender K,Sehmidt R,Sehrcincr A,et al.Leakage of brainoriginated proteins in peoteins in pefipheral blood:temporal profile and diagnose-tic value in early ischcmic stroke[J].J Nerrol Sci,1997,148(1):101-105.
[25]于宗明,李湘青.乌司他丁对脑出血患者血清hs-CRP和NSE的影响[J].山东医药,2013,53(37):64-65.
[26]李绵绵,楼文文,梅永成.乌司他丁对婴幼儿体外循环心脏病人血浆NSE和S100蛋白的影响[J].现代实用医学,2008,20(9):679-681.
[27]韩潇,王莹洁,朱昌来.醒脑静注射液在体外循环家兔的脑保护作用[J].江苏医药,2014,40(3):258-260.
[28]涂悦,杨细平,商崇智,醒脑静对颅脑创伤的保护作用[J].中国应用生理学杂志,2014,30(3):230-236.
[30]顾怀金,李根,万东.醒脑静注射液治疗急性脑出血的临床疗效及对血清hs-CRP和NSE的影响[J].中国实验方剂学杂志,2014,20(14):178-181.
Effects of Ulinastatin Combined with Xingnaojing injection on Neuron Specific Enolase and Aquaporin-4 of the Incerebral Hemorrhage Model in Rabbit
TONG Liyan,JIN Xin,HU Caibao,et al. Hangzhou Traditional Chinese Medical Hospital,Zhejiang,Hangzhou 310007,China
Objective:To observe the effect of ulinastatin(UTI)combined with xingnaojing(XNJ)injection on serum neuron-specific enolase(NSE)and Aquaporin-4(AQP-4)on rabbit model of incerebral hemorrhage.Methods:40 successful model of New Zealand rabbits were randomly divided into 4 groups,each group of 10:incerebral hemorrhage model group(Group M)and UTI in treatment group(Group U)and XNJ in treatment group(Group X)and UTI combined with XNJ in treatment group(Group UX).The contents of NSE and AQP-4 in arterial blood of each rabbit were checked by ELISA method at before modeling(0 d),and treatment 1st,3rd,5th,7thday.Results:NSE and AQP-4 levels were elevated after the success of modeling.Compared with Group M,at the 1st day,the level of NSE and AQP-4 of each group was no significant statistical difference(P>0.05);At the 3rd to 7thdays,NSE of each group was decreased,there was statistically significant(P<0.05);AQP-4 of Group U at 7thday and Group X at 5thto 7thdays and Group UX at 3rd to 7th days were all declined,there are statistically significant(P<0.05).Compared with UX group,at the 7th day,NSE level of Group U and Group X were higher,there was statistically significant,(P<0.05);AQP-4 of Group X were no significant statistical difference(P>0.05);AQP-4 of Group U was higher at 5th and 7th days,there was significant difference(P<0.05).Conclusion:UTI combined with XNJ treatment can make the incerebral hemorrhage model in rabbit arterial blood NSE and AQP-4 declined,has certain brain protective effect on incerebral hemorrhage.
Ulinastatin;Xingnaojing;Incerebral hemorrhage;Rabbit;NSE;AQP-4
R285.5
A
1004-745X(2015)04-0586-04
10.3969/j.issn.1004-745X.2015.04.007
2014-11-20)
天普科学研究基金资助项目 (01200919);浙江省科技厅重症医学科技创新团队项目(2011R50018-02);浙江省医药卫生科技计划研究项目(2013KYB004);浙江省中医药卫生科技计划研究项目(2014ZB091)
△通信作者(电子邮箱:zjicu1996@163.com)
