蓝莓叶总黄酮的体外抗炎功效评价
2015-01-03郑洪艳王昌涛
赵 丹,苏 宁,杨 丽,郑洪艳,霍 彤,王昌涛,*
蓝莓叶总黄酮的体外抗炎功效评价
赵 丹1,苏 宁2,杨 丽2,郑洪艳2,霍 彤1,王昌涛1,*
(1.北京工商大学理学院,北京 100048;2.中国检验检疫科学研究院,北京 100176)
目的:通过体外实验方法从分子水平对蓝莓叶总黄酮的抗炎功效进行评价。方法:建立人永生化表皮细胞HaCaT与蓝莓叶总黄酮的共培养体系,利用反转录实时荧光定量聚合酶链式反应检测在不同培养时间点(0、15、30、60、120 min)白细胞介素-6(interleukin-6,IL-6)、IL-8、干扰素诱导蛋白-10(interferon-inducible prot ein-10,IP-10)等炎症细胞因子相关基因表达情况,观察蓝莓叶总黄酮的添加对这些基因表达的影响,并探讨蓝莓叶总黄酮在分子水平上的抗炎机理。结果:蓝莓叶总黄酮的添加能够提高抗炎因子IL-6、CXCR-2基因的表达量(P<0.05),降低促炎因子IL-8、IP-10基因的表达量(P<0.05),对CXCR-1基因的表达呈复杂型调节。结论:蓝莓叶总黄酮通过对炎症相关因子表达量产生影响,从而减弱促炎症反应,增强抗炎症反应,最终发挥抗炎功效。
蓝莓叶总黄酮;炎症因子;反转录实时荧光定量聚合酶链式反应;抗炎
由于动物实验所存在的伦理问题以及国际上对动物福利的日益关注,发展新的体外实验方法用以减少、优化和替代(reduction, refinement, replacement,3R理论)动物实验成为当前研究的热点。反转录实时荧光定量聚合酶链式反应(real-time reverse transcription quantitative polymerase chain reaction,RT-qPCR)技术因其具有特异性强、灵敏度高以及重复性好等优势,在动物替代实验领域发挥了日益重要的作用。此技术不仅避免了PCR产物污染产生的假阳性结果和非特异性扩增问题,同时还能够对标本模板进行精确定量[1-2]。
皮肤在受到外界药物刺激后会发生炎症反应。 在这个过程中,白细胞介素-6(interleukin-6,IL-6)、IL-8、干扰素诱导蛋白-10(interferon-inducible protein-10,IP-10)等炎症因子和趋化因子的相关基因表达会受到影响。IL-6能够刺激参与免疫反应的细胞增殖、分化并提高其功能活性;IL-8是巨噬细胞和上皮细胞等分泌的细胞因子,与其受体CXCR-1和CXCR-2结合而对中性粒细胞产生细胞趋化作用,从而实现对炎症反应的调节[3-5]。
本实验利用反转录实时荧光定量PCR技术,检测在人类永生化表皮细胞HaCaT培养体系中蓝莓叶总黄酮的添加对这些细胞因子表达量的影响,从而进一步对这些细胞因子的表达与皮肤炎症反应的关系进行研究。
1 材料与方法
1.1材料与试剂
HaCaT细胞,购自上海斯信生物科技有限公司。
DMEM低糖培养基、二甲基亚砜 德国Sigma公司;胎牛血清 美国Gibco公司;青霉素-链霉素双抗(100×) 美国Corning公司。
1.2仪器与设备
WJ-80A-ⅡCO2培养箱 上海圣科仪器设备有限公司;ABI 7300型实时荧光定量PCR仪、GeneAmp PCR System 9700美国ABI应用生物系统公司;Enduro水平电泳仪 美国Labnet公司;3-30K台式高速冷冻离心机、1-14微型离心机 德国Sigma公司;SW-CJ-1D超净工作台 上海启前电子科技有限公司;细胞培养瓶、细胞培养瓶板、细胞冻存管 美国Corning/Costar公司。1.3方法
1.3.1细胞培养及处理
从-80℃冰箱中取出待用冻存的HaCaT细胞,迅速置于37℃水浴中解冻,在1~2 min内轻微振动使其融化。1 000 r/min离心10 min,弃去上清液,在沉淀中加入1 mL DMEM完全培养液,转移至25 cm2培养瓶中,37℃、5%CO2培养。当细胞生长至90%融合时,用2 mL磷酸盐缓冲液(phosphate buffered saline,PBS)轻柔清洗两次,加入200μL0.25%胰酶后放入CO2培养箱中消化5 min,放到显微镜下观察,当确认细胞从培养瓶壁上脱落后,加入2 mL DMEM完全培养液终止消化,800 r/min离心10 min,弃去上清液,加入4 mL培养液,进行细胞计数后,以5×105个/cm2的密度接种于25 cm2培养瓶中。
将消化后的HaCaT细胞以2×106个/孔的密度接种于6孔板内,以60μg/mL质量浓度蓝莓叶总黄酮处理细胞0、15、30、60、120 min。
1.3.2细胞总RNA提取与检测
待细胞密度长至80%时,冰浴条件下,依次加入1 mL Trizol、0.2 mL氯仿,手摇振荡2 min;4℃、8 000 r/min离心15 min,取上层水相,加入等体积异丙醇(约700μL),振荡,静置15 min;12 000 r/min离心10 min,弃去上清液,向沉淀中加入1 mL 70%乙醇洗涤,8 000 r/min离心10 min;重复进行1次乙醇洗涤;室温条件下干燥15 min,加入40μL经焦碳酸二乙酯(diethyl pyrocarbonate,DEPC)处理的ddH2O,溶解10 min后于-80℃保存[6-7]。
琼脂糖凝胶电泳检测RNA:将样品和Marker加至凝胶上样孔,180 V电压电泳10 min。
1.3.3 cDNA第一链合成
使用TINAGEN FastQuantRTKit(含gDNase)FastQuant cDNA第一链合成试剂盒(去基因组)进行cDNA第一条链合成反应。
1.3.4反转录实时荧光定量PCR分析
1.3.4.1引物设计
根据NCBI中发布的IL-6、IL-8、IP-10等基因的序列,通过Primer Express软件设计特异性引物,同时设计管家基因β-actin的特异性引物,各基因的引物序列见表1。

表1 qRT-PCR引物序列Table1 Primer sequences for qRT-PCR
1.3.4.2 反转录实时荧光定量PCR反应
以cDNA为模板,按照表2配制RT-qPCR反应体系(使用前,在1 mL PrimeScriptRTEnzyme MIX中加入40μL的ROX Reference Dye),用ddH2O将反应体系补足到20μL,分析IL-6、IL-8、IP-10等基因的表达量。

表2 反转录实时荧光定量PCR反应体系Table2 Real time fluorescence quantitative reverse transcription PCRTable2 Real time f reaction system stem
2 结果与分析
2.1 HaCaT细胞培养
图1为HaCaT细胞培养贴壁前后形态比较,贴壁前HaCaT细胞为规则的圆球体状,透明饱满,且可随培养液流动。当培养2~4 h以后,HaCaT细胞开始呈现出片层状态贴壁生长,单个细胞形态不规则,其形态会因其所处培养空间大小的具体情况不同而变化;另一方面,随着培养液中营养物质的消耗和HaCaT细胞自身生长过程中代谢物的产生,培养液的颜色(随pH值变化)和细胞中内容物的颜色也与贴壁前的HaCaT细胞有了显著的差别。这就决定了一定时间内需要根据培养瓶或者培养板中HaCaT细胞生长的具体情况,而定期换新鲜培养液或者进行传代培养,才能保证HaCaT细胞良好的生长状态。

图1 HaCaT细胞培养贴壁前(a)后(b)的形态(20×)Fig.1 HaCaT cells before (a) and after (b) attached culture (20 ×)
HaCaT细胞对生长环境的要求相对其他动物细胞较为宽泛。HaCaT细胞增殖速率快,培养2~4 h即可贴壁,36 h左右需要进行传代。细胞快速地增殖会引起培养液中营养物质在短时间内被大量消耗,限制了细胞进一步生长。因此,在考察蓝莓叶总黄酮对HaCaT细胞的影响时,培养时间不宜过长。综合考虑,本实验中选取培养时间分别为0、15、30、60、90、120 min,在以上6个时间点对添加蓝莓叶总黄酮的HaCaT细胞生长状况进行考察。
2.2 HaCaT细胞总RNA的提取

图2 HaCaT细胞总RNA琼脂糖凝胶电泳检测结果Fig.2 Electrophoresis of total RNA from HaCaT cells
采用1.0%琼脂糖凝胶电泳对提取的HaCaT细胞RNA进行完整性检测。如图2所示,28S rRNA与18S rRNA带型清晰。另经紫外分光光度计测定,所提取HaCaT细胞RNA的A260nm/A280nm介于1.8~2.0之间,RNA质量高,完整性好,适于反转录实时荧光定量PCR研究[8]。
严格来说,以拉斐尔前派画家之名而为人所熟知的罗塞蒂的拉斐尔前派创作期,至此已经结束了。人们应该看到,在拉斐尔前派那原本就模糊不清的理想幻灭之后,罗塞蒂绘画中的逃亡意识开始明确:他在相当长一段时间里都使用古老的水彩作画,并专注于但丁与比阿特丽丝等中世纪题材。
2.3 RT-qPCR炎症因子特异性引物的检测
利用设计的β-actin、IL-6和IL-8的引物对目标产物进行检测,结果如图3所示。以反转录得到的cDNA为模板,通过设计的引物进行扩增,得到的产物利用1%琼脂糖凝胶电泳进行检验,得到条带单一的、片段大小与预期目的条带大小一致的特异性引物,可进行下一步RT-qPCR的实验。

图3 炎症因子IL-6、IL-8特异性引物检测结果Fig.3 Electrophoresis of PCR amplified products with specific primers for β-actin, IL-6 and IL-8
2.4 RT-qPCR实验结果
以HaCaT细胞为研究对象,考虑到其炎症因子相关基因表达量变化的时间大多在2 h以内[9],并且综合HaCaT细胞生长情况,本实验选择2 h以内作为蓝莓叶总黄酮处理HaCaT细胞的考察时间。
2.4.1蓝莓叶总黄酮对HaCaT细胞炎症因子类基因表达的影响
2.4.1.1蓝莓叶总黄酮对HaCaT细胞IL-6表达的影响

图4 蓝莓叶总黄酮处理不同时间对HaCaT细胞IL--66表达量的影响Fig.4 Influence of treatment time with blueberry leaf extracts on IL-6 expression
2.4.1.2蓝莓叶总黄酮对HaCaT细胞IL-8表达的影响

图5 蓝莓叶总黄酮处理不同时间对HaCaT细胞IL--88表达量的影响Fig.5 Influence of treatment time with blueberry leaf extracts on IL-8 expression
蓝莓叶总黄酮对HaCaT细胞IL-8表达量的影响如图5所示,培养时间在15 min内,HaCaT细胞IL-8表达量迅速下降,并在30 min内保持缓慢下降的趋势,在30~90 min内又缓慢上升,但远小于空白组,而在90~120 min的培养时间内,IL-8表达量又有下降趋势。整体来看,蓝莓叶总黄酮对IL-8基因表达的影响主要体现在培养0~15 min内迅速抑制其表达,并在120 min的培养时间内总体保持抑制其表达的作用。对不同时间段IL-8表达量进行分析,发现与空白组相比,培养至15、30 min时,HaCaT细胞IL-8表达量极显著降低(P<0.01),而培养至60~120 min时,IL-8表达量稍有回升,但仍显著低于空白组(P<0.05),这表明蓝莓叶总黄酮对HaCaT细胞IL-8的表达具有抑制作用。IL-8在许多炎症中具有聚集和激活T淋巴细胞、白细胞和血管内皮细胞的功能,局部产生的IL-8可以直接作用于表皮细胞,促进慢性炎症的发展[11]。IL-8表达量的升高会使大量中性粒细胞向炎症区域聚集,释放炎症介质而加重炎症反应[12-13]。蓝莓叶总黄酮抑制了IL-8的表达,从而间接地抑制了炎症的发生和发展。
2.4.2蓝莓叶总黄酮对HaCaT细胞趋化因子相关基因表达的影响
2.4.2.1蓝莓叶总黄酮对HaCaT细胞CXCR-1和CXCR-2表达的影响
CXCR-1和CXCR-2是CXCR家族中的两个重要成员,属G蛋白偶联受体超家族成员。CXCR-1和CXCR-2会表达在正常的人内皮细胞表面,在急性炎症反应过程中,趋化因子能够促进内皮细胞释放大量促炎细胞因子[14]。
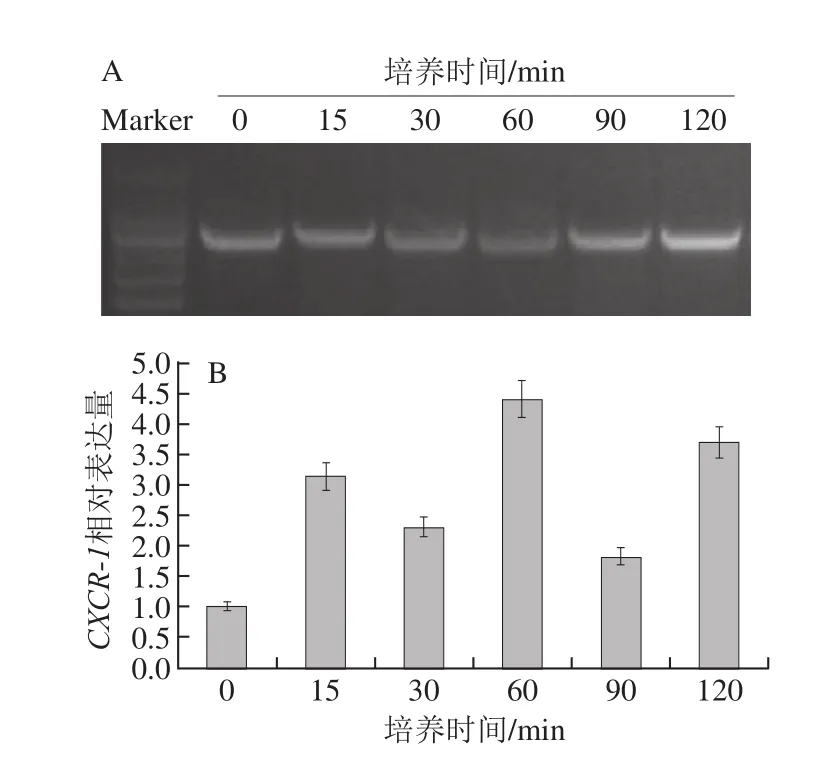
图6 蓝莓叶总黄酮处理不同时间对HaCaT细胞CXCR--11表达量的影响Fig.6 Influence of treatment time with blueberry leaf extracts on CXCR-1 expression
如图6所示,添加蓝莓叶总黄酮后,HaCaT细胞CXCR-1的表达量在培养15 min内有明显升高的趋势,随后的培养过程中,CXCR-1的表达量被间隔性地促进和抑制,但总体水平都是高于空白组。对不同培养时间段HaCaT细胞CXCR-1表达量进行统计学分析,发现与空白组相比,在培养的120 min内,HaCaT细胞CXCR-1表达量的变化均不显著(P>0.05)。以上结果表明,蓝莓叶总黄酮对HaCaT细胞CXCR-1的表达有一定促进作用,但在促进和抑制间存在一定的动态平衡。

图7 蓝莓叶总黄酮处理不同时间对HaCaT细胞CXCR--22表达量的影响Fig.7 Influence of treatment time with blueberry leaf extracts on CXCR-2 expression
如图7所示,添加蓝莓叶总黄酮后,HaCaT细胞CXCR-2的表达量在培养15 min内有平缓的升高,在随后培养的15~90 min内,保持在较高的水平,而在培养的90~120 min内,CXCR-2的表达量显著升高(P<0.05)。以上结果表明,蓝莓叶总黄酮对HaCaT细胞CXCR-2的表达是起促进作用的。
2.4.2.2蓝莓叶总黄酮对HaCaT细胞IP-10表达的影响

图8 蓝莓叶总黄酮处理不同时间对HaCaT细胞IP-10表达量的影响Fig.8 Influence of treatment time by blueberry leaf extracts on IP-10 expression
如图8所示,添加蓝莓叶总黄酮后,HaCaT细胞IP-10表达量在培养15 min内迅速下降,并且在90 min的培养时间内保持在一个相当低的水平。虽然在培养至90~120 min内,HaCaT细胞IP-10表达量有一定的升高,但是与空白组相比仍是受到抑制的。经统计学分析发现,与空白组相比,培养至15、30 min时,HaCaT细胞IP-10表达量显著降低(P<0.05),而培养至60、90 min时,IP-10表达量极显著降低(P<0.01),到培养120 min时,IP-10表达量稍有回升,但仍显著低于空白组(P<0.05)。以上结果表明,蓝莓叶总黄酮对IP-10基因的表达具有抑制作用。
3 结 论
炎症因子(IL-6、IL-8)和趋化因子(CXCR-1和CXCR-2、IP-10)是反映炎症反应的重要指标,在机体抗感染、抑病毒过程中起重要作用[15-16]。本实验将蓝莓叶总黄酮与HaCaT细胞共培养特定时间后,利用RT-qPCR检测相关炎症因子和趋化因子的表达情况。结果表明,蓝莓叶总黄酮对IL-6和CXCR-2基因的表达具有正向调节的作用,二者的表达量显著增加。其中,IL-6通过影响细胞内花生四烯酸的代谢而起到抗炎作用,CXCR-2通过与配体IL-8结合,启动中性粒细胞趋化反应,募集中性粒细胞,引起炎症反应,对入侵的病原体发挥吞噬杀伤和清除作用。IL-8和IP-10基因的表达受到了明显抑制,表达量大幅度降低,进而抑制了炎症的发生和发展。IP-10及其受体CXCR-3具有强大的招募中性粒细胞能力,可促进多种细胞因子的分泌,作为趋化因子介导Thl型炎症反应[17-18],蓝莓叶总黄酮的添加抑制了HaCaT细胞中IP-10的表达,从而降低了炎症反应发生的概率。而蓝莓叶总黄酮对趋化因子CXCR-1的表达则呈现出复杂型调节的作用,表现为间歇性地促进和抑制,因此,蓝莓叶总黄酮具体的抗炎作用效果还有待研究。
综合来看,在炎症反应中有诸多的炎症因子和趋化因子参与到其中,这些因子之间相互作用,联系紧密,网络系统复杂多样,所以其表达量的变化必然会相互影响[19-21]。整体来看,蓝莓叶总黄酮的添加会促进抗炎因子的表达,抑制促炎因子的表达,从而发挥其抗炎作用。但是蓝莓叶总黄酮的具体抗炎机理到目前为止还不是很清楚,有待进一步研究。本实验利用RT-qPCR法对蓝莓叶总黄酮的抗炎功效进行了初步评价,为保健品或药食同源物质的体外抗炎评价提供了新思路。
[1] GERMOLEC D R, YOSHIDA T, GAIDO K, et al. Arsenic induces overexpression of growth factors in human keratinocytes[J]. Toxicology and Applied Pharmacology, 1996, 141(1)∶ 308-318.
[2] WEISFELNER M E, GOTTLIEB A B. The role of apoptosis in human epidermal keratinocytes[J]. Journal of Drugs in Dermatology, 2003, 2(4)∶ 385-391.
[3] 魏晶, 李伟, 邵万平, 等. CXCR1/CXCR2拮抗剂G31P抗中性粒细胞介导的炎症作用研究[J]. 中华微生物学和免疫学杂志, 2010(5)∶483-486.
[4] GRAS D, TIERS L, VACHIER I, et al. Regulation of CXCR/IL-8 in human airway epithelial cells[J]. International Archives of Allergy and Immunology, 2009, 152(2)∶ 140-150.
[5] HASHIZUME M, HIGUCHI Y, UCHIYAMA Y, et al. IL-6 plays an essential role in neutrophilia under inflammation[J]. Cytokine, 2011, 54(1)∶ 92-99.
[6] 蒋艳玲, 赵明, 梁功平, 等. 1,25-二羟维生素D3对HaCaT细胞增殖活性及基因组DNA和增殖相关基因启动子甲基化水平的影响[J]. 中华皮肤科杂志, 2013, 46(12)∶ 885-888.
[7] 杨井, 陶娟, 李延, 等. 缺氧对HaCaT细胞HIF-1α, GLUT-1表达的影响及与细胞增殖的关系[J]. 中国皮肤性病学杂志, 2009, 23(10)∶621-623.
[8] 汤三妹, 杨娟, 周秋莲, 等. 猕猴桃RNA提取与RT-PCR[J]. 生物技术通报, 2006(5)∶ 67-71.
[9] 吴德全. IL-15调控HaCaT细胞增殖及分化的研究[D]. 合肥∶ 安徽医科大学, 2012∶ 14-36.
[10] TCHERAKIAN C, RIVAUD E, CATHERINOT E, et al. Pulmonary arterial hypertension related to HIV∶ is inflammation related to IL-6 the cornerstone?[J]. Revue de Pneumologie Clinique, 2011, 67(4)∶250-257.
[11] 许树长, 陈莹, 王锋, 等. IL-8及CXCR-1在反流性食管炎患者食管黏膜中的表达及意义[J]. 同济大学学报∶ 医学版, 2007, 28(5)∶ 51-54.
[12] FITZGERALD R C, ONWUEGBUSI B A, BAJAJ-ELLIOTT M, et al. Diversity in the oesophageal phenotypic response to gastrooesophageal reflux∶ immunological determinants[J]. Gut, 2002, 50(4)∶451-459.
[13] ISOMOTO H, WANG A, MIZUTA Y, et al. Elevated levels of chemokines in esophageal mucosa of patients with reflux esophagitis[J]. The American Journal of Gastroenterology, 2003, 98(3)∶ 551-556.
[14] AKCAY A, NGUYEN Q, EDELSTEIN C L. Mediators of inflammation in acute kidney injury[J]. Mediators of Inflammation, 2009. doi∶ 10.1155/2009/137072.
[15] 张如峰, 杨桂文, 安利国. 趋化因子及其受体在炎症中作用的研究进展[J]. 国际免疫学杂志, 2012, 35(3)∶ 191-196.
[16] 邢艳玲. IP-10对变应性接触性皮炎小鼠细胞因子表达影响的研究[D].天津∶ 天津医科大学, 2009∶ 15-31.
[17] FUENTE M, MIQUEL J. An update of the oxidation-inflammation theory of aging∶ the involvement of the immune system in oxiinflamm-aging [J]. Current Pharmaceutical Design, 2009, 15(26)∶3003-3026.
[18] 夏世金, 沈自尹, 董竞成. 老年大鼠下丘脑-垂体-肾上腺轴炎性衰老相关基因表达特征[J]. 老年医学与保健, 2009, 15(1)∶ 7-9.
[19] 郑梅竹. 罗布麻叶总黄酮抗抑郁作用及其机制研究[D]. 长春∶ 吉林大学, 2011∶ 40-106.
[20] SASAKI M, IKEDA H, SATO Y, et al. Proinflammatory cytokineinduced cellular senescence of biliary epithelial cells is mediated via oxidative stress and activation of ATM pathway∶ a culture study[J]. Free Radical Research, 2008, 42(7)∶ 625-632.
[21] BARTEK J, HODNY Z, LUKAS J. Cytokine loops driving senescence[J]. Nature Cell Biology, 2008, 10(8)∶ 887-889.
In vitro Anti-inflammatory Effect of Total Flavonoids from Blueberry Leaves
ZHAO Dan1, SU Ning2, YANG Li2, ZHENG Hongyan2, HUO Tong1, WANG Changtao1,*
(1. School of Science, Beijing Technology and Business University, Beijing 100048, China; 2. Chinese Academy of Inspection and Quarantine, Beijing 100176, China)
Purpose∶ To evaluate thein vitroanti-inflammatory potential of total flavonoids from blueberry leaves. Methods∶a co-culture system of HaCaT cell and flavonoids were constructed. To examine the effect of flavonoids on the expression of inflammatory cytokines including interleukin 6 (IL-6), interleukin-8 (IL-8), and interferon induced protein 10 (IP-10), realtime reverse transcription quantitative PCR (RT-qPCR) was used to detect the expression of the related genes after co-culture for different periods of time(0, 15, 30, 60, and 120 min). The anti-inflammatory mechanism of flavonoids from blueberry leaves was analyzed at the molecular level. Results∶ The total flavonoids from blueberry leaves significantly enhanced the expression of anti-inflammatory cytokines (IL-6andCXCR-2) (P< 0.05) and significantly inhibited the expression of pro-inflammatory cytokines (IL-8,IP-10) (P< 0.05) to achieve the anti-inflammatory activity. Chemotactic factor receptorCXCR-1was regulated complicatedly. Conclusions∶ The total flavonoids from blueberry leaves could decrease inflammation by regulating the function of several gene loci via several steps.
total flavonoids from blueberry leaves; inflammatory cytokines; real-time reverse transcription PCR; anti-inflammatory
R966
1002-6630(2015)17-0231-05
10.7506/spkx1002-6630-201517043
2014-11-05
国家质检总局质检公益性行业科研专项(201310132;201410019)
赵丹(1988—),女,助理实验师,硕士,研究方向为生物技术。E-mail:zhaodanustb@126.com
*通信作者:王昌涛(1975—),男,教授,博士,研究方向为植物功效成分开发应用。E-mail:wangct@th.btbu.edu.cn
