干燥方式对桑叶降糖活性成分含量的影响
2015-01-03秦樱瑞曾艺涛丁晓雯黄先智
秦樱瑞,曾艺涛,杨 娟,丁晓雯,黄先智*
(1.西南大学食品科学学院,重庆市农产品加工及贮藏重点实验室,重庆 400716;2.西南大学食品科学学院,家蚕基因组生物学国家重点实验室,重庆 400716)
干燥方式对桑叶降糖活性成分含量的影响
秦樱瑞1,曾艺涛1,杨 娟1,丁晓雯1,黄先智2,*
(1.西南大学食品科学学院,重庆市农产品加工及贮藏重点实验室,重庆 400716;2.西南大学食品科学学院,家蚕基因组生物学国家重点实验室,重庆 400716)
本实验探讨了冷冻干燥、真空干燥、微波干燥和热风干燥4种不同干燥方式对桑叶降糖活性成分的影响。采用高效液相色谱法测定桑叶1-脱氧野尻霉素(1-deoxynojirimycin,DNJ)含量、苯酚-硫酸法测桑叶多糖含量、亚硝酸钠法测定桑叶总黄酮含量。结果表明:冷冻干燥法制备的桑叶色泽最好,与新鲜桑叶最为接近,但DNJ和总黄酮的含量都较低;真空干燥法制备的桑叶DNJ和多糖含量最低,且桑叶的色泽也最差;微波干燥对桑叶的降糖成分和色泽影响较小,当功率为140 W处理10 min时,其DNJ和多糖的含量最高,分别为(297.15±6.35)mg/100 g和(11.71±0.01)%;热风干燥的时间较短,对桑叶的颜色影响也较小,当干燥温度为75℃,干燥时间为60 min,所得桑叶的DNJ、总黄酮、多糖的含量都较高,分别为(227.47±5.79)mg/100 g、(49.51±1.18)mg/g和(11.29±0.01)%。因此热风干燥更适合于工业化生产中大批量桑叶的干燥。同时测定对α-葡萄糖苷酶和α-淀粉酶的抑制作用可知干燥后桑叶降糖物质结构未发生改变,降糖效果依然存在。
桑叶;干燥;1-脱氧野尻霉素;黄酮;多糖
桑叶为桑科(Moraceae)植物桑(Morus albaL.)的叶,又名铁扇子,味苦、甘,性寒,归肺、肝经,具有疏风清热、平肝明目的功效[1]。历代中医药书籍如《本草纲目》、《神农本草经》等均记载桑叶能够治疗消渴症,现代药理研究也表明桑叶具有降血糖[2]、降血脂[3]、降血压[4]、抗炎、抗肿瘤[5]及预防冠心病[6]等多种药理活性,我国卫生部将其列为药食两用中药材之一[7]。
目前,糖尿病已成为威胁人类健康的主要疾病之一,而桑叶中的降糖物质能够有效降低患者的血糖水平,促进其恢复健康[8]。国内外学者对桑叶降糖的功能和作用机理进行了一些研究报道,Jeszka-Skowron等[9]将桑叶醇提物混合到高脂饲料中,再给予经过链脲霉素诱导的糖尿病大鼠,发现桑叶醇提物能够有效降低糖尿病大鼠的血糖,促进胰岛素分泌。Chung等[10]对50个健康受试者分别给予不同剂量的桑叶水提物,发现桑叶水提物能够有效抑制受试者正餐后血糖水平升高。
桑叶中的降糖物质主要是生物碱、黄酮、多糖等[11-12]。盛琳波等[13]通过对1-脱氧野尻霉素(1-deoxynojirimycin,DNJ)含量的影响因素及稳定性进行研究发现桑树乳汁在常温、4、-20℃条件下短时间(28 d内)保存的DNJ含量相对稳定,其粗提液中的DNJ则容易降解。张军等[14]研究了不同温度下乙醇对桑叶黄酮浸提效果的影响,发现60、70℃左右时,黄酮的得率最高,85℃时左右下降。刘凡等[15]通过对桑叶多糖、黄酮、生物碱联合提取工艺条件的研究发现当水溶液的提取温度达到80℃时,桑叶的多糖和黄酮达到峰值。为了在桑叶的干燥过程中更多地保留这些降糖成分,本实验采用不同的方法干燥桑叶,比较干燥前后桑叶降糖成分的变化,以选择最优的干燥方法,为桑叶产品的开发利用提供一条理想的干燥路线,以期达到更好的降糖效果。
1 材料与方法
1.1材料与试剂
桑叶(胜利大叶),采摘于重庆市蚕业科学技术研究院。
DNJ标准品(纯度≥98%) 北京德威钠生物技术有限公司;芦丁(纯度≥98%) 中国药品生物制品检定所;芴甲氧羰酰氯(9-fluorenylmethyl chloroformate,FMOC-Cl)、甘氨酸 美国Sigma公司;乙腈、醋酸、D-葡萄糖、苯酚、浓硫酸、甲醇等常用试剂均为分析纯。
1.2仪器与设备
Agilent 1260高效液相色谱仪 美国安捷伦公司;S22分光光度计 上海棱光技术有限公司;GZX-9140MBE电热鼓风干燥箱 上海博讯实业有限公司;5810型台式高速离心机 德国Eppendor公司;WD700(MG-5033M)LG微波炉 天津乐金电子电器有限公司;DZF-6021真空干燥箱 上海齐欣科学仪器有限公司;SCANLAF Coolsafe55-4真空冷冻干燥机 香港基因有限公司;KQ5200DB超声波清洗机 昆山市超声仪器有限公司。
1.3方法
1.3.1桑叶的前处理
桑叶去柄、清洗、沥干表面水分,切为5 cm×5 cm左右的叶片,备用。为了更好地保存桑叶,延长其贮藏期,使其干燥后水分含量在安全水分14%以下[16]。
1.3.2桑叶的干燥处理
1.3.2.1热风干燥
称取桑叶30 g左右平铺于托盘中,于鼓风干燥箱中干燥。干燥条件分别为65℃、100 min,75℃、60 min,85℃、50 min。将干燥后的桑叶粉碎测定相关指标。
1.3.2.2微波干燥
称取桑叶30 g左右平铺于玻璃盘中,于微波炉中干燥。干燥条件分别为微波功率140 W、10 min,280 W、8 min,420 W、6 min。将干燥后的桑叶粉碎测定相关指标。
1.3.2.3冷冻干燥
称取桑叶30 g左右,采用桑叶直接冻干、桑叶85℃烫漂3 min后冻干、桑叶打浆后冻干、桑叶85℃烫漂3 min打浆后冻干4种方式处理。冻干条件:在-80℃预冻6 h,再进行真空冷冻干燥,冷阱温度-50℃左右,真空度0.025 MPa,干燥6 h。将干燥后的桑叶粉碎测定相关指标。
1.3.2.4真空干燥
称取桑叶30 g左右,平铺于托盘中,于真空干燥机中干燥。干燥条件分别为65℃、0.07 MPa、4 h,75℃、0.08 MPa、2.5 h,85℃、0.09 MPa、1.5 h。将干燥后的桑叶粉碎测定相关指标。
1.3.3桑叶水分含量的测定
按照国标GB 5009.3—2010《食品安全国家标准 食品中水分的测定》中的直接干燥法[17]。
1.3.4桑叶降糖成分的测定
1.3.4.1 DNJ含量的测定
按照参考文献[18-19]的方法略加修改进行测定。测试样品的制备:称取干燥好的桑叶粉0.5 g,加入35 mL超纯水,80℃水浴浸提2 h(每20 min摇匀一次),抽滤,滤渣再加15 mL超纯水重复提取1次,合并2次滤液用超纯水定容至50 mL,即得样品提取液。
DNJ的衍生化:取DNJ提取液(或标准液)300μL于10.0 mL离心管中,加入0.4 mol/L的硼酸钾缓冲溶液(pH 8.5)300μL,再加入5 mmol/L的FMOC-Cl(溶于乙腈中)300μL,混匀,25℃水浴20 min。加入1 mol/L的甘氨酸300μL中和剩余的FMOC-Cl以终止反应,加入体积分数为1%的醋酸液300μL及超纯水1 200μL稀释,6 000 r/min离心10 min,再以0.45μm微孔滤膜过滤器过滤,收集滤液备用。
高效液相色谱(high performance liquid chromatography,HPLC)条件:色谱柱:C18柱(150 mm×4.6 mm,5μm);流动相:乙腈-0.1%醋酸(50∶50,V/V);流速1.0 mL/min;柱温25℃;进样量10μL;紫外检测器,检测波长254 nm。
标准曲线绘制:对不同质量浓度的DNJ标准溶液进行测定,以DNJ质量浓度为横坐标,峰面积为纵座标绘制标准曲线,得到回归方程为y=2.335 9x-0.005 5(R2=0.999 8)。
1.3.4.2桑叶总黄酮含量的测定
按照参考文献[20]的方法略加修改进行测定。称取干燥好的桑叶粉1 g左右,加入30 mL甲醇,60℃水浴浸提1 h,抽滤,滤渣再重复提取2次,合并滤液,以甲醇定容至100 mL,得到供试液。取供试液1.0 mL于25 mL的容量瓶中,加入蒸馏水5.0 mL,5%的亚硝酸钠溶液1.0 mL,混匀,放置5 min,加1 mol/L NaOH溶液10 mL,甲醇定容至25 mL,于508 nm波长处测定吸光度。
按照以上方法测定不同质量芦丁标准溶液的吸光度,以芦丁质量浓度为横坐标,吸光度为纵坐标绘制标准曲线,得到回归方程为y=0.465 1x+0.017 8(R2=0.999 5)。
1.3.4.3桑叶多糖含量的测定
按照参考文献[21]的方法略加修改进行测定。称取干燥好的桑叶粉0.25 g左右于蓝盖瓶中,加入25 mL的沸蒸馏水于超声波清洗机中在功率100 W,55℃条件下超声提取20 min,将提取液摇匀后抽滤,定容至25 mL。取1.0 mL滤液于50 mL容量瓶中,用蒸馏水定容后取2.0 mL至20 mL具塞试管中,加入1.0 mL 5%的苯酚溶液,再立即加入5.0 mL浓硫酸,静置30 min后于490 nm波长处测定吸光度。
按照以上方法测定不同质量的葡萄糖标准溶液的吸光度,以葡萄糖质量浓度为横坐标,吸光度为纵坐标绘制标准曲线,得到回归方程为y=0.009 7x-0.002 7(R2=0.999 5)。
1.3.5桑叶粉颜色评定
组织经过训练的5人评定小组对桑叶粉的颜色进行感官评价。以最接近新鲜桑叶者得分最高,采用1~5分评分法,褐绿色(1分),深绿色(2分),黄绿色(3分),绿色(4分),翠绿色(5分),色泽位于两者之间的酌情给分。1.3.6桑叶粉提取物对α-葡萄糖苷酶的抑制作用
参照文献[22-23]的方法加以改进而得。选取热风75℃干燥60 min、含水量为(4.87±0.21)%的桑叶粉按照1.3.4.1节的方法制备提取液A。在37℃反应体系中依次加入磷酸盐缓冲溶液(0.1 mol/L,pH 6.8)3.0 mL、5 U/mL的α-葡萄糖苷酶液20μL(0.1 mol/L pH 6.8的磷酸盐缓冲溶液配制),样品制备液A 100μL,且每次测试的总体积为3.12 mL。以上试液混匀后放入37℃恒温水浴中平衡15 min,然后加入100μL2.5 mmol/L的4-硝基苯-α-D-吡喃葡糖苷(4-nitrophenyl-α-D-glucopyranoside,PNPG,0.1 mol/L pH 6.8的磷酸盐缓冲溶液配制)启动反应,恒温反应15 min后,加入5 mL 1 mol/L的Na2CO3终止反应,于400 nm波长处测定吸光度。同时做相同体系下的样品空白组(蒸馏水代替样品,加入Na2CO3后再加入PNPG)、样品对照组(蒸馏水代替样品,加入PNPG后再加入Na2CO3)、样品颜色干扰组(样品,加入Na2CO3后再加入PNPG)。α-葡萄糖苷酶抑制率计算公式如下。

式中:A1为样品空白组吸光度;A2为样品对照组吸光度;A3为样品组吸光度;A4为样品颜色干扰组吸光度。1.3.7桑叶粉提取物对α-淀粉酶的抑制作用
参照文献[24-26]的方法加以改进而得。在37℃反应体系中依次加入125 U/mLα-淀粉酶液200μL(0.1 mol/L pH 6.8的磷酸盐缓冲溶液配制),样品制备液A 100μL,放入37℃恒温水浴中平衡5 min,然后加入1%可溶性淀粉500μL启动反应,恒温反应5 min后加入500μL3,5-二硝基水杨酸(3,5-dinitrosalicylic acid,DNS)显色剂,沸水浴5 min显色,然后立即加入冰水浴冷却,定容至25 mL后于540 nm波长处测定吸光度。同时做相同体系下的样品空白组(蒸馏水代替样品),样品颜色干扰组(蒸馏水代替酶液)。
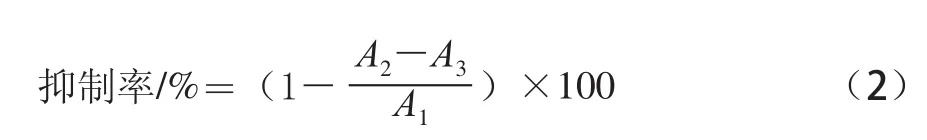
式中:A1为样品空白组吸光度;A2为样品组吸光度;A3为样品颜色干扰组吸光度。
1.4数据统计
每项实验均重复3次以上,实验结果以表示,采用Excel 2003、SPSS 17.0进行数据分析。
2 结果与分析
2.1不同干燥方法对桑叶水分及降糖成分的影响
2.1.1热风干燥法对桑叶中水分及降糖成分的影响

表1 热风干燥对桑叶中水分及降糖成分的影响Table1 Effect of hot air drying on the contents of moisture and hypoglycemic components in mulberry leaves
由表1可知,热风干燥的桑叶含水量在4.34%~4.87%之间,远远低于14%,有利于桑叶长期保存。当干燥温度为75℃时,桑叶中DNJ和多糖的含量分别为(227.47±5.79)mg/100 g和(11.29±0.01)%,与85℃时DNJ和多糖含量相比无显著性差异(P>0.05);而75℃时桑叶总黄酮的含量为(49.51±1.18)mg/100 g,与85℃时相比显著增加(P<0.05)。因此,75℃的干燥方式优于85℃。当干燥温度为65℃时,虽然总黄酮的含量与75℃时相比无显著性差异(P>0.05),但是此温度下DNJ
和多糖的含量分别为(196.13±16.34)mg/100 g和(11.07±0.01)%,均显著低于75℃时所得桑叶中这两种物质的含量(P<0.05)。因此,75℃的干燥方式也优于65℃。随着干燥温度的升高,DNJ的含量随之上升,这可能是因为干燥温度越高,干燥的时间就越短,对DNJ的破坏较小,而总黄酮的含量反而下降,可能是因为黄酮属于热敏性物质,温度越高对黄酮的破坏程度越大,黄酮的损失就越大。对桑叶粉的颜色评价表明,热风干燥后的桑叶粉均呈绿色,对颜色的影响较小。从干燥后所得桑叶粉颜色、各降糖成分的含量高低综合考虑,热风干燥选择75℃干燥60 min为宜。
2.1.2微波干燥对桑叶中水分及降糖成分的影响
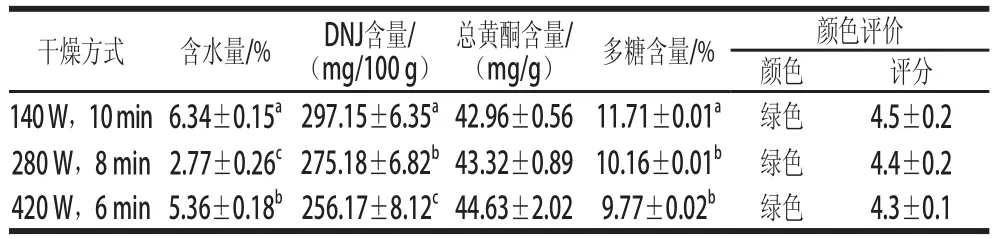
表2 微波干燥对桑叶中水分及降糖成分的影响Table2 Effect of microwave drying method on the contents of moisture and hypoglycemic components in mulberry
由表2可知,微波干燥桑叶所需的时间非常短,均在10 min内,且桑叶的含水量较低,在2.77%~6.34%之间,远远低于14%,有利于桑叶长期保存。当微波功率为420 W干燥6 min时,桑叶DNJ的含量最低为(256.17±8.12)mg/100 g,多糖的含量也最低为(9.77±0.02)%。这可能是因为功率越大对DNJ的破坏越大,同时桑叶中的多糖发生焦糖化反应等原因造成的。当干燥功率为140 W时,桑叶中DNJ的含量最高为(297.15±6.35)mg/100 g,多糖含量也最高为(11.71±0.01)%,且总黄酮的含量与420 W时干燥比较无显著性差异(P>0.05)。通过对桑叶粉的颜色评价表明,微波干燥的桑叶颜色与新鲜桑叶较为接近,均呈现绿色。从干燥后桑叶粉的颜色、各降糖成分的含量综合考虑,微波干燥选择140 W干燥10 min最好。
2.1.3冷冻干燥对桑叶中水分及降糖成分的影响
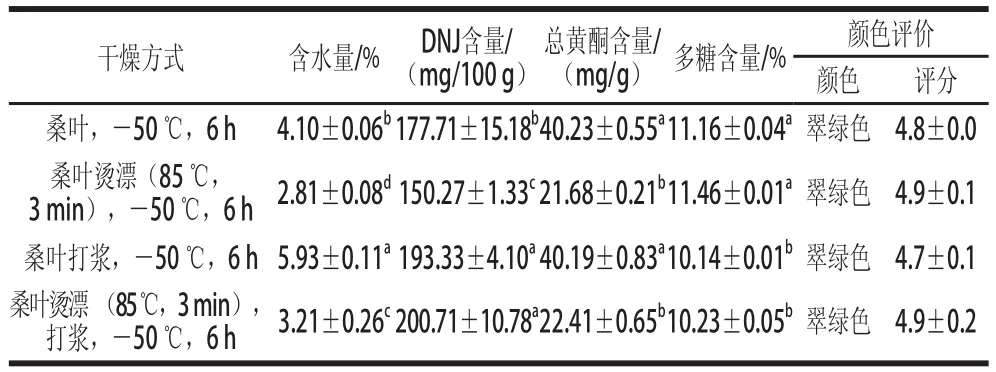
表3 冷冻干燥对桑叶中水分及降糖成分的影响Table3 Effect of freeze drying method on the contents of moisture and hypoglycemic components in mulberry-leavess
由表3可知,通过不同方式前处理的桑叶,在同样的冷冻干燥条件下干燥后,含水量相差较大,但都在6%以下,远远低于14%,有利于桑叶长期保存。未烫漂直接冷冻干燥得到的桑叶粉,DNJ的含量为(177.71±15.18)mg/100 g,总黄酮含量最高为(40.23±0.55)mg/g,多糖含量为(11.16±0.04)%。黄酮在低温下更稳定,但随着干燥时间的增加黄酮的损失也会加大[27]。桑叶先在-80℃预冻6 h,再在-50℃干燥6 h,干燥时间较长,造成黄酮损失较大。所以冷冻干燥下,总黄酮的含量反而更低。桑叶烫漂后直接进行冷冻干燥得到的桑叶粉,DNJ的含量最低为(150.27±1.33)mg/100 g,总黄酮含量也最低为(21.68±0.21)mg/g,但多糖含量最高为(11.46±0.01)%。桑叶打浆后直接进行干燥得到的桑叶粉,DNJ的含量为(193.33±4.10)mg/100 g,与桑叶烫漂打浆后进行冷冻干燥的桑叶相比无显著性差异(P>0.05),总黄酮含量为(40.19±0.83)mg/g,多糖含量为(11.46±0.01)%。桑叶烫漂后在打浆进行冷冻干燥,桑叶粉DNJ的含量为(200.71±10.78)mg/100 g,多糖含量为(10.23±0.05)%,总黄酮含量为(22.41±0.65)mg/g,但显著低于未烫漂直接进行干燥和桑叶打浆后直接进行干燥的桑叶粉的总黄酮含量(P<0.05),这可能时因为黄酮易溶于热水,在85℃烫漂的过程中,桑叶中的黄酮溶于热水受到了一定的损失造成[28],因此桑叶不宜进行烫漂。通过对桑叶粉的颜色评价表明,冷冻干燥的桑叶颜色呈翠绿色,与新鲜桑叶最为接近。综合考虑,在所采用的4种冷冻干燥方式中,以桑叶打浆后再冷冻干燥6 h的方式最为适宜。
2.1.4真空干燥对桑叶中水分及降糖成分的影响

表4 真空干燥对桑叶中水分及降糖成分的影响Table4 Effect of hot air and vacuum method on the contents of moisture and hypoglycemic components in mulberry leaves
由表4可知,使用真空干燥得到的桑叶粉含水量在2.75%~5.31%之间,远远低于14%,有利于桑叶长期保存。桑叶经真空干燥处理后,DNJ的含量均较低,当干燥温度为85℃时,DNJ与总黄酮的含量分别为(174.76±2.63)mg/100 g和(52.56±0.39)mg/g,显著高于65、75℃两种干燥方式中DNJ和总黄酮的含量(P<0.05),而85℃时多糖的含量最低为(9.23±0.01)%。但DNJ与黄酮的降糖效果要优于多糖[10],主要考虑DNJ和总黄酮的含量。真空干燥处理所得桑叶粉的颜色为深绿色,评分较低。综合考虑真空干燥桑叶的3种方式,选择85℃,0.09 MPa,干燥1.5 h为宜。
2.24种干燥方法的综合比较
通过对以上4种干燥方式的分析比较,各选取其中最好的干燥方式进行比较。桑叶中DNJ的降糖效果要优于黄酮和多糖,因此以DNJ的含量作为最主要的考核指标,其次为黄酮[29]。通过对4种较优干燥方式的比较分析可知,冷冻干燥虽然能使桑叶保持与新鲜桑叶最接近的颜色,但是却使桑叶中DNJ含量较低为(193.33±4.10)mg/100 g,且总黄酮的含量也最低为(40.19±0.83)mg/g;同时冷冻干燥所用的时间最长达6 h,能耗较多,成本高。因此从降糖物质保存和生产成本考虑,桑叶不适用于冷冻干燥。
真空干燥桑叶的时间较长,D N J的含量最低为(174.76±2.63)mg/100 g,与冷冻干燥相比显著降低(P<0.05),同时其多糖含量也最低为(9.23±0.01)%,颜色呈现深绿色,感官品质最差。因此,从各降糖成分的含量和生产成本考虑,桑叶也不适于采用真空干燥。
微波干燥的时间最短,当干燥功率为140 W时干燥时间仅为10 min,且DNJ的含量最高为(297.15±6.35)mg/100 g,显著高于其他3种干燥方式处理桑叶的DNJ含量(P<0.05),多糖的含量也最高为(11.71±0.01)%,总黄酮的含量为(42.96±0.56)mg/g。微波干燥后的桑叶均呈现绿色,干燥过程中也未出现烧焦、发泡等现象。虽然微波干燥所用的时间短,但是微波干燥的载物量对其干燥速度的影响较大,随着载物量的增加,干燥时间会相应延长[30]。当大批量干燥时成本将增大,因此微波干燥不适于大批量桑叶的干燥。
热风干燥的时间也较短,当温度为75℃时,干燥时间为60 min,DNJ的含量为(227.47±5.79)mg/100 g,与冷冻干燥和真空干燥相比显著升高(P<0.05),总黄酮和多糖的含量也较高,分别为(49.51±1.18)mg/g和(11.29±0.01)%。热风干燥后桑叶的颜色为绿色,与新鲜桑叶也比较接近。热风干燥是目前采用最多、最为经济的干燥方法,因此热风干燥是大量干燥桑叶较为理想的干燥方法。
2.3桑叶粉提取液对α-葡萄糖苷酶的抑制作用
抑制α-葡萄糖苷酶的活性可减缓葡萄糖的生成及吸收,调整血糖水平,降低餐后血糖峰值,降低高血糖对胰腺的刺激,提高胰岛素敏感性,从而保护胰腺功能[31]。通过对不同剂量桑叶粉提取液进行实验,结果如图1所示。
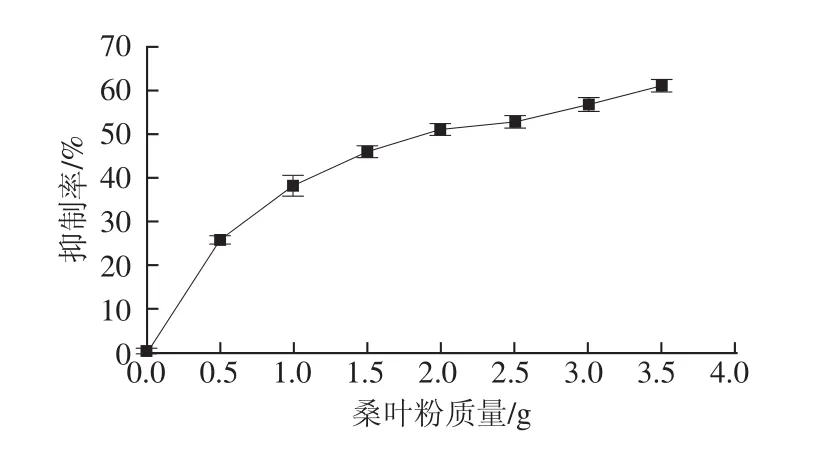
图1 不同剂量的桑叶粉对α-葡萄糖苷酶活性的影响Fig.1 Effects of different doses of mulberry-leaf powder on alphaglycosidase enzymes activity
由图1可知,随着桑叶粉剂量的增加,对α-葡萄糖苷酶的抑制作用也逐渐增加。当桑叶粉剂量在0~3.5 g之间时,存在明显的剂量依赖关系,随着剂量的增加,抑制效果也显著增加。由此可知,桑叶粉提取物对α-葡萄糖苷酶有较明显的抑制作用。
2.4桑叶粉提取液对α-淀粉酶的抑制作用
α-淀粉酶是一种糖苷水解酶,抑制α-淀粉酶能够有效抑制肠道内唾液及胰淀粉酶的活性,从而降低血糖和血脂的含量[32]。通过对不同剂量桑叶粉提取液进行实验,结果如图2所示。

图2 不同剂量的桑叶粉对α-淀粉酶活性的影响Fig.2 Inhibitory effects of different doses of mulberry leaf powder on alpha-amylase activity
由图2可知,随着桑叶粉剂量的增加,对α-淀粉酶的抑制作用也逐渐增加,剂量在0~1.0 g之间时桑叶粉与抑制率之间存在明显的剂量依赖关系。随着桑叶粉剂量的增加,抑制率也增加,但当剂量在1.0~3.5 g之间时,抑制率的增加呈逐渐变缓的趋势,当桑叶粉的剂量为3.5 g时,α-淀粉酶的抑制率为51.72%。由此可以得出桑叶粉提取物对α-淀粉酶活性有很明显的抑制作用。
3 结 论
通过对以上4种干燥方式的比较和综合分析,热风干燥温度为75℃,干燥60 min,所得桑叶粉的色泽较好,含水量为(4.45±0.15)%,DNJ、总黄酮、多糖的含量分别为(227.47±5.79)mg/100 g、(49.51±1.18)mg/g和(11.29±0.01)%,普遍高于其他3种处理方法,同时热风干燥后桑叶品质也较好,均呈现嫩绿色。因此热风干燥是大批量工业化生产桑叶较为理想的干燥方法。同时通过测定桑叶粉对α-葡萄糖苷酶和α-葡萄糖苷酶的抑制作用可知,干燥后桑叶粉未失去降糖作用。
[1] 原爱红, 黄哲, 马骏. 桑叶黄酮的提取及降糖作用的研究[J]. 中草药, 2004, 35(11)∶ 1242-1243.
[2] VICHASILP C, NAKAGAWA K, SOOKWONG P, et al. Development of high 1-deoxynojirimycin (DNJ) content mulberry tea and use of response surface methodology to optimize tea-making conditions or highest DNJ extraction[J]. LWT-Food Science and Technology, 2012, 45(2)∶ 226-232.
[3] KIM J Y, CHOI B G, JUNG M J, et al. Mulberry leaf water extract ameliorates insulin sensitivity in high fat or high sucrose diet induced overweight rats[J]. Journal of the Korean Society for Applied Biological Chemistry, 2011, 54(4)∶ 612-618.
[4] YANG N C, JHOU K Y, TSENG C Y. Antihypertensive effect of mulberry leaf aqueous extract containing γ-aminobutyric acid in spontaneously hypertensive rats[J]. Food Chemistry, 2012, 132(4)∶1796-1801.
[5] LIM H H, YANG S J, KIM Y, et al. Combined treatment of mulberry leaf and fruit extract ameliorates obesity-related inflammation and oxidative stress in high fat diet-induced obese mice[J]. Journal of Medicinal Food, 2013, 16(8)∶ 673-680.
[6] CHAN K C, HO H H, PENG C H, et al. Polyphenol-rich extract from mulberry leaf inhibits vascular smooth muscle cell proliferation involving upregulation of p53 and inhibition of cyclin-dependent kinase[J]. Journal of Agricultural and Food Chemistry, 2010, 58(4)∶2536-2542.
[7] 宋喜云. 新型复合桑业茶的研制进展[J]. 潍坊高等职业教育, 2010, 6(4)∶ 23-27.
[8] 玄光善, 潘士佳, 南姬. 桑叶有效成分降糖作用研究[J]. 食品科学, 2011, 32(7)∶ 323-326.
[9] JESZKA-SKOWRON M, FLACZYK E, JESZKA J, et al. Mulberry leaf extract intake reduces hyperglycaemia in streptozotocin (STZ)-induced diabetic rats fed high-fat diet[J]. Journal of Functional Foods, 2014, 8∶ 9-17.
[10] CHUNG H I, KIM J, KIM J Y, et al. Acute intake of mulberry leaf aqueous extract affects postprandial glucose response after maltose loading∶ randomized double-blind placebo-controlled pilot study[J]. Journal of Functional Foods, 2013, 5(3)∶ 1502-1506.
[11] 南京中医药大学. 中药大辞典[M]. 上海∶ 上海科学技术出版社, 1997∶ 2741-2742.
[12] 丁盈, 蒋梅香, 周应军, 等. 桑叶降糖活性成分研究[J]. 中国药物化学杂志, 2007, 17(6)∶ 386-389.
[13] 盛琳波, 李昭良, 苏超, 等. 桑树乳汁中1-脱氧野尻霉素含量的影响因素及稳定性[J]. 蚕业科学, 2014, 40(4)∶ 712-717.
[14] 张军, 穆莉, 檀华蓉, 等. 桑叶中黄酮化合物的提取工艺及不同品种不同时期的含量变化[J]. 蚕业科学, 2006, 32(1)∶ 142-145.
[15] 刘凡, 黄勇, 廖森泰, 等. 应用响应面法优化桑叶多糖、黄酮和生物碱联合提取工艺[J]. 蚕业科学, 2013, 39(3)∶ 568-575.
[16] 卢林英. 快速干燥苜蓿草增值的重要措施[J]. 中国牧业通讯, 2003(21)∶ 55-56.
[17] 中华人民共和国卫生部. GB 5009.3—2010食品中水分的测定[S].北京∶ 中国标准出版社, 2010.
[18] 耿鹏, 朱元元, 杨洋, 等. 桑树资源中1-脱氧野尻霉素的测定及其生物活性分析[J]. 中草药, 2005, 36(8)∶ 1151-1154.
[19] 肖洪, 沈以红, 黄先智, 等. 发酵桑叶茶生物活性成分变化研究[J]. 食品科学, 2013, 34(19)∶ 176-180. doi∶ 10.7506/spkx1002-6630-201319037.
[20] 黄健, 闵星, 陆春燕. 主要桑品种桑叶黄酮化合物含量的比较分析[J].江苏蚕业, 2013, 35(2)∶ 12-14.
[21] 刘树兴, 王维, 魏丽娜. 桑叶多糖提取工艺研究[J]. 现代食品科技, 2006, 22(2)∶ 154-155.
[22] YU Zhipeng, YIN Yongguang, ZHAO Wenzhu, et al. Anti-diabetic activity peptides from albumin against alpha-glucosidase and alphaamylase[J]. Food Chemistry, 2012, 135(3)∶ 2078-2085.
[23] 朱文佳, 寇自农 张曦, 等. α-葡萄糖苷酶抑制剂体外筛选方法的研究[J]. 食品研究与开发, 2012, 33(8)∶ 171-175.
[24] THILAGAM E, PARIMALADEVI B, KUMARAPPAN C, et al. α-Glucosidase and α-amylase inhibitory activity of Senna surattensis[J]. Journal of Acupuncture and Meridian Studies, 2013, 6(1)∶ 24-30.
[25] 程秀丽. α-淀粉酶抑制剂的活性测定[J]. 中国新医药, 2004, 3(4)∶ 71-72.
[26] 赵修南, 贾启燕, 单俊杰. α-淀粉酶抑制剂筛选方法的优化[J]. 国际药学研究杂志, 2008, 35(5)∶ 321-324.
[27] 赵晶, 张庆钢, 赵瑜, 等. 冻藏温度和时间对沙棘果中类黄酮含量的影响[J]. 食品工业, 2008(5)∶ 7-9.
[28] HARTONEN K, PARSHINTSEV J, SANDBERG K, et al. Isolation of flavonoids from aspen knotwood by pressurized hot water extraction and comparison with other extraction techniques[J]. Talanta, 2007, 74(1)∶ 32-38.
[29] DROUZAS A E, SCHUBERT H. Microwave application in vacuum drying of fruits[J]. Journal of Food Engineering, 1996, 28(2)∶ 203-209.
[30] 唐小俊, 池建伟, 张名位, 等. 苦瓜微波干燥工艺优化[J]. 农业机械学报, 2008, 39(1)∶ 68-73.
[31] 李宪璀, 范晓 韩丽君, 等. 海藻提取物中α-葡萄糖苷酶抑制剂的初步筛选[J]. 中国海洋药物, 2002(2)∶ 8-11.
[32] 黄绍华, 胡晓波, 王震宙. 山药多糖对α-淀粉酶活力的抑制作用[J].食品工业科技, 2006, 27(9)∶ 94-95.
Effects of Drying Methods on the Contents of Hypoglycemic Components in Mulberry Leaves (Morus alba L.)
QIN Yingrui1, ZENG Yitao1, YANG Juan1, DING Xiaowen1, HUANG Xianzhi2,*
(1. Chongqing Key Laboratory of Agricultural Products Processingand Store, College of Food Science, Southwest University, Chongqing 400716, China; 2. State Key Laboratory of Mulberry Silkworm Genome Biology, College of Food Science, Southwest University, Chongqing 400716, China)
The effects of different drying methods on the contents of hypoglycemic components in mulberry leaves (Morus albaL.) were explored to find the most appropriate drying method for in-depth development of mulberry leaves. 1-Deoxynojirimycin (DNJ) inmulberry leaves was quantified by high performance liquid chromatography (HPLC), polysaccharide content was measured by phenol-sulfuric acid method, and the content of flavonoids was assayed by sodium nitrite method. The results showed that freeze dried mulberry leaves presented the best quality but lower contents of DNJ and flavonoids. Vacuum drying provided the lowest contents of DNJ and polysaccharide as well as the worst color in dried mulberry leaves. Microwave drying had little effect on the hypoglycemic components and color of mulberry leaves; the highest contents of DNJ and polysaccharide of (297.15±6.35) mg/100 g and (11.71±0.01)%, respectively, were obtained by microwave drying at 140 W for 10 min. Hot air drying was time saving and only slightly affected the color of mulberry leaves, leading to higher contents of DNJ, flavones and polysaccharide of (227.47±5.79) mg/100 g, (49.51±1.18) mg/g and (11.29±0.01)%, respectively, in dried mulberry leaves. Thus, hot air drying is more suitable for industrial processing of mulberry leaves. At the same time, during the drying process no structural change was observed for the hypoglycemic components and they were still effective against alpha glycosidase and alpha amylase suggesting that the hypoglycemic activity was retained.
mulberry leaf; drying; 1-deoxynojirimycin; flavonoids;polysaccharide
TS201.1
1002-6630(2015)17-0071-06
10.7506/spkx1002-6630-201517014
2014-10-31
国家现代农业(桑蚕)产业技术体系建设专项(CARS-22-ZJ0503)
秦樱瑞(1989—),女,硕士研究生,研究方向为食品安全与质量控制。E-mail:594745844@qq.com
*通信作者:黄先智(1965—),男,副教授,博士,研究方向为桑树资源利用。E-mail:404409425@qq.com
