文昌鱼Hedgehog基因敲除和突变体表型分析
2015-01-03王慧李光王义权厦门大学生命科学学院厦门361102
王慧,李光,王义权厦门大学生命科学学院,厦门 361102
文昌鱼Hedgehog基因敲除和突变体表型分析
王慧,李光,王义权
厦门大学生命科学学院,厦门 361102
文昌鱼隶属脊索动物门头索动物亚门,是无脊椎动物到脊椎动物的过渡类群,其躯体结构简单,是研究胚胎发育的理想材料。本文以文昌鱼为实验对象,利用TALEN敲除技术对Hedgehog(Hh)基因在胚胎发育中的功能进行了研究。在文昌鱼Hh基因翻译起始位点下游附近选取TALEN目标位点,根据此序列组装相应TALEN重组质粒,体外合成mRNA,向未受精卵注射mRNA后,经体外受精获得F0代胚胎。效率分析显示,靶向该基因的TALEN mRNA可导致F0代胚胎在相应基因组区域发生突变的比例为34%。对部分F0个体所产配子筛查发现,TALEN引起的突变可进入配子,将其中1尾突变类型为8 bp缺失的雄性个体与野生型雌性配对获得F1群体,对F1群体逐尾筛查,从中获得多尾携带8 bp缺失的杂合子;这些杂合子相互配对所产的F2代胚胎,其中约有1/4个体在幼体早期出现躯体前端和尾向下弯曲、脊索前端腹侧的中胚层组织发育不全,不能开口等;随着幼体生长发育,躯体前端和尾部进一步卷曲,口部仍未形成,左右各形成一个口前窝,内柱和鳃裂位于躯体腹侧,最终因无口摄食而死亡。基因型分析发现,上述畸形胚胎均为Hh纯合突变体,其与杂合子及野生型比例分布符合孟德尔遗传定律,表明这些发育畸型的特征与Hh基因功能缺失有关。
TALEN;基因敲除;文昌鱼;Hedgehog基因;突变体
Hedgehog(Hh)基因最早由 Nvsslein-Volhard和Wieschaus在筛选影响果蝇胚胎躯体结构的基因时被发现[1],此后科研人员又在其他物种中陆续鉴定出其同源基因。脊椎动物中有3个Hh同源基因,分别是 Shh(sonic hedgehog)、Ihh(indian hedgehog)和Dhh(desert hedgehog),其中Shh在脊椎动物各类群中都非常保守,其功能也最重要。在胚胎发育过程中,Shh主要在脊索表达,成熟的 Shh蛋白由此向四周扩散,进入位于其背侧的神经管中,形成一个Shh蛋白浓度梯度,决定不同类型神经元的分化[2];Shh蛋白向两侧扩散进入体节,可诱导生骨节标记基因Pax1表达[3],从而指导中轴骨骼的形成,还能诱导生肌节分化成 SSF(Superficial slow fibres)和MP(Muscle pioneer)等类型的肌细胞[4];此外,研究还发现 Shh蛋白调控脊椎动物附肢前-后轴的图式形成[5]。实际上,Hh基因广泛存在于无椎动物和脊椎动物中,在胚胎发育的早期参与动物体轴的发生和附肢轴向的确定等。
文昌鱼隶属脊索动物门头索动物亚门,是无脊椎动物到脊椎动物的过渡类群[6]。它们躯体结构简单,但有与脊椎动物相似的躯体构筑模式(Body plan),是研究脊椎动物器官发生和起源的重要动物模型。在文昌鱼基因组中,仅有1个Hh同源基因,主要表达在脊索和底板(Floor plate)[7],与脊椎动物中的 Shh基因表达位置相似;此外,文昌鱼的 Hh基因还在左侧咽内胚层表达,类似鸡胚中 Shh基因的左右不对称表达[8],提示该基因的功能与脊椎动物Shh的功能存在某些共同之处,但该基因在文昌鱼胚胎发育过程中与哪些重要器官的发生有关尚不清楚。因此,建立文昌鱼Hh基因突变体,对深入研究该基因在文昌鱼胚胎发育中的功能、揭示脊椎动物独特躯体构筑模式的起源都是十分必要的。本实验室于2014年将TALEN技术应用于文昌鱼基因的定点敲除,首次成功地敲除了文昌鱼基因组中 7个基因,但由于基因敲除后文昌鱼的死亡率高和文昌鱼本身世代时间长的原因,当时暂未获得能够将功能缺失基因传递下去的子代[9]。本研究利用TALEN技术敲除文昌鱼Hh基因,经过精心养护获得了可传代的Hh基因功能缺失的文昌鱼突变体杂合子,从而能够细致地观察 Hh基因缺失后对文昌鱼胚胎发育的影响,这是文昌鱼中第一例基因敲除突变体。
1 材料和方法
1.1 实验动物
按照本实验室之前的报道[10],将引种来的佛罗里达文昌鱼(Branchiostoma floridae)饲养在方形塑料桶中(50 cm×35 cm×30 cm),桶底垫约5 cm的海沙,水面高出沙面 5~10 cm,连续充气,喂以单胞藻。性腺成熟的文昌鱼个体经热诱导分别获得成熟的卵子或精子,卵子用于显微注射[11],完成注射后人工受精。
1.2 TALEN质粒构建与显微注射
利用TALEN技术敲除文昌鱼Hh基因,参考文献[12]并按以下原则选择目标位点:(1)识别靶点序列通常在16~20 bp,左右靶点间隔序列在14~20 bp;(2)识别靶点序列前的1个碱基为T;(3)识别靶点序列包含的G碱基尽量少;(4)一对TALEN的2个识别靶点应位于同一外显子上。按照以上原则,本文在佛罗里达文昌鱼Hh基因上选取了1个TALEN的目标位点,识别序列为:5'-CGCAAGCTCACCCCCT-3'(左靶点)和 5'-GATGCCGGCGGTCTCCG-3'(右靶点),间隔序列含1个BsrGⅠ酶切位点。构建TALEN所需模块和骨架质粒全部购自Addgene公司,根据本实验室之前的报道[9],采用Golden Gate方法完成组装。
构建好的TALEN质粒,用限制性内切酶SacⅠ将其线性化,再用Ambion公司的T3试剂盒体外合成mRNA。将成对的TALEN mRNA(约200 ng/μL)、甘油(100%)、德克萨斯红荧光染料(5 mg/mL)以3.5:1:0.5体积比混合,其中荧光染料用于指示mRNA注射进入卵子,按照本实验室已建立的显微注射方法[13],将TALEN mRNA注入文昌鱼成熟的未受精卵中,注射完成后滴加适量精液使卵受精,同时在另一个培养皿中受精一些同一雌性个体产、但未经注射的卵子作为对照。体视显微镜下观察到受精膜举起时即刻更换新鲜海水,彻底去除过量的精液和溶解在海水中的多聚赖氨酸,同时清除显微注射时损坏的卵子,然后放置恒温恒湿培养箱(温度25℃,湿度90%)中培养。待胚胎发育至原肠早期,在荧光体视显微镜(Olympus公司)下,去除注射不成功的胚胎(不发红色荧光)。
1.3 突变效率检测
待胚胎发育至神经胚晚中期,在注射组和对照组中分别取约200枚胚胎,放于1.5 mL塑料离心管中,用酚-氯仿法提取基因组DNA用作PCR扩增模板。PCR引物设计分别位于左、右靶点的上游和下游,二者间隔约400 bp,引物序列为:
Hh-Talen-F:5'-GAATTTAGCCGTTAATAGGGAG-3';Hh-Talen-R:5'-GCGAGTAATCCGTCCG TTGA-3'。PCR产物用Omega公司的试剂盒纯化回收,经限制性内切酶BsrGⅠ酶切后,琼脂糖凝胶电泳检测。如TALEN注射组胚胎的PCR产物中有未被限制酶切开的完整条带,则说明靶点处发生了突变,根据未切开PCR条带占所有条带的荧光亮度百分比,可以大致估测TALEN的突变效率。
1.4 突变体筛选
1.4.1 F0代培养及配子筛选
用有效的TALEN mRNA注射未受精卵,受精后获得F0代,于恒温恒湿下精心培养胚胎至幼体早期,然后转移至较大的方形塑料桶中,于28℃鱼房中培养,此时的桶底不必垫沙,根据幼体密度投喂适量的单细胞藻,保持通气,并每日更换约一半海水。大约 1个月后,幼体开始变态,此时在桶底铺垫约1 cm厚细沙,供变态的幼体及时钻入沙中。变态后的亚成体饲养管理与成体基本相同,即保持通气、按时饲喂、定期换水和洗沙[14],经2个月的饲养后,F0代文昌鱼逐渐性成熟。对性腺成熟个体采用温度和光照诱导的方法[11]催产,催产前将待产个体在22℃低温中养殖10 d以上,再于27℃高温中热激24 h,之后将每一个个体单独置于250 mL的一次性塑料杯中,熄灯后(文昌鱼在黑暗条件下产卵) 于27℃水温中催产;每隔30 min观察一次,若发现排卵或精液个体,及时从杯中取出F0亲本并编号,于另一个杯中暂养,卵子或精液的编号与亲本个体一一对应。
用 PCR产物-酶切方法检测配子以筛选出生殖细胞中带有靶位点突变的F0亲本。因卵子富含卵黄,不易提取基因组DNA,所以雌性个体产下的卵子先用野生型(WT)成体产的精液受精,待受精卵发育一段时间后再用Qiagen公司的DNA提取试剂盒提取胚胎的基因组DNA进行检测;而雄性个体所产的精液可以直接用酚-氯仿法提取基因组DNA检测。配子检测如果有突变,即将其对应的F0亲本单独饲养,使其再次产卵或者产精,并与野生型的成体杂交,以获取F1代。
1.4.2 F1代亚成体筛选
因筛得的F0代中通常仅部分配子的目标基因被敲除,为获得携有突变基因的F1代,需要对F1代个体进行逐尾检测,然后把携带突变基因的个体培养成熟并繁殖。因此本研究中待F1幼体生长至亚成体(体长约 2 cm)时便开始逐尾检测,提早检测可以对少数携带突变基因的个体加强饲养管理,促进其性腺发育。剪切单一个体的尾尖,提取基因组DNA,经 PCR-酶切初步鉴定后,选择有突变个体的 PCR产物,进一步克隆测序,逐条分析靶位点突变类型。切取少许尾尖组织(通常小于1 mm),以确保切完尾尖的个体存活力不受影响,为避免伤口感染,使用的海水经灭菌处理,切完尾尖的个体单独置250 mL一次性塑料杯中,在 19~22℃低温中暂养,其间少量投饵,2~3 d后将突变类型相同的个体放在同一个深色的3 L塑料小桶里,放回鱼房中正常饲养,适当加强饵料投喂,待其性腺发育成熟。
1.4.3 F2代获得及纯合突变体鉴定
选取携带相同突变类型的性成熟雌雄F1个体,按文献[11]报道的热激诱导产卵(精)方法,获得卵子和精液后,将适量精液与卵子混合,受精后的胚胎即为F2代。雄性若提前产精,可将精液保存在4℃冰箱1~2 d,用前在普通正置显微镜下检查精子是否还仍有活力,精子游动越剧烈,表明活力越强,使用时受精效果越好。将F2胚胎放于培养箱培养,定期在体视显微镜下观察F2代胚胎的发育情况,对出现特异表型的个体进行基因型分析,以确定此种表型是否为纯合突变体对应的表型。
2 结果与分析
2.1 文昌鱼Hh基因的突变率
TALEN mRNA显微注射的卵受精发育至神经胚(F0)后,经PCR-酶切鉴定,结果显示,Hh TALEN注射组胚胎提取的DNA模板扩增产物中,有未切开的完整条带,而对照组胚胎提取的DNA模板扩增产物被 BsrGⅠ限制酶完全切开(图 1)。根据未切开的电泳条带占所有电泳条带荧光亮度的百分比,估测注射 TALEN mRNA后 Hh基因的突变效率约为34%。在此基础上,用同样的方法重复注射了几批文昌鱼卵,受精后精心饲养,以获取较多Hh基因敲除的F0代。
2.2 F0代的配子筛选结果
F0代群体生长发育成熟后,逐尾诱导获取配子。用PCR-酶切方法检测了11尾F0所产配子,其中雄性10尾,雌性1尾,发现10号雄性成体的配子存在突变,将未能切开的DNA片段经克隆测序验证,结果显示测序的3个克隆均为8 bp缺失突变(图2)。
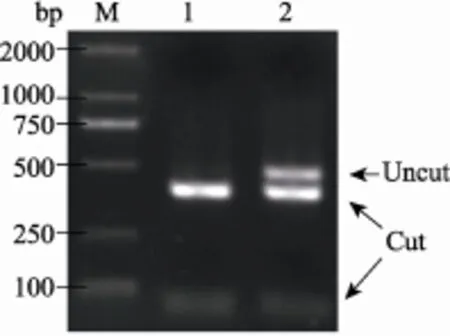
图1 Hh TALEN文昌鱼胚胎DNA扩增产物的BsrGⅠ酶切结果

图2 以F0代10号个体所产配子DNA为模板的PCR产物酶切和测序检测结果
2.3 F1代亚成体的检测
将F0代10号雄性个体与野生型雌性个体杂交,得到携带8 bp缺失突变的F1代群体。F1代群体生长至亚成体(体长约2 cm)时,即可逐尾检测个体的Hh基因是否突变。共检测了176尾,结果有8尾携带突变基因,突变类型与 F0代 10号雄性个体的配子相同(图3)。
2.4 F2代纯合突变体鉴定
将 F1代杂合子相互配对,获得 F2代群体。在F2代幼体早期(受精后约 30 h)群体中观察到一些尾部弯曲畸形幼体(图4B),于是挑取约200枚此种畸形的幼体混合为一组提基因组 DNA,同时还从 F2群体中选取约200枚外部形态正常的幼体(图4 A)作为对照。经PCR-酶切检验,结果显示外部形态正常幼体的PCR产物能够部分切开,尾部弯曲畸形幼体的PCR产物完全不能切开(图4C),表明尾部弯曲畸形的幼体是纯合子突变体,而外形正常的个体可能为野生型和杂合子突变体的混合群体。
在胚胎发育至神经胚晚期之前的F2代群体中,未见任何发育异常个体,但此后Hh基因敲除的个体发育出现畸形。为此,本文将同一对亲本产的胚胎在神经胚期随机分成3组独立培养,每组150枚,以排除饲养管理的影响,待纯合突变幼体发育至出现尾部弯曲的畸形性状时,计数体形正常和尾部弯曲个体数。结果显示,3组中外部形态正常幼体与尾部弯曲幼体的个数比值均接近 3:1(表 1)。此外,利用 PCR-酶切方法抽样检测了外部形态正常的幼体,结果显示,在随机检测的 71尾中,杂合子 46尾和野生型25尾,2种基因型个体数量接近 2:1。以上统计结果表明,本研究获得的文昌鱼8 bp突变Hh基因符合孟德尔遗传学分离定律,幼体尾部弯曲个体是Hh基因8 bp缺失突变纯合子。

图3 F1代Hh基因缺失突变检测结果

图4 F2代幼体形态及基因型检测
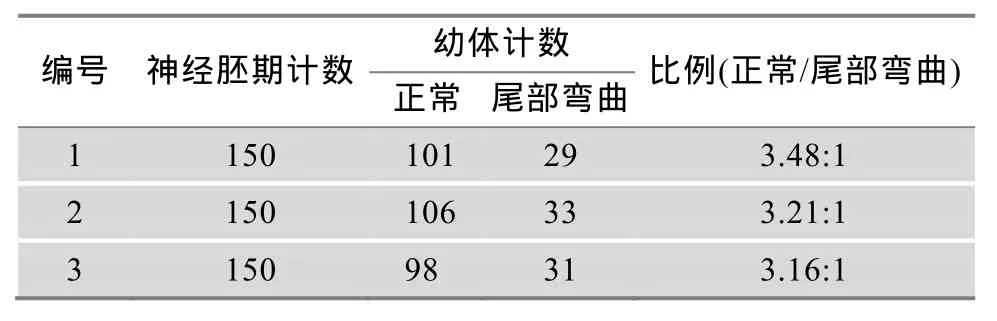
表1 基因敲除F1杂合子配对所得F2代的统计结果
2.5 纯合突变体表型
当 Hh纯合突变体的胚胎发育至神经胚即将结束时,尾端开始出现弯曲(图 5:A、B),进一步发育至幼体早期畸形特征更显著(图 5:C、D),躯体前端和尾端均向腹侧弯曲,脊索前端的腹面中胚层组织发育不全,致使表皮细胞层直接附于其上,口和鳃没有发育。胚胎发育至幼体中期时,纯合突变体尾部进一步弯曲呈卷盘状(图5:F、G),依然没有口出现,咽鳃区发育异常,本该出现在右侧的鳃裂却出现在身体的腹中线处,鳃裂前端的内柱也同样出现在腹中线,而本来只出现在左侧的口前窝却在左右两侧各形成一个,使本该两侧不对称的幼体变得左右对称(图 5:F~J)。随着幼体继续发育,纯合突变体身体前、后两端的弯曲进一步加深,躯体缩小并伴全身严重水肿,咽区鳃裂结构不能分辨(图5:K、L),因无口不能进食,虽有肠道但无食物,纯合突变体自受精约10 d后死亡,而此时的野生型和杂合子个体均正常发育并出现第4鳃裂。

图5 Hh纯合突变体的外部形态
3 讨 论
基因敲除是研究特定基因功能的最直接的技术手段,不仅可以通过对功能缺失突变体的直接观察,判断该基因在胚胎发育过程中的作用,还可以用基因拯救(Rescue)等方法对基因功能进行更深入的研究,因此获得可传代的基因敲除突变体是深入研究基因功能的关键性一步。Hedgehog是动物早期胚胎发育过程中的重要调控因子,本文报道的文昌鱼Hh基因缺失突变体是在头索动物中首次获得,该突变体能够以杂合子的方式保存Hh基因缺失突变,这是文昌鱼中报道的第一例基因敲除突变体。
3.1 文昌鱼Hh基因缺失对胚胎发育左右对称性的影响
文昌鱼幼体在形态上有一个显著的特点是咽鳃区呈左右不对称分布,即左侧开口,右侧为鳃裂,此外位于口前方的口前窝也出现在身体左侧,位于鳃裂前的内柱同样位于右侧。本研究中我们观察到,Hh纯合突变体幼体的咽鳃区的结构呈对称分布,虽然口缺失,但在体左右各形成一个口前窝,使得鳃裂和内柱被挤压至腹侧中央,表明Hh与文昌鱼幼体发育的左右不对称有关,Hh基因功能缺失后,幼体便失去了保持正常的左右不对称发育的能力。
早在1995年Levin等[8]对鸡胚的研究即已发现,Shh在鸡胚亨氏结中只表达在左侧,并可调控nodal基因的表达,因此推测Shh参与了鸡胚左右不对称的形成。Zhang等[15]对Hedgehog信号通路的进一步研究发现,小鼠中该通路成员之一的Smo突变可导致心管的右旋环化紊乱,分子检测结果表明Hh信号通路可能间接地参与小鼠左右不对称状态的维持。本文敲除文昌鱼Hh基因,结果导致幼体咽鳃区不再呈现左右不对称分布,由此可见,在头索动物文昌鱼中 Hh基因即已涉及个体发育过程中正常的不对称构造形成,但文昌鱼中是否也像脊椎动物那样通过 Nodal信号通路间接影响不对称的形成有待进一步研究。
3.2 文昌鱼Hh基因敲除突变体
文昌鱼 Hh基因敲除纯合突变体不仅在早期幼体阶段咽鳃区的不对称发育受到破坏,躯体的前端和尾端分别向腹面卷曲,而且幼体的口始终无法形成,最后全部死亡,可见该基因对文昌鱼的存活必不可少,基因的缺失突变无法以纯合子个体的形态保存下来。所幸的是敲除文昌鱼 Hh基因后,从 F1代中筛选获得的8尾携带Hh基因移码突变的杂合子不仅能存活下来,而且还能繁殖,用这些F1杂合子自交后得到F2代群体,从中随机取出450枚发育中的胚胎,分 3组培养至幼体期发现,发育正常与尾部畸形个体间的比例略大于3:1,其中畸形个体全部是纯合突变体,之所以略偏离3:1,可能是因为检测时部分纯合突变体已经死亡,正常发育个体中应当有野生型与杂合子 2种基因型。为检测杂合子的存活力是否受影响,本文还检测了杂合子与野生型交配所产子代生长发育至成体的基因型,共检测了45尾,其中有11尾杂合子,34尾野生型,虽然偏离了1:1的比例,但是在每一对交配组合中仍然得到了相当数量的生长发育成熟的杂合子,因此本研究所得到的8 bp缺失突变文昌鱼Hh基因可以杂合子形式保存下来,为随后的基因功能研究奠定了基础。检测结果还提示杂合子的存活率显著低于野生型,这一现象产生可以有两种解释:(1)由于杂合子体内仅有1个正常的Hh基因,因此基因表达产物剂量减少,至使杂合子存活率降低;同时也可能由于该突变体是Hh基因8 bp缺失造成的移码突变,基因突变后仍有可能表达出无功能的产物,该无功能产物对正常基因表达产物造成干扰或对胚胎直接产生其它不利影响,从而降低了杂合子存活率。(2)另一种可能是TALEN的副作用,但TALEN mRNA注射后的化学毒副作用和 TALEN的脱靶的副作用,都应当在F0代中表现出来,而不会在经过2~3代繁殖后的子代中出现;如果设想脱靶效用造成非目标基因修饰可以同时传递到子代中,从本文设计的突变体筛选策略中可以看出,同时具有Hh和非目标基因修饰并被筛出的可能性也基本为 0。由此分析可见,杂合子存活率低可能是Hh基因本身的原因,其产生的机制随着该基因功能研究的深入将会得到更好的解释。
[1] Nüsslein-Volhard C, Wieschaus E. Mutations affecting segment number and polarity in Drosophila. Nature, 1980, 287(5785): 795-801.
[2] Huangfu D, Anderson KV. Signaling from Smo to Ci/Gli: conservation and divergence of Hedgehog pathways from Drosophila to vertebrates. Development, 2006, 133(1): 3-14.
[3] Chiang C, Litingtung Y, Lee E, Young KE, Corden JL, Westphal H, Beachy PA. Cyclopia and defective axial patterning in mice lacking Sonic hedgehog gene function. Nature, 1996, 383(6599): 407-413.
[4] Ingham PW, Kim HR. Hedgehog signalling and the specification of muscle cell identity in the zebrafish embryo. Exp Cell Res, 2005, 306(2): 336-342.
[5] Riddle RD, Johnson RL, Laufer E, Tabin C. Sonic hedgehog mediates the polarizing activity of the ZPA. Cell, 1993, 75(7): 1401-1416.
[6] Bertrand S, Escriva H. Evolutionary crossroads in developmental biology: amphioxus. Development, 2011, 138(22): 4819-4830.
[7] Shimeld SM. The evolution of the hedgehog gene family in chordates: insights from amphioxus hedgehog. Dev Genes Evol, 1999, 209(1): 40-47.
[8] Levin M, Johnson RL, Sterna CD, Kuehn M, Tabin C. A molecular pathway determining left-right asymmetry in chick embryogenesis. Cell, 1995, 82(5): 803-814.
[9] Li G, Feng J, Lei Y, Wang J, Wang H, Shang LK, Liu DT, Zhao H, Zhu Y, Wang YQ. Mutagenesis at specific genomic loci of amphioxus Branchiostoma belcheri Using TALEN method. J Genet Genomics, 2014, 41(4): 215-219.
[10] Zhang QJ, Sun Y, Zhong J, Li G, Lü XM, Wang YQ. Continuous culture of two lancelets and production of the second filial generations in the laboratory. J Exp Zool B Mol Dev Evol, 2007, 308(4): 464-472.
[11] Li G, Shu ZH, Wang YQ. Year-round reproduction and induced spawning of Chinese amphioxus, Branchiostoma belcheri, in laboratory. PLoS One, 2013, 8(9): e75461.
[12] Cermak T, Doyle EL, Christian M, Wang L, Zhang Y, Schmidt C, Baller JA, Somia NV, Bogdanove AJ, Voytas DF. Efficient design and assembly of custom TALEN and other TAL effector-based constructs for DNA targeting. Nucleic Acids Res, 2011, 39(12): e82.
[13] Liu X, Li G, Feng J, Yang X, Wang YQ. An efficient microinjection method for unfertilized eggs of Asian amphioxus Branchiostoma belcheri. Dev Genes Evol, 2013, 223(4): 269-278.
[14] 张秋金. 厦门海域文昌鱼属Branchiostoma的分类及2种文昌鱼的实验室连续繁育[学位论文]. 厦门大学, 2007.
[15] Zhang XM, Ramalho-Santos M, McMahon AP. Smoothened mutants reveal redundant roles for Shh and Ihh signaling including regulation of L/R asymmetry by the mouse node. Cell, 2001, 105(6): 781-792.
(责任编委: 张博)
Generating amphioxus Hedgehog knockout mutants and phenotype analysis
Hui Wang, Guang Li, Yiquan Wang
School of Life Sciences, Xiamen University, Xiamen 361102, China
The amphioxus is a promising animal model for evolutionary-developmental studies due to its key position on the animal phylogenetic tree. In the present study, we reported a genetically modified amphioxus strain on the Hedgehog (Hh) gene locus using the TALEN method. The result showed that our TALEN pair injection could bring about 34% mutations in the amphioxus Hh coding region. Further analysis on the F0gametic DNA revealed that the mutations had entered into gametes. So, we paired one F0male carrying an 8 bp deletion with a wild-type (WT) female, and carefully nursed the F1embryos up to adulthood. We then screened F1individually via analyzing their genomic DNA from a tiny tail tip, and obtained eight heterozygous mutants from the F1offspring. Moreover, our observation on the F2embryos generated by mating F1mutants also revealed that about 25% of early larvae developed aberrantly with head and tail curving ventrally, agenesis of the mesoblastic tissue under their anterior notochord, and no mouth opening. With the larva growth, deformities (such as twist of head and tail, mouth absent, ventrally localized endostyle and gill slits) became more severe, and eventually those malformed larvae died due to no food intake.Genetic analysis showed that all these deformed embryos were homozygous mutants and the ratio of Hh hetorozygotes vs WT agreed with Mondel's law. WT amphioxus larvae are asymmetric with the mouth on the left and gill slits on the right side. However, the homozygous mutant larvae became left-right symmetric with the gill slits on the ventral side, indicating a conserved role of Hedgehog signaling in establishing the left-right embryonic axis.
TALEN; gene knockout; amphioxus; hedgehog gene; mutant
2015-06-10;
2015-07-03
国家自然科学基金项目(编号:31372188,31101631) 资助
王慧,硕士,专业方向:动物发育遗传。E-mail: 1337477106@qq.com
王义权,教授,博士生导师,研究方向:动物分子遗传。E-mail: wangyq@xmu.edu.cn
10.16288/j.yczz.15-276
时间:2015-7-24 10:31:31
URL:http://www.cnki.net/kcms/detail/11.1913.R.20150724.1031.002.html
