十种微藻粗多糖的抑菌作用及海水小球藻粗多糖的抗氧化活性
2015-01-03宋东辉刘凤路邸富荣
席 波,宋东辉,孙 晶,刘凤路,邸富荣
(天津市海洋资源与化学重点实验室,天津科技大学海洋科学与工程学院,天津 300457)
十种微藻粗多糖的抑菌作用及海水小球藻粗多糖的抗氧化活性
席 波,宋东辉,孙 晶,刘凤路,邸富荣
(天津市海洋资源与化学重点实验室,天津科技大学海洋科学与工程学院,天津 300457)
采用滤纸扩散法研究10种微藻粗多糖对细菌和真菌的抑菌作用,对抑菌作用明显的微藻粗多糖提取物,进一步研究其抗氧化活性.结果表明:10种微藻粗多糖提取物中,海水小球藻(Marine chlorella vulgaris)的粗多糖提取物抑菌能力最好,其粗多糖提取物对大肠杆菌(Escherichia coli)、藤黄八叠球菌(Micrococcus luteus)、假丝酵母(Monilia albican)、金黄色葡萄球菌(Staphylococcus aureus)的抑菌圈直径分别达13.0、8.0、11.0、10.0,mm.进一步研究其抗氧化活性,1,1-二苯基-2-三硝基苯肼(DPPH)自由基清除能力最高为61.2%,,超氧阴离子清除能力最高达到74.47%,,羟基自由基清除能力最大为75.37%,,抗脂质过氧化能力最高达74.32%,.
微藻;粗多糖;抑菌;抗氧化
微藻多糖是由多个相同或不同的单糖基通过糖苷键相连形成的高分子碳水化合物.作为一种广泛存在于微藻体内的天然大分子物质,微藻多糖除了具有传统的工业价值外,近年来的研究表明,它们还具有多种生物活性及药用功能,如增强机体免疫活性、抗病毒、抗肿瘤、抗氧化、抗辐射等作用[1];还有其他研究表明微藻多糖是通过调节机体免疫系统功能发挥这些作用的[2].微藻多糖可以通过促进淋巴细胞增殖与分化、刺激巨噬细胞的吞噬功能、促进细胞因子和抗体的产生等途径来实现对机体免疫系统功能的调节[3].藻类多糖物质具有多种生物活性,而抗氧化研究大多集中在大型海藻中,对微藻多糖抗菌和抗氧化研究开展的较少.
本研究对10种微藻粗多糖进行了抑菌活性检测,对抑菌作用明显的微藻粗多糖提取物进一步研究其抗氧化活性,包括粗多糖对1,1-二苯基-2-三硝基苯肼(DPPH)自由基清除能力、抗脂质过氧化能力、羟基自由基清除能力、超氧阴离子去除能力以及还原力的分析测定,旨在筛选出抗氧化活性强的微藻,为研制新型免疫增强剂提供理论依据.
1 材料与方法
1.1 材料
1.1.1 微藻
本实验选取8种淡水微藻及2种海水微藻.其中淡水微藻为集胞藻6803(Synechocystis sp.PCC6803)、发菜念珠藻(Nostoc flagelliformis)、聚球藻7942(Synechococcus sp.PCC7942)、鱼腥藻7120 (Anabaena sp.PCC7120)、普通念珠藻(Nostoc commune)、四尾栅藻(Scenedesmus quadricanda)、铜绿微囊藻905(Microcystis aeruginosa FACHB905)及普通小球藻(Chlorella vulgaris);海水微藻为杜氏盐藻(Dunaliella salina)和海水小球藻(Marine chlorella vulgaris).以上微藻均购自中国科学院淡水藻种库(FACHB-collection),由天津科技大学海洋科学与工程学院微生物制品实验室持续继代保种.
1.1.2 试剂
Na2HPO4·7H2O、NaH2PO4·7H2O、浓硫酸、邻二氮菲、C6H5OH、FeSO4·7H2O、H2O2、DPPH(1,1–二苯基–2–三硝基苯肼)、Tris、邻苯三酚、新鲜鸡蛋PBS卵黄混浊液、三氯乙酸、硫代巴比妥酸、铁氰化钾、FeCl3、维生素B12、柠檬酸、柠檬酸铁铵.
1.1.3 供试菌种
革兰氏阴性菌:大肠杆菌(Escherichia coli);革兰氏阳性菌:藤黄八叠球菌(Micrococcus luteus)和金黄色葡萄球菌(Staphylococcus aureus);真菌:假丝酵母(Monilia albican).以上菌株均购自中国普通微生物菌种保藏管理中心(CGMCC),由天津科技大学海洋科学与工程学院微生物制品实验室持续继代保种.1.1.4 培养基
BG-11培养基、f/2培养基、PDA培养基和LB培养基按照文献[4–7]进行配制.
1.2 方法
1.2.1 微藻的培养
普通小球藻、发菜念珠藻、集胞藻6803、四尾栅藻、普通念珠藻、聚球藻7942、铜绿微囊藻905和鱼腥藻7120均采用BG-11培养基进行培养.杜氏盐藻和海水小球藻采用f/2培养基进行培养.恒温摇床培养条件为:光照度3,000,lx,光/暗周期12,h/12,h,培养温度25~30,℃,转速150,r/min.
1.2.2 粗多糖提取及得率测定[8–11]
微藻培养10,d后,离心收集藻细胞,采用冷冻干燥法制备成藻粉.干藻粉称质量(m1),加入提取介质后超声破碎(功率为700,W、辐射时间为10,s、间隔时间10,s),于80,℃水浴提取6,h.离心取上清液,浓缩到适当体积,加3.8倍体积的95%,无水乙醇,醇沉过夜.离心收集沉淀,复溶于适量蒸馏水中,调pH至7,加0.5%,中性蛋白酶,50,℃保温3,h,离心去沉淀.再用Sevage法去除蛋白[12],其中氯仿与正丁醇体积比为5∶1,剧烈振荡0.5,h,离心去除有机层,得到水相层,重复3次.蒸馏水透析2,d,期间4~5,h换1次水,透析液离心除去不溶物后减压浓缩,浓缩后冷冻干燥得到粗多糖(m2).根据式(1)计算粗多糖得率.

1.2.3 粗多糖抑菌实验[13]
培养皿倒入15~20,mL培养基,待凝固后吸取菌悬液0.5,mL于对应培养皿中,涂布均匀,将粗多糖溶液配制成相同质量浓度(25,mg/mL)的溶液,将已灭菌的圆形滤纸片分别浸入粗多糖溶液和无菌蒸馏水中用镊子夹出,将已风干的带有提取物的圆形滤纸片置于对应的培养基中,每个培养基放置3个带有提取物的圆形滤纸片和1个带有无菌蒸馏水的圆形滤纸片,密封后放入培养箱中培养48~72,h并观察其抑菌效果.
1.2.4 抗氧化活性测定
半数有效浓度(median effect concentration,EC50)指清除率50%,时的多糖样品浓度,是用来评价微生物多糖抗氧化活性的一个重要参数,EC50值越低,表明该组分的抗氧化能力越强[14].EC50值的计算分析通过SPSS statistics19 软件完成.
(1)DPPH自由基清除能力测定[15]:用无水乙醇溶解4,mg DPPH并定容于100,mL容量瓶中,避光保存(0~4,℃).取不同体积(0、0.1、0.2、0.4、0.6、0.8、1.0,mL)的样品溶液加双蒸水定容至1,mL,与4,mL DPPH溶液加入同一试管中,摇匀,在黑暗中放置30,min,以无水乙醇作为空白,在517,nm下测定其吸光度(A).以BHT为阳性对照,按照式(2)计算清除率,清除率越大抗氧化能力越强.

式中:A0为1,mL无水乙醇加4.0,mL DPPH 溶液的吸光度;A1为待测液加4.0,mL DPPH 溶液的吸光度.
(2)抗脂质过氧化能力测定[16]:用0.1,mol/L、pH 7.45的磷酸盐缓冲液(PBS)配制卵黄悬液,其中卵黄与PBS体积比为 1∶25,吸取卵黄悬液0.4,mL,在试管中分别加入不同体积(0、0.1、0.2、0.4、0.6、0.8、1.0,mL)的被测溶液并加水定容到1.0,mL;再加入0.4,mL的FeSO4(25,mmol/L)和0.1,mol/L pH 7.45 的PBS 2.2,mL,37,℃气浴恒温振荡器中振荡15,min,取出后加入20%, 的三氯乙酸1.0,mL静置10,min,4,500,r/min离心10,min;吸取4,mL上清液加入0.8%,的硫代巴比妥酸2,mL,加塞,放入沸水浴中15,min,冷却后,以空白管(6,mL PBS代替),调零,532,nm处测定吸光度.以BHT为阳性对照,样品抗氧化活性用对卵黄脂蛋白脂质过氧化的抑制率按照式(3)计算.

式中:A0为不加样品管的吸光度;A为样品管的吸光度.
(3)羟基自由基清除能力测定[15,17]:在6只试管中分别加入PBS(pH 7.4)0.4,mL、双蒸水0.25,mL、5,mmol/L的邻二氮菲溶液0.15,mL和7.5,mmol/L FeSO40.5,mL后立即混匀.测试管中分别加不同体积(0、0.1、0.2、0.4、0.6、0.8、1.0,mL)的多糖溶液,用水补齐到1.0,mL,最后加入1%,的H2O20.1,mL,37,℃水浴保温60,min.在536,nm处测定吸光度,以BHT为阳性对照,损伤管中加入1%,的H2O2而不加样品,对照管中两者都不加,空白管中加样品而不加1%的H2O2.按照式(4)计算清除率.

式中:A样品、A损伤、A对照和A空白分别为样品管、损伤管、对照管和空白管在536,nm处的吸光度.
(4)超氧阴离子去除能力测定[15,17]:在试管中分别加入不同体积(0、0.1、0.2、0.4、0.6、0.8、1.0,mL)的多糖溶液,用水补齐至1.0,mL,然后加入0.05,mol/L的Tris–盐酸缓冲(pH 8.2)3.0,mL,25,℃水浴保温10,min,再分别加入12,µL同样预温的30,mmol/L的邻苯三酚,混匀并精确反应4.0,min,0.5,mL浓盐酸终止反应,紫外分光光度计在320,nm下测定反应溶液的吸光度,以本实验中的Tris–盐酸缓冲液作空白,以BHT为阳性对照,按照式(5)计算清除率.

式中:A空白为Tris-盐酸缓冲液的吸光度;A对照为反应体系(Tris–盐酸+邻苯三酚)的吸光度;A样品为反应体系加入样品后的吸光度.
(5)还原力测定[17]:在试管中分别加入不同体积(0、0.1、0.2、0.4、0.6、0.8、1.0,mL)的待测溶液加水定容至1.0,mL.加入0.2,mol/L、pH 6.6的PBS 2.5,mL和1%,铁氰化钾2.5,mL,50,℃水浴保温20,min,然后加入10%,三氯乙酸2.5,mL,3,000,r/min离心.吸取上清液2.5,mL,加入双蒸水2.5,mL和0.1%, 的FeCl3溶液0.5,mL,在700,nm处测定吸光度,以BHT为阳性对照.
2 结果与讨论
2.1 微藻粗多糖的得率
10种微藻粗多糖得率的测定结果见表1.其中铜绿微囊藻905粗多糖得率最低,为1.2%,;普通念珠藻最高,达4.9%,.

表1 供试微藻粗多糖的得率测定Tab.1Extraction yield of the crude polysaccharides from 10,microalgae
2.2 不同微藻的多糖粗提物抑菌活性
10种微藻粗多糖对4种测试菌株表现出不同程度的抑制作用(表2).海水小球藻和鱼腥藻7120均对4种指示菌有较好的抑制作用,其中海水小球藻粗多糖抑菌效果明显优于本实验中其他微藻多糖.海水小球藻粗多糖对大肠杆菌抑制作用最强,抑菌圈直径为13.0,mm,对金黄色葡萄球菌的抑菌圈直径为10.0,mm;而杜氏盐藻粗多糖对藤黄八叠球菌的抑菌效果最强,其抑菌圈直径为10.5,mm.其余微藻的抑菌效果不一,其中普通念珠藻和海水小球藻粗多糖表现出对革兰氏阴性菌大肠杆菌和革兰氏阳性菌藤黄八叠球菌和金黄色葡萄球菌的抑制作用;海水小球藻多糖对大肠杆菌和假丝酵母有一定的抑制作用;发菜念珠藻和聚球藻7942多糖只对大肠杆菌和金黄色葡萄球菌有抑制作用;铜绿微囊藻905粗多糖只对真菌假丝酵母有抑制作用;四尾栅藻粗多糖对大肠杆菌、藤黄八叠球菌和金黄色葡萄球菌都有抑制作用.

表2 微藻多糖的抑菌圈直径Tab.2 Antibacterial circle diameters of microalgae polysaccharides
本实验选取的10种微藻中,除铜绿微囊藻905外,其他9种微藻粗多糖均对大肠杆菌有明显的抑制作用,说明上述粗多糖提取物对革兰氏阴性菌有较好的抑制作用;杜氏盐藻、集胞藻6803、鱼腥藻7120和铜绿微囊藻905粗多糖均对藤黄八叠球菌有抑制作用;普通小球藻、普通念珠藻、鱼腥藻7120、铜绿微囊藻905、四尾栅藻和海水小球藻粗多糖均对真菌假丝酵母有抑制作用;发菜念珠藻、聚球藻7942、普通念珠藻、鱼腥藻7120、四尾栅藻和海水小球藻对金黄色葡萄球菌有抑制作用.其中海水小球藻粗多糖提取物对革兰氏阳性菌、革兰氏阴性菌和真菌均有明显抑制作用.
钱卓权等[18]研究发现,羊栖菜、鼠尾藻和海带等大型海藻提取物对大肠杆菌和金黄色葡萄球菌的抑菌圈直径最大分别为3.4,mm和6.3,mm.而本研究的发菜念珠藻、普通念珠藻和海水小球藻等对大肠杆菌和金黄色葡萄球菌的抑菌圈直径均在7.5,mm以上,分析可能微藻多糖含量高并有对抑菌起关键作用的官能团,也可能是因为提取粗多糖的温度、pH等因素不同,使得不同方法的多糖提取纯度有差异造成的.
2.3 微藻粗多糖的抗氧化活性
综合考虑供试微藻多糖得率和抑菌效果,并鉴于海水小球藻多糖活性的极少研究,因此后续实验只对海水小球藻粗多糖进行抗氧化活性测定.
2.3.1 海水小球藻粗多糖对DPPH自由基清除效果
DPPH自由基被广泛用于评价物质的抗氧化能力.海水小球藻粗多糖提取物对DPPH自由基存在清除效果(图1).在实验质量浓度范围内,它们随着质量浓度的增加对DPPH自由基的清除能力逐渐增加,当粗多糖质量浓度小于2,mg/mL,其清除DPPH自由基的效果尤为明显,海水小球藻粗多糖和BHT的EC50分别为3.498,mg/mL和1.219,mg/mL.表明海水小球藻粗多糖清除DPPH 自由基的能力较强.
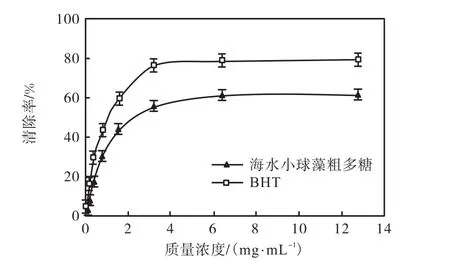
图1 海水小球藻粗多糖在不同质量浓度下清除DPPH自由基能力Fig.1 Scavenging rate of Chlorella polysaccharide on DPPH free radicals at different concentrations
2.3.2 海水小球藻粗多糖抗脂质过氧化效果
机体产生的自由基对机体造成损伤的一个重要的途径就是脂质过氧化,因此脂质过氧化程度也是检测抗氧化能力的重要指标.海水小球藻粗多糖在不同浓度下抗脂质过氧化能力如图2所示.

图2 海水小球藻粗多糖在不同浓度下抗脂质过氧化能力Fig.2 Anti-lipid peroxidation of Chlorella polysaccharide at different concentrations
在一定质量浓度范围内,随着海水小球藻多糖质量浓度的增加,其抗脂质过氧化能力增强,抑制率最高达到74.32%,,多糖质量浓度在0~1.6,mg/mL时,其抗脂质过氧化能力提高迅速.当多糖质量浓度达到3.2,mg/mL后,其抗脂质过氧化能力提高不明显并趋于稳定.海水小球藻粗多糖EC50为0.915,mg/mL (<1,mg/mL),表明其抗脂质过氧化能力非常高.
2.3.3 海水小球藻粗多糖对羟基自由基清除效果
在众多活性氧自由基中,羟自由基可致生物大分子如某些蛋白质、核酸、不饱和脂肪酸等严重损伤.因此羟自由基清除率也是检测抗氧化活性的一个重要参数.海水小球藻粗多糖在不同浓度下清除羟基自由基能力如图3所示.小球藻粗多糖在0~1.6,mg/mL时清除羟基自由基的能力明显提高,达到3.2,mg/mL后清除能力基本不变,清除率最大为75.37%,.其EC50值达到1.122,mg/mL,表明海水小球藻粗多糖清除羟基自由基能力较好.
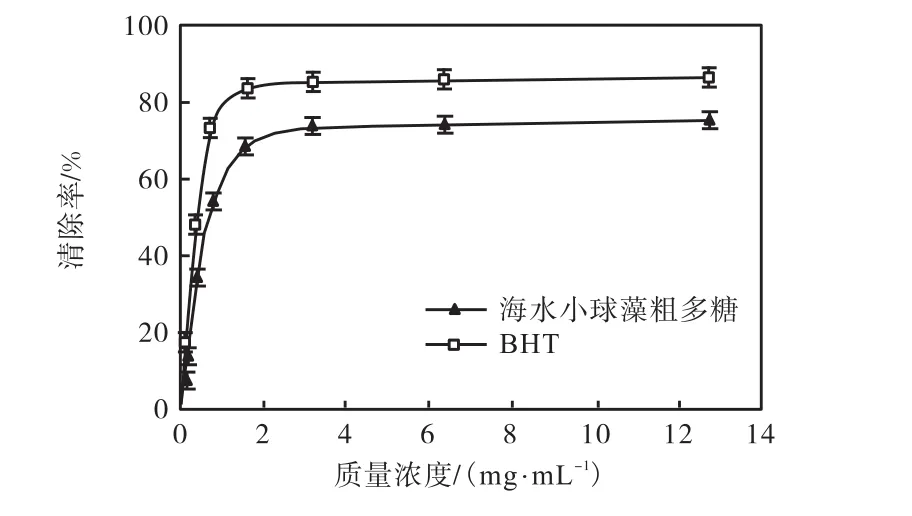
图3 海水小球藻粗多糖在不同浓度下清除羟基自由基能力Fig.3 Scavenging rate of Chlorella polysaccharide on hydroxyl radicals at different concentrations
2.3.4 海水小球藻粗多糖对超氧阴离子清除效果
超氧阴离子自由基是一种相对较弱的氧化剂,可间接引发脂质过氧化,因此常用清除超氧阴离子自由基的能力来反应抗氧化活性.由图4可知,海水小球藻粗多糖表现出很强的清除超氧阴离子能力,而且随着多糖质量浓度的增加而增强.粗多糖质量浓度达到1.6,mg/mL时,其清除率达到最高值74.47%,.海水小球藻粗多糖EC50达0.467,mg/mL,表明其清除超氧阴离子的能力非常强.
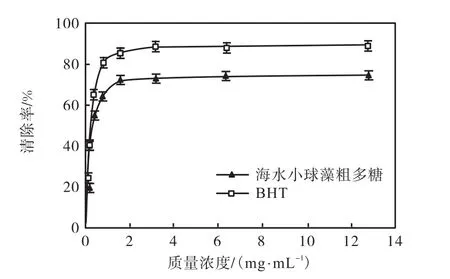
图4 海水小球藻粗多糖在不同浓度下清除超氧阴离子能力Fig.4 Scavenging rate of Chlorella polysaccharide on superoxide anion radicals at different concentrations
2.3.5 海水小球藻粗多糖还原力效果
抗氧化剂的还原力与其抗氧化性活性有十分密切的关系,因此可通过测定还原力来说明抗氧化活性的大小.由图5可知,海水小球藻粗多糖还原力呈质量浓度依赖性,即随着多糖质量浓度的升高,其还原力呈增强趋势.

图5 小球藻粗多糖在不同浓度下的还原力Fig.5 Chlorella polysaccharide reducing power at different concentrations
有研究表明[19–20]多糖的生物活性与其结构因素有关,如糖单元的类型和糖苷键的构型、多糖的取代基、多糖的空间结构、多糖的相对分子质量大小等都能影响其活性.而多糖抗氧化活性的强弱不是单一因素所致,是与多糖的相对分子质量、单糖组成、构型和糖苷键连接方式等结构特征的多方面因素有关,这也是影响多糖抗氧化活性差异的主要因素.本研究由于实验条件所限,只研究了粗多糖的抑菌活性及体外抗氧化活性.下一步将开展海水小球藻多糖的纯化及体内外抗氧化活性研究,预计纯化后的海水小球藻多糖将会有更好的抗氧化能力.
3 结 论
海水小球藻粗多糖对革兰氏阴性菌(大肠杆菌)和革兰氏阳性菌(藤黄八叠球菌和金黄色葡萄球菌)以及真菌(假丝酵母)的抑菌效果较好,抑菌圈直径分别为13.0、8.0、11.0、10.0,mm.
海水小球藻粗多糖抗氧化活性研究表明,在实验质量浓度范围内,海水小球藻粗多糖对DPPH清除率最高为61.2%,,抗脂质过氧化能力最高达74.32%,,羟基自由基清除率最大为75.37%,,超氧阴离子清除率最高达到74.47%,.随着质量浓度的增加,吸光度变大,还原力增强.
[1] 陈德力,刘平怀,时杰,等.微藻多糖及其应用[J].现代化工,2009,29(2):224–228.
[2] 陈玮,刘启顺,李曙光,等.微藻多糖生物活性研究进展[J].中国海洋药物杂志,2012,31(3):55-60.
[3] 周妍,王凌,孙利芹,等.5种海洋微藻多糖体外免疫调节活性的筛选[J].海洋通报,2010,29(2):194-198.
[4] 张丹,朱晓艳,温小斌,等.微藻培养基平衡pH的研究[J].水生生物学报,2014(3):401-406.
[5] 付宝龙,潘光华,朱大玲,等.不同氮源对骨条藻光合活性、生长和中性脂积累的影响[J].天津科技大学学报,2014,29(3):16-22.
[6] 杨勇,张凤英,陈岑,等.PDA培养基改良配方的研究[J].酿酒科技,2012(4):29-31.
[7] 高强,许保银,程逸冰,等.运用绿色荧光蛋白探讨肉葡萄球菌双精氨酸分泌途径[J].天津科技大学学报,2014,29(5):1-5.
[8] 吴曼,李文权,张赛金,等.海洋微藻多糖提取纯化条件的研究[J].海洋技术,2004,23(1):9-12.
[9] Goo B G,Beak G,Choi D J.Characterization of a renewable extracellular polysaccharide from defatted microalgae Dunaliella tertiolecta[J].Bioresource Technology,2013,129:343-350.
[10] 夏冰.螺旋藻多糖提取纯化方法研究[D].西安:西安建筑科技大学,2010.
[11] 刘筱潇,孙颖颖,管习超,等.3种海洋微藻多糖提取工艺的研究[J].海洋通报,2010,29(5):534-539.
[12] 张婧婧.蜈蚣藻多糖提取纯化及其活性研究[D].福州:福建农林大学,2012.
[13] 任明.复合多糖抗辐射和抗肿瘤作用及其机制研究[D].长春:吉林大学,2014.
[14] 祝子坪,李娜.桑黄菌多糖体外抗氧化作用[J].食品科学,2011,32(19):92-95.
[15] 郭守东.微生物胞外多糖的结构及其抗氧化活性研究[D].青岛:中国海洋大学,2010.
[16] 孙颖颖,王辉.球等鞭金藻胞外多糖的体外抗氧化活性和理化性质的初步分析[J].海洋科学,2013,37(5):45-49.
[17] 魏磊,郑朝辉,侯成林,等.四种野生食用菌粗多糖的抗氧化活性[J].微生物学通报,2011,38(10):1533-1539.
[18] 钱卓权,殷皓臻,黄晓林,等.三种海藻抑菌活性和抗氧化活性[J].浙江农业学报,2014,26(2):384-387.
[19] Duh P D,Tu Y Y,Yen G C.Antioxidant activity of water extract of Harng Jyur(Chrysanthemum morifolium Ramat)[J].LWT:Food Science and Technology,1999,32(5):269-277.
[20] Tsiapali E,Whaley S,Kalbfleisch J,et al.Glucans exhibit weak antioxidant activity,but stimulate macrophage free radical activity[J].Free Radical Biology and Medicine,2001,30(4):393–402.
责任编辑:郎婧
Anti-microbial Activities of Crude Polysaccharide Extracts from Ten Species of Microalgae and the Antioxidant Activities of Crude Polysaccharide Extracts from Marine chlorella vulgaris
XI Bo,SONG Donghui,SUN Jing,LIU Fenglu,DI Furong
(Tianjin Key Laboratory of Marine Resources and Chemistry,College of Marine Science and Engineering,Tianjin University of Science & Technology,Tianjin 300457,China)
This research studied the anti-microbial capacity of crude polysaccharide extracs from ten species of microalgae by using filter paper diffusion method,and the antioxidant activities of the optimized crude polysaccharide extracts were investigated.The results showed that the crude polysaccharide extracts from Marine chlorella vulgaris had more significant anti-microbial capacity and antioxidant activities than that of other microalgae.The inhibition zone of the crude polysaccharide against Escherichia coli,Micrococcus luteus,Monilia albican and Staphylococcus aureus were 13.0,mm,8.0,mm,11.0,mm and 10.0,mm,respectively.The antioxidant activities of the optimized crude polysaccharide extracts to eliminate DPPH free radical,superoxide anion radical,hydroxyl radical and anti-lipid peroxidation were up to 61.2%,,74.47%,, 75.37%, and 74.32%,,respectively.
microalgae;crude polysaccharide;anti-microbial capacity;antioxidant activities
Q949.6
A
1672-6510(2015)05-0020-06
10.13364/j.issn.1672-6510.20140140
2014-10-31;
2015-01-29
天津市海洋局科技兴海资助项目(KJXH2013-16)
席 波(1990—),男,山西人,硕士研究生;通信作者:宋东辉,教授,dhsong@tust.edu.cn.
