应用Kappa法检验IHA和ELISA在检测猪瘟抗体中的一致性
2015-01-03钱昌银詹松鹤朱良强
刘 华,钱昌银,詹松鹤,朱良强
(1.安徽省动物疫病预防与控制中心,安徽合肥 230096;2.合肥市动物疫病预防控制中心,安徽合肥 230096)
应用Kappa法检验IHA和ELISA在检测猪瘟抗体中的一致性
刘 华1,钱昌银2,詹松鹤1,朱良强1
(1.安徽省动物疫病预防与控制中心,安徽合肥 230096;2.合肥市动物疫病预防控制中心,安徽合肥 230096)
[目的] 比较IHA和 ELISA 2种基层使用较广泛的猪瘟抗体检测试剂盒检测结果的一致性。[方法]用产品A(IHA)和产品B(ELISA)对237份猪血清进行抗体检测,分别计算阳性率、阳性一致性、阴性一致性、符合率,并进行Kappa检验。[结果] 产品B检测的阳性率(73.8%)高于A(67.1%),且有统计学意义(p<0.01)。2种试剂盒共同检出128份猪瘟抗体阳性和31份阴性,阳性一致性为80.5%(95%置信区间:74.3%-86.7%),阴性一致性为39.7%(95%置信区间:28.9%-50.6%),符合率67.1%(95%置信区间:61.1%-73.1%);Kappa 值为0.214(95%置信区间:0.088-0.339)。[结论] 2种试剂盒的检测结果阳性率有差异,结果一致性强度为弱。
猪瘟;抗体;酶联免疫吸附试验;正向间接血凝试验;Kappa检验
猪瘟是由猪瘟病毒感染引起的猪急性、热性、高致死性传染病,对养猪业危害极大,是我国规定强制免疫的重大动物疫病之一,为科学评价其免疫效果,每年要求对其进行抗体监测。猪瘟抗体检测方法较多,正向间接血凝试验由于操作简单、不需要特殊设备,在基层被广泛采用;酶联免疫吸附试验(ELISA)能迅速检测大量样品,而且还具有敏感、特异等特点[1]。为比较两种方法的一致性,笔者对相同的猪血清样品分别进行检测,现将结果报告如下。
1 材料与方法
1.1 猪血清
237份猪血清,为本实验室保存的部分春季集中监测样品。
1.2 检测试剂
猪瘟间接血凝抗体检测试剂盒(批号:2014070105);猪瘟抗体液相阻断ELISA检测试剂盒(IDEXX,批号:49-40182)。
1.3 检测方法
1.3.1 产品A(IHA法)。在96孔微量反应板中每孔加入50μL稀释液;取待检血清加入第1孔,混匀,吸出50L转入第2孔,混匀后吸出50μL至第3孔,依次倍比稀释至第12孔,最后吸出的50L弃去。依照此法稀释其余血清和阳性对照;阴性对照血清依上述方法稀释到第3孔,5~6孔为稀释液对照。稀释后,各孔加入血凝抗原25μL,震荡混匀后覆膜,室温静置1.5~2h观察结果。判定标准为:以出现50%红细胞凝集的血清最大稀释度为该血清的抗体效价,抗体效价达1:16的为抗体阳性。
1.3.2 产品B(ELISA法)。在ELISA反应板上每孔加入50μL样品稀释液,对照孔分别加入50μL阳性血清和阴性血清,其余各孔加50μL待检血清。振荡混匀后覆膜,室温静置2h或过夜;充分甩去反应板中的液体,并用稀释后的洗涤液洗板3次,最后一次拍干;加入100μL辣根过氧化物酶标记的猪瘟病毒的酶标抗体加入各孔,覆膜室温孵育30min,洗板3次后,每孔加入100μL底物溶液,室温避光孵育10min,每孔加入100μL终止液,在450nm波长下测吸光度值。判定标准为:据OD450nm值计算阻断率,阻断率大于或等于40%为阳性,小于或等于30%为阴性。
1.4 统计学方法
采用SPSS 20.0 统计软件对两种试剂盒检测结果的阳性率进行χ2检验;结果一致性进行Kappa检验。Kappa值<0,一致性强度极差;0~0.2,微弱;0.21~0.4,弱;0.41~0.6,中度;0.61~0.8,高度;0.81~1.0,极强[2]。
2 结果
IHA和ELISA同时检测237份猪血清样本的结果比较见表1。
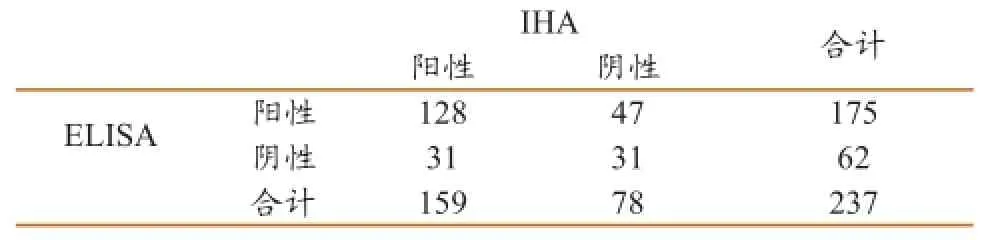
表1 2种方法检测猪瘟抗体的结果比较
两种试剂盒共同检出128份阳性,阳性率54.0%。IHA单独检出159份阳性,阳性率67.1%。ELISA单独检出175份阳性,阳性率73.8%,略高于IHA(χ2=11.11,p<0.01)。二者的阳性结果一致性为80.5%(95%置信区间:74.3%-86.7%),阴性结果一致性为39.7%(95%置信区间:28.9%-50.6%),总体样本结果的一致率为67.1%(95%置信区间:61.1%-73.1%)。经Kappa一致性检验,Kappa值为0.214(95%置信区间:0.088-0.339),表明两种产品的一致性为弱。
3 分析与讨论
在基层兽医实验室工作中,如何选择猪瘟抗体检测试剂盒往往困惑着检测人员。判断试验或试剂好坏的标准通常有两个指标,即敏感性(Se)和特异性(Sp)。国内一般参考农业部第 683 号公告有关规定进行试剂盒敏感性和特异性的评价[3],但基层兽医实验室无法获取金标准和标准血清,因此通过敏感性和特异性判断试剂的好坏存在困难。Kappa一致性检验方法是Cohen在1960年首先提出的,旨在评估不同检测方法的一致性,近年来在医学检验、流行病学及临床资料可靠性考察等方面的应用较为广泛[4-6],但在兽医实验室检测中应用极少[7]。Kappa值无法判定哪个试剂盒或方法较好,但Kappa值越大,表明两种结果可靠程度越高[4]。本次试验的结果一致性为弱,提示IHA和ELISA至少有一种结果不可靠。IHA和ELISA试验各有其优劣势,因此建议基层在开展猪瘟抗体检测时,根据实验室仪器和经费配套的情况和结果可靠性慎重选择。
应用Kappa一致性检验分析不同猪瘟抗体检测试剂盒检测结果一致性,比国内同类研究更加科学[8-11],为科学选择试剂提供了重要的参考依据。另外,在兽医实验室工作中,还常遇到评估两种检测方法、两名检验人员、两种设备检测结果的符合程度及用同一种方法进行多次测定的结果能否重现的问题,这些均可以用Kappa一致性检验进行评价,因而应用范围较广泛。笔者认为,在兽医实验室检测工作中,应重视和推广Kappa一致性检验,为评价试验结果提供更加科学的依据。
[1] 孙海燕,王在时,戴志红,等.猪瘟抗体检测技术的研究现状及发展趋势[J].中国兽药杂志,2009,43(5):40-44.
[2] Landis J R,Koch G G. The measurement of observer agreement for Gategorical data[J].Biometrics,1977,33: 159-174.
[3] 吴华伟,高金源,邓永,等. 国内5种猪圆环病毒PCV2抗体检测试剂盒的比较试验[J]. 中国兽药杂志,2011,45(6):11-12,15.
[4] 张波.Kappa一致性检验中流行病学中的应用举例[J].宁夏医学院学报,1995,17:(4):336-337.
[5] 宋斌斌,赵瀛,张春燕,等.两种抗中性粒细胞胞浆抗体检测方法的结果比较[J]. 检验医学,2011,26(7):457-460.
[6] 夏邦世,吴金华. Kappa一致性检验在检验医学研究中的应用[J]. 中华检验医学杂志,2006,29(1):83-84.
[7] 吴雪军,周彩琴,赵灵燕,等. 检测猪繁殖与呼吸障碍综合征病毒抗体的两种ELISA方法的比较及其应用[J].中国兽医杂志,2012,48(4):27-29.
[8] 陈少平,沙磊,张鲁安,等. 2种猪瘟抗体检测技术比较[J].中国兽医杂志,2003,39(8):26-27.
[9]马超英. 4种猪瘟病毒抗体检测方法的比较[J]. 动物医学进展,2013,33(10):128-131.
[10]李金海,张东,王泽州,等.用酶联免疫吸附试验和正向间接血凝试验检测猪瘟抗体[J].四川畜牧兽医,2003,30(7):24,27.
[11]刘秋,王前光,蒋国才.正向间接血凝法与阻断抗体ELISA法检测猪瘟抗体结果对比分析[J].黑龙江畜牧兽医:综合版,2014(1):67-68.
Liu Hua1,Qian Changyin2,Zhan Songhe1,Zhu Liangqiang1
(1.Anhui Center for Animal Disease Control and Prevention,Hefei,Anhui 230096; 2.Hefei Center for Animal Disease Control and Prevention,Hefei,Anhui 230096)
Application of Kappa-test for Evaluation of IHA and ELISA in CSFV Antibody Detection
[Objective]To compare the consistency between the 2 CSFV antibody kits(IHA and ELISA)widely used in veterinary labs at grassroots level in China. [Method]237 swine serum samples were tested by kit A(IHA)and kit B(ELISA). The positive rates,positive and negative consistence rates,coincidence rate were calculated separately,and the consistency was evaluated by Kappa test. [Results]The positive rate of kit B(73.8%)was higher than kit A(67.1%)and there was a statistically signifi cant difference(p<0.01).128 positive and 31 negative were detected by the 2 kits together,the positive consistency rate was 80.5%(95%CI=74.3%-86.7%)and the negative consistency rate was 39.7%(95%CI=28.9%-50.6%),the coincidence rate was 67.1%(95%CI=61.1%-73.1%).The Kappa value was 0.214(95%CI= 0.088-0.339). [Conclusion]The results showed that there was a signifi cant difference between the two testing positive rates and a weak consistency between the two kits.
classical swine fever;antibody;ELISA;IHA;Kappa-test
S852.651
:A
:1005-944X(2015)02-0069-03
朱良强
