TGF-β/Smads信号通路参与苦参素抑制糖尿病心肌病大鼠心肌纤维化及改善心功能作用
2015-01-02刘小军官功昌王军奎刘仲伟陕西省人民医院心内科西安710068通讯作者mail1011111280bjmueducn
赵 娜,潘 硕,张 勇,刘小军,官功昌,王军奎,刘仲伟(陕西省人民医院心内科,西安 710068;通讯作者,E-mail:1011111280@bjmu.edu.cn)
糖尿病在世界范围内呈现高发病率、高致死率及致残率。研究表明,合并心血管系统并发症的糖尿病患者致死率增加2倍以上[1]。其中糖尿病心肌病(diabetic cardiomyopathy,DbCM)是糖尿病所致心血管系统损害的重要并发症之一,最终临床结果表现为充血性心力衰竭、心源性休克以及猝死[2]。在DbCM病理进展过程中,心肌纤维化是导致心脏室壁僵硬、舒张及收缩功能不全、发生难治性心力衰竭的重要机制之一[3]。
目前大量研究显示转化生长因子-β1(transforming growth factor beta one,TGF-β1)能通过激活其下游Smads蛋白,调控相关细胞外基质(extracellular matrix,ECM)合成基因的转录,在心脏、肝脏、肺及肾脏等多种组织器官中参与纤维化的形成[4,5]。
苦参素(matrine),又称苦参碱,是存在于苦参、苦豆子以及广豆根等多种豆科植物中的一种生物碱,具有抗炎、抗肿瘤、免疫调节、抗心律失常、抗凋亡以及抗纤维化等多种生物学活性[6]。研究表明,苦参素具有较强的抗纤维化作用,其机制与抑制细胞因子分泌、抑制细胞增殖以及胶原合成等有关。苦参素能够通过影响 TGF-β/Smads抑制肝脏及肾脏纤维化[7]。本课题前期研究发现苦参素对糖尿病心肌病心功能具有明显的改善作用,但其具体机制尚不清楚。本研究拟探讨苦参素改善糖尿病心肌病心功能是否与改善心肌纤维化相关,并进一步明确TGF-β/Smads信号通路是否参与上述过程,为苦参素在糖尿病心肌病临床治疗中的应用提供实验依据。
1 材料与方法
1.1 动物分组与处理
将40只4周龄雄性SD大鼠(SPF级,西安交通大学动物实验中心),平均体重(112.44±7.62)g,随机分为四组,每组10只,分别为对照组(Ctrl)、苦参素组(Mat)、糖尿病心肌病组(DbCM)和糖尿病心肌病+苦参素组(DbCM+Mat)。以链脲佐菌素(streptozotocin,STZ,Sigma-Aldrich)10 mmol/L 单次腹腔注射制作大鼠糖尿病心肌病模型,注射剂量为60 mg/kg体重,以同体积生理盐水单次腹腔注射制作大鼠对照组。根据既往研究,啮齿类动物血浆葡萄糖浓度>16.7 mmol/L可认为糖尿病心肌病模型造模成功。在造模成功后8周,采用灌胃法使用苦参素溶液(Solarbio)处理大鼠,剂量为200 mg/(kg·d),灌胃液体积2 ml/100 g,共连续处理10 d。对照组仅予以单次腹腔注射生理盐水,苦参组先予以单次腹腔内注射生理盐水,随后应用苦参素溶液灌胃;糖尿病心肌病组仅予以单次腹腔注射链脲佐菌素,糖尿病心肌病+苦参素组先予以单次腹腔注射链脲佐菌素,随后应用苦参素溶液灌胃。
1.2 血流动力学检测
采用颈动脉心室内插管法评估各组大鼠心脏血流动力学指标。10%水合氯醛腹腔注射对大鼠进行麻醉,解剖右侧颈外动脉,插管后连接压力换能器采集生物信号,启动生物信息采集系统(AD Instrument)生物压力检测模块,检测左室收缩压(LVSP)以及左室舒张末压(LVEDP)。
1.3 免疫荧光检测大鼠心肌组织I型胶原蛋白表达水平
收集大鼠心室肌标本,OCT包埋剂包埋后置于冷冻台上冷冻,将组织制成厚度5 mm的冰冻切片。4%多聚甲醛中固定24 h,丙酮溶液4℃复温10 min,PBS洗涤后,30%过氧化氢处理及5%BSA封闭后,滴加I型胶原蛋白(collagenⅠ/ColⅠ)抗体(Abcam)37℃环境处理30 min;PBS洗涤后滴加Alexa Fluor 488荧光标记二抗(Invitrogen),甘油封片后在荧光显微镜下观察Ⅰ型胶原的表达。
1.4 蛋白质免疫印迹法评估大鼠心肌组织TGF-β/Smads信号通路活化情况
处死大鼠后收集心室肌标本,RIPA裂解液(Santa Cruz)匀浆、离心后获得心室肌组织总蛋白。BCA法测量组织蛋白浓度后,使用SDS-PAGE垂直电泳分离后,电转印至PVDF膜上。15%脱脂牛奶封闭后,分别以 TGF-β1(Santa Cruz)、Smad2(Abcam)、Smad3(Abcam)、磷酸化Smad2(phospho S467,Abcam)、磷酸化Smad3(phospho S423,Abcam)以及 GAPDH(Abcam)抗体,在4℃下孵育12 h。PBST洗涤后,室温下孵育30 min后ECL显色法显色,X线片曝光检测TGF-β1、Smad2、Smad3、磷 酸 化 Smad2 及 磷 酸 化Smad3蛋白水平表达。
1.5 统计学分析
实验数据均采用SPSS16.0进行统计学分析,数据比较采用单因素方差分析(ANOVA)以及studentt检验。P<0.05为差异具有统计学意义。
2 结果
2.1 苦参素对DbCM大鼠血糖及心功能的影响
与对照组相比,糖尿病心肌病组大鼠血浆葡萄糖浓度显著升高(P<0.05),苦参素处理并未对血浆葡萄糖水平产生明显影响(见图1A);糖尿病心肌病组大鼠LVSP显著降低(P<0.05,见图1B),同时LVEDP水平显著升高(P<0.05,见图1C)。与糖尿病心肌病组相比,糖尿病心肌病+苦参素组大鼠LVSP显著增加(P<0.05),LVEDP显著下降(P<0.05,见图1)。
2.2 苦参素处理对DbCM大鼠心肌纤维化的影响
心脏组织免疫荧光染色显示,与对照组相比,糖尿病心肌病组大鼠心脏组织中Ⅰ型胶原水平显著增加(P<0.05,见图2);与糖尿病心肌病组相比,糖尿病心肌病+苦参素组大鼠心脏组织内ColⅠ水平显著减少(P <0.05,见图2)。
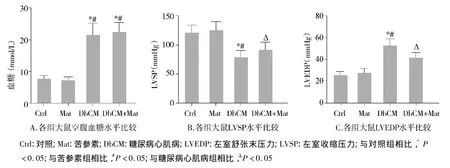
图1 各组大鼠空腹血糖水平及心脏血流动力学指标比较Figure 1 The fasting blood glucose level and the hemodynamic index in four groups
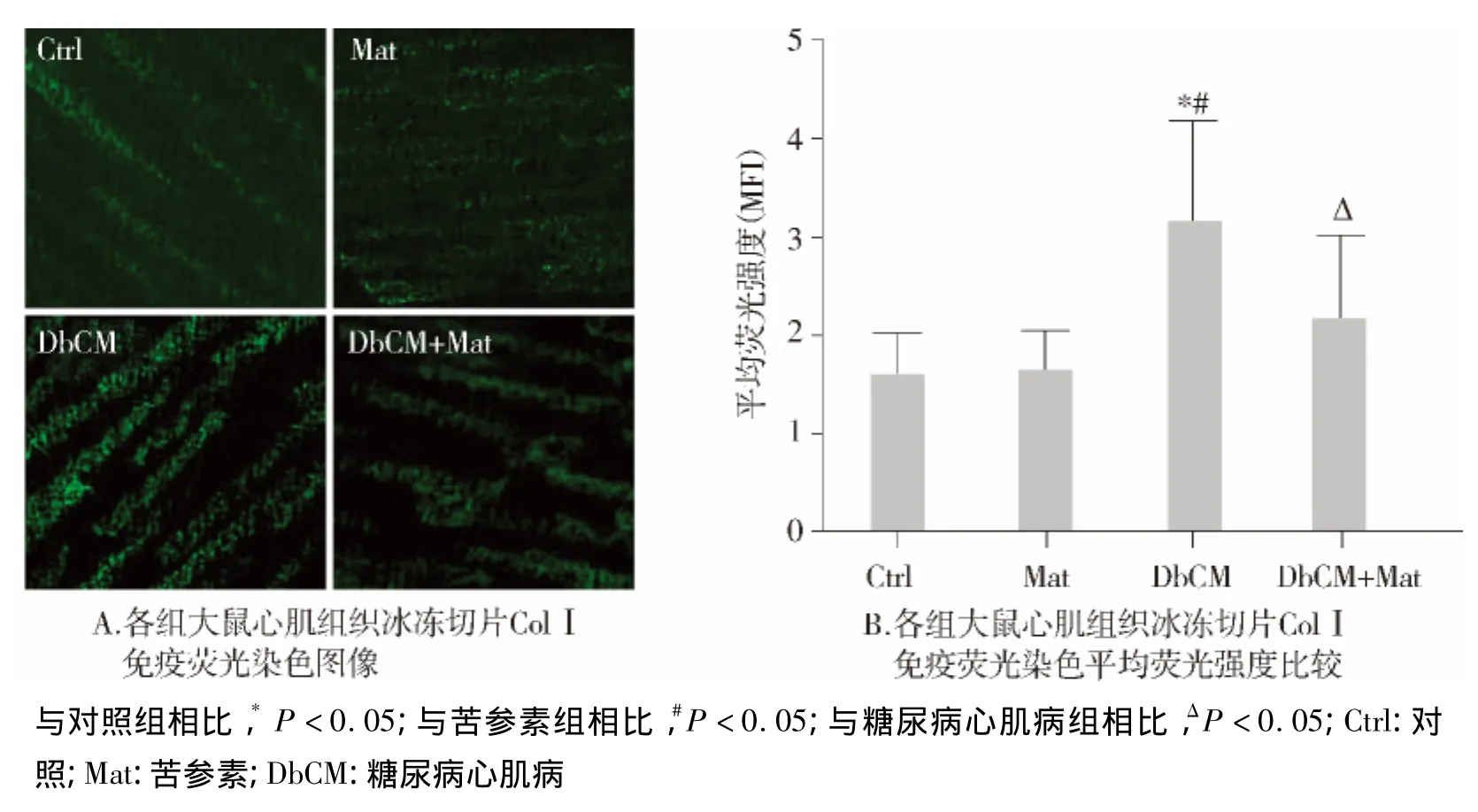
图2 各组心肌组织ColⅠ免疫荧光染色Figure 2 Immunofluorescence staining of collagenⅠcontent in four groups
2.3 苦参素处理对DbCM大鼠心肌组织TGF-β1/Smads信号通路的影响
各组大鼠心脏组织内TGF-β1/Smads信号通路的活化结果表明,与对照组相比,糖尿病心肌病大鼠心肌组织内 TGF-β1及ColⅠ表达水平,Smad2及Smad3的磷酸化水平均显著增加(各组P<0.05,见图3);与糖尿病心肌病组相比,糖尿病心肌病+苦参素组大鼠心脏组织内TGF-β1及ColⅠ表达水平,Smad2及Smad3的磷酸化水平均显著减少(各组P<0.05,见图3)。
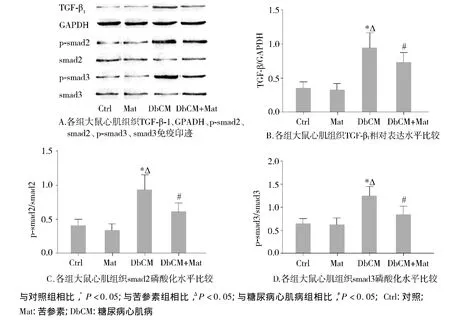
图3 各组心肌组织内TGF-β1/Smads信号通路激活情况Figure 3 The expression of TGF-β1/Smads signal pathway in the groups
3 讨论
DbCM指在糖尿病患者中发生的以心功能不全和心律失常为主要表现的特异性心肌病。DbCM中心功能不全的发生主要表现为心脏重塑。心脏重塑包括心肌细胞及非心肌细胞的重塑,其中非心肌细胞的重塑表现为成纤维细胞的增殖、分化为肌成纤维细胞,后者合成及分泌ECM导致心脏纤维化。心脏组织的ECM包括多种成分,其中Ⅰ型占80%以上[8],其表达的增多导致心肌僵硬度增加,顺应性下降,最终导致心室收缩及舒张功能受损[9]。本研究发现,DbCM大鼠表现出心脏舒张及收缩功能下降的同时伴有心肌组织中出现明显的Ⅰ型胶原沉积,提示DbCM大鼠心脏纤维化参与心脏功能下降过程。
目前认为,DbCM所致的心脏纤维化机制主要与高血糖导致的氧化应激、RAAS系统激活,内皮素、基质金属蛋白酶、胰岛素样生长因子(IGF-1)以及TGF-β1表达增加等有关[10]。既往研究结果显示,TGF-β1能够刺激心脏成纤维细胞合成Ⅰ、Ⅲ型胶原,同时对胶原酶原、基质酶原等产生抑制作用,最终导致ECM在心脏间质沉积,促进心脏纤维化,加重心力衰竭[11]。本研究发现,在DbCM大鼠心肌组织中的 TGF-β1表达水平明显升高,初步证实TGF-β1诱导的信号通路参与DbCM大鼠心脏纤维化过程。Smads蛋白是TGF-β1下游的重要信号分子,smad2及smad3磷酸化后,形成的异源寡聚体通过活化转录因子进一步上调下游胶原蛋白的表达[12]。本研究结果进一步发现DbCM大鼠心脏组织中Smad2和Smad3磷酸化水平显著增高,进一步证实在DbCM大鼠心肌组织中TGF-β1/Smads信号通路呈显著活化状态。
近年相关药理研究表明,苦参素具有抗炎、抗肿瘤、抗病毒以及抗纤维化等多种生物学活性,其抗肝脏、肾脏以及肺脏纤维化的活性均已得到研究证实及临床应用[13]。本研究在DbCM大鼠模型中发现苦参素亦能发挥抗心脏纤维化,改善心功能作用,同时对其可能的分子生物学机制做一初步探讨,结果发现,苦参素能够显著抑制DbCM心脏组织中活化的TGF-β1/Smads信号通路的相关分子表达(图3),揭示苦参素是发挥抗纤维化作用的靶点之一。
总之,在DbCM的发生发展过程中,心脏纤维化在心功能的不断恶化中扮演重要的角色。本课题发现苦参素通过减轻心肌纤维化改善DbCM的心功能,并证实TGF-β1/Smads信号通路是其作用的分子机制之一。研究结果进一步补充完善DbCM的发病机制,并为苦参素在DbCM治疗中的应用提供一定的理论基础。
[1]Monesi L.,Tettamanti M,Cortesi L,et al.Elevated risk of death and major cardiovascular events in subjects with newly diagnosed diabetes:findings from an administrative database[J].Nutr Metab Cardiovasc Dis,2014,24(3):263-270.
[2]孙丽,贺欣,王娟,等.核仁素在糖尿病性心肌病中的表达[J].中南大学学报医学版,2014,39(10):1056-1060.
[3]Ward ML,Crossman DJ.Mechanisms underlying the impaired contractility of diabetic cardiomyopathy[J].World J Cardiol,2014,6(7):577-584.
[4]Meng XM,Tang PM,Li J,et al.TGF-beta/Smad signaling in renal fibrosis[J].Front Physiol,2015,6:82.
[5]Cheng X,Gao W,Dang Y,et al.Both ERK/MAPK and TGF-Beta/Smad signaling pathways play a role in the kidney fibrosis of diabetic mice accelerated by blood glucose fluctuation[J].J Diabetes Res,2013,2013:463740.
[6]Huang WC,Chan CC,Wu SJ,et al.Matrine attenuates allergic airway inflammation and eosinophil infiltration by suppressing eotaxin and Th2 cytokine production in asthmatic mice[J].J Ethnopharmacol,2014,151(1):470-477.
[7]Gao HY,Li GY,Lou MM,et al.Hepatoprotective effect of matrine salvianolic acid B salt on carbon tetrachloride-induced hepatic fibrosis[J].J Inflamm(Lond),2012,9(1):16.
[8]Vadla GP and Vellaichamy E.Anti-fibrotic cardio protective efficacy of aminoguanidine against streptozotocin induced cardiac fibrosis and high glucose induced collagen up regulation in cardiac fibroblasts[J].Chem Biol Interact,2012,197(2/3):119-128.
[9]Li Q,Wang Y,Sun SZ,et al.Effects of benazepril on cardiac fibrosis in STZ-induced diabetic rats[J].Acta Cardiol,2010,65(4):431-439.
[10]Krenning G,Zeisberg EM,Kalluri R.The origin of fibroblasts and mechanism of cardiac fibrosis[J].J Cell Physiol,2010,225(3):631-637.
[11]Meyer A,Wang W,Qu J,et al.Platelet TGF-beta1 contributions to plasma TGF-beta1,cardiac fibrosis,and systolic dysfunction in a mouse model of pressure overload[J].Blood,2012,119(4):1064-1074.
[12]Zhai Y,Gao X,Wu Q,et al.Fluvastatin decreases cardiac fibrosis possibly through regulation of TGF-beta(1)/Smad 7 expression in the spontaneously hypertensive rats[J].Eur J Pharmacol,2008,587(1/2/3):196-203.
[13]Yu JL,Li JH,Chengz RG,et al.Effect of matrine on transforming growth factor beta1 and hepatocyte growth factor in rat liver fibrosis model[J].Asian Pac J Trop Med,2014,7(5):390-393.
