雌激素及其受体调节剂对APOE基因敲除小鼠胸主动脉CD40/CD40L的影响
2015-01-02赵焕英宋学英首都医科大学附属北京友谊医院北京00050首都医科大学医学实验与测试中心首都医科大学附属北京天坛医院通讯作者mailxuebingbjcom
陈 瑛,赵焕英,杨 颖,宋学英,郭 伟,薛 冰(首都医科大学附属北京友谊医院,北京 00050;首都医科大学医学实验与测试中心;首都医科大学附属北京天坛医院;通讯作者,E-mail:xuebing_bj@6.com)
近年来,随人口老龄化和生活水平的提高,动脉粥样硬化(atherosclerosis,AS)的发病率和致死率在不断攀升。尤其绝经后的中年女性发病率明显比绝经前发病率増高。AS是许多免疫炎性因子参与的一种慢性炎症疾病[1]。研究报道人白细胞分化抗原CD40及其配体CD40L作为上游炎性因子,参与了炎症、动脉粥样硬化和血栓形成的各个环节,成为AS病理过程中重要的研究因子[2-3]。除了抗炎治疗外,雌激素替代疗法也成为女性AS治疗重要手段,但雌激素治疗效果颇具争议,雌激素对AS有效治疗有很多报道[4]。但也有研究报道雌激素替代治疗并不能减少已有冠心病绝经后妇女AS发生,也不能减慢AS发展[5]。本研究观察不同绝经期小鼠给予雌激素治疗对雌激素受体(Estrogen receptor,ER)敏感性及对炎性因子CD40/CD40L系统影响。为进一步明确绝经后激素治疗对动脉粥样斑块稳定性影响提供证据。
1 材料与方法
1.1 实验动物及主要试剂和仪器
去势APOE(-/-)小鼠,品系C57BL/6J;戊酸雌二醇(又名补佳乐,美国拜耳公司),非特异性ER受体拮抗剂ICI 182780和特异性雌激素受体β(ERβ)拮抗剂 PHTTP均购于英国 TOCRIS公司;CD40、CD40L抗体(abcam),兔二步法检测试剂盒(北京中杉金桥公司),罗丹明标记羊抗兔IgG(H+L)二抗(KPL);Rneasy Lipid Tissue Kit(Qiagen),第一链合成试剂盒(Invitrogen),Power SYBR Green Master Mix(ABI公司);Masson染色试剂盒(Solarbio)。Nanodrop2000(Thermo Fisher),IQ5 real-time PCR 仪(Bio-Rad),莱卡显微镜等。
1.2 AS动物分组及给药方式
确定AS斑块形成,24只APOE(-/-)雌鼠随机分成三组:第一组给予生理盐水0.2 ml/d(对照组);第二组给予非特异ER拮抗剂ICI和雌激素(estrogen,E2):ICI皮下注射 0.13 ml/周 +E2 0.028 mg/(kg·d)(ICI+E2组);第三组给予特异性雌激素 β 受体(Estrogen receptor β,ERβ)拮抗剂 PHTTP和雌激素:PHTTP 0.13 ml/d+E2 0.028 mg/(kg·d)(PHTTP+E2组)。给药8周后麻醉处死。
1.3 免疫组化和免疫荧光染色
小鼠胸主动脉石蜡包埋组织切片8 μm,常规脱蜡到水,3%过氧化氢室温避光20 min阻断内源性过氧化物酶,蒸馏水洗2 min×3次。然后行枸橼酸热修复10 min后,0.01mol/L PBS洗5 min×3次;滴加5%牛血清封闭抗原,湿盒内30 min,倾去封闭液,滴加1∶100稀释CD40和CD40L抗体,置湿盒内于4℃过夜孵育。次日PBS洗10 min×3次,CD40玻片滴加1∶300兔两步法检测试剂盒二抗,后续程序按试剂盒说明操作。CD40L按1∶500滴加罗丹明标记的兔二抗,室温孵育1 h,PBS洗10 min×3次,DAPI复染细胞核,PBS洗3次后,甘油封片,以PBS代替一抗为阴性对照,调节曝光时间,在荧光显微镜下采集图片。
1.4 real-time PCR检测CD40/CD40L mRNA
新鲜主动脉血管组织液氮保护下研磨,按Rneasy Lipid Tissue Kit试剂盒说明书提取总RNA,Nanodrop2000检测提取核酸质量,质量合格的纳入下游实验,用第一链试剂盒进行反转录实验。PCR反应中以β-actin为内参基因,各基因序列见表1。定量PCR反应体系为:cDNA模板50 ng,上下游引物(10 μm)各 0.5 μl,Power SYBR Green PCR master mix 10 μl,补充水至 20 μl。然后进行 PCR 反应程序,95℃预变性10 min;95℃变性15 s,60℃退火1 min,在这步采集荧光信号,共40个循环;PCR反应之后熔解曲线分析程序:95℃ 1 min,40℃ 1 min,65-95℃逐渐升温,验证引物特异扩增。

表1 研究所用引物的序列Table 1 Primers used in the study
1.5 Masson 染色
主动脉血管常规石蜡切片脱蜡至水,按Solarbio公司试剂盒说明,先用Weigert铁苏木素染色液染细胞核5-10 min,酸性乙醇分化液分化、水洗。Masson蓝化液返蓝、水洗。蒸馏水洗1 min;再用丽春红品红染色液染色5-10 min,磷钼酸溶液洗1-2 min,弱酸工作液洗1 min;最后放入苯胺蓝染色液中染色1-2 min,弱酸工作液洗1 min。梯度乙醇快速脱水,二甲苯透明,中性树胶封片。
1.6 统计学分析
采用SPSS 13.0统计软件。各组之间 CD40/CD40L表达的差异应用Kruskal-Wallis检验,多重比较应用Student-Newman-Keuls法。P<0.05表示差异有统计学意义。
2 结果
2.1 免疫组化和免疫荧光结果
从图1可见,CD40/CD40L在动脉粥样硬化斑块中的内皮细胞、平滑肌细胞上均表达。CD40在斑块细胞内的表达尤其高(图1A,B中棕染部位)。CD40L在平滑肌上和血管内外膜上表达多。Leica图像分析软件显示对照组、PHTTP+E2组和ICI+E2组的CD40/CD40L 表达分别为 12.35 ±1.23,7.67 ±0.97,10.54 ±1.17。三组小鼠 CD40/CD40L 的表达量有显著不同(H=10.38,P=0.03)。与对照组相比,PHTTP+E2组CD40/CD40L表达明显下降(q=12.46,P=0.02),而ICI+E2组CD40/CD40L下降不明显。
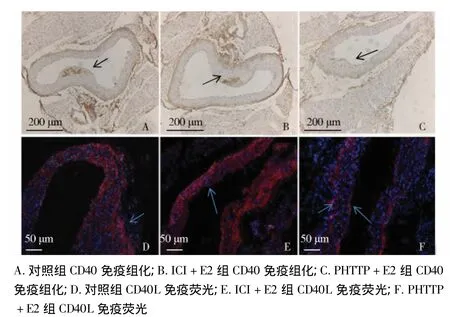
图1 CD40和CD40L在动脉粥样硬化斑块中的内皮细胞、平滑肌细胞上的表达Figure 1 Expression of CD40 and CD40L in the endothelial cells and smooth muscle cells of atherosclerotic plaques
2.2 real-time PCR 结果
提取三组小鼠主动脉总RNA,反转录cDNA,以内参基因β-actin为内参校准基因,用CD40/CD40L引物,用SYBRGreen染料法扩增CD40/CD40L mRNA,以相对定量2-ΔΔCt计算各组扩增 Ct值,以对照组表达量为1,其他两组相对它的表达结果显示,激素治疗组与对照组相比CD40和CD40L mRNA表达量显著下降,差异有统计学意义(P<0.05,见图2)。
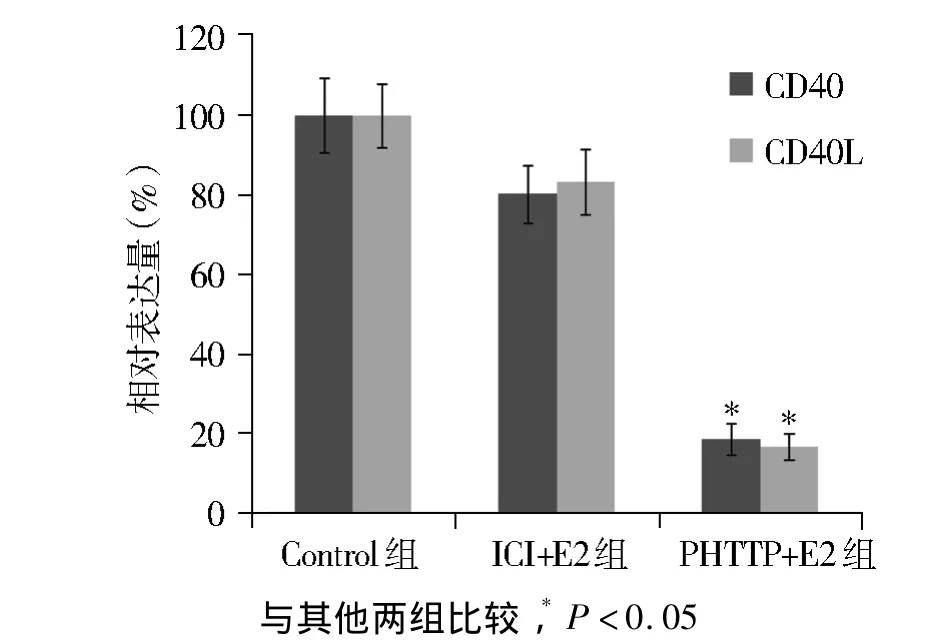
图2 CD40和CD40L mRNA在各组中的相对表达量Figure 2 The real-time PCR result of CD40 and CD40L mRNA expression in three groups
2.3 Masson 染色结果
Masson将细胞核染色为黑蓝色,肌原纤维染色为红色或淡红色,胶原纤维为蓝色。对照组胶原纤维在动脉粥样硬化斑块处明显减少,其次为ICI+E2组,而给予ERβ拮抗剂后,再给予雌激素治疗,胶原纤维表达量未见减少(见图3),说明纤维斑块稳定。
3 讨论
AS是一种全身性、慢性炎性反应性疾病,主要是细胞纤维基质、脂质和组织碎片的异常沉积,在动脉内膜或中层发生增生等复杂的病理变化[6]。妇女绝经前与同年龄男性相比,动脉硬化的发病率和死亡率低很多,但绝经后发生率迅速上升,60岁以后接近同年龄组男性水平,绝经是心血管疾病发病率和死亡率上升的独立危险因素。激素疗法能降低早期绝经心血管事件,而随绝经期延长雌激素替代治疗并不能减少已有冠心病绝经后妇女AS发生[7,8],推测绝经后激素替代疗法对不同绝经期心血管效应不同,与心血管系统的基础状态及血管上雌激素受体量有关[9,10]。ER是雌激素替代治疗AS的重要靶标,ER有ERα和ERβ两种类型。本课题早期建立绝经早期和晚期小鼠模型,发现主动脉ERα受体在绝经早期小鼠的表达量明显高于晚期小鼠,ERβ在早期和晚期AS小鼠中表达无明显差异[11]。本研究以不同激素调节剂进一步证明激素替代治疗作用机制,及对AS小鼠主动脉斑块稳定性相关炎性因子CD40/CD40L系统表达的影响。发现与对照组相比,PTHHP+E2组CD40/CD40L表达量明显下降;而非特异受体阻断剂ICI和雌激素(ICI+E2)组CD40/CD40L表达量下降不显著。说明ERα介导的激素治疗能显著降低CD40/CD40L系统的表达。

图3 主动脉壁Masson染色后胶原纤维在各组中的表达Figure 3 Expression of fibrils in each group after Masson staining of aortic wall
CD40/CD40L系统在AS的发生、发展及斑块破裂的各个环节发挥重要作用,它是炎性上游因子,可激活下游炎性因子如 IL-1、IL-6、IL-8、IL-12、IFN-γ、TNF-α 的高表达,从而级联放大炎性反应[12,13],同时它还可诱导多种基质金属蛋白酶(MMP)的表达,使 AS 斑块的纤维帽变薄[14],降解间质胶原[15],促进斑块内细胞发生凋亡,从而进一步引发斑块坏死核的形成[16]。因此对于AS激素替代治疗中检测CD40/CD40L含量是预判治疗效果的生化指标之一。Masson染色显示,对照组胶原纤维降解严重,结合炎性因子CD40/CD40L在对照组中含量最高,说明AS斑块中易触发炎性细胞反应,易导致斑块不稳定与心血管事件的发生。而加入特异雌激素受体ERβ抑制剂PTHHP和雌激素治疗后,胶原纤维含量稳定,非特异抑制剂和雌激素组胶原含量也有部分降解。说明雌激素通过ERα发挥治疗功能。ERα在AS中是心血管疾病的保护性因素,而ERβ可能妇女AS的不良因素。
[1]von Hundelshausen P,Schmitt MM.Platelets and their chemokines in atherosclerosis-clinical applications[J].Front Physiol,2014,8(5):294.
[2]Antoniades C,Bakogiannis C,Tousoulis D,et al.The CD40/CD40 ligand system:linking inflammation with atherothrombosis[J].J Am Coll Cardiol,2009,54(8):669-677.
[3]Wolf D,Jehle F,Michel NA,et al.Coinhibitory suppression of T cell activation by CD40 protects against obesity and adipose tissue inflammation in mice[J].Circulation,2014,129(23):2414-2425.
[4]Schierbeck L.Primary prevention of cardiovascular disease with hormone replacement therapy[J].Climacteric,2015,18(4):492-497.
[5]Anderson GL,Limacher M,Assaf AR,et al.Effects of conjugated equine estrogen in postmenopausal women with hysterectomy:the Women’s Health Initiative randomized controlled trial[J].JAMA,2004,291(14):1701-1712.
[6]Steinberg D.Atherogenesis in perspective:hypercholesterolemia and inflammation as partners in crime[J].Nat Med,2002,8(11):1211-1217.
[7]Vitale C,Mercuro G,Cerquetani E,et al.Time since menopause influences the acute and chronic effect of estrogens on endothelial function[J].Arterioscler Thromb Vasc Biol,2008,28(2):348-352.
[8]Bechlioulis A,Naka KK,Calis KA,et al.Cardiovascular effects of endogenous estrogen and hormone therapy[J].Curr Vasc Pharmacol,2010,8(2):249-258.
[9]Oviedo PJ,Hermenegildo C,Sobrino A,et al.Therapeutic dosages of oral or transdermal estradiol did not modify sCD40L levels in postmenopausal women[J].Gynecol Endocrinol,2008,24(6):354-357.
[10]Meyer MR,Barton M.ER alpha,ER beta,and gp ER:novel aspects of oestrogen receptor signalling in atherosclerosis[J].Cardiovasc Res,2009,83(4):605-610.
[11]陈瑛,蔺莉,金华.绝经早期和绝经晚期小鼠主动脉病理改变及雌激素受体表达的对比研究[J].中国全科医学,2010,13(30):3397-3399.
[12]Antoniades C,Bakogiannis C,Tousoulis D,et al.The CD40/CD40 ligand system:linking inflammation with atherothrombosis[J].J Am Coll Cardiol,2009,54(8):669-677.
[13]Hausding M,Jurk K,Daub S,et al.CD40L contributes to angiotensin Ⅱ-induced pro-thrombotic state,vascular inflammation,oxidative stress and endothelial dysfunction[J].Basic Res Cardiol,2013,108(6):386.
[14]Ding S,Zhang M,Zhao Y,et al.The role of carotid plaque vulnerability and inflammation in the pathogenesis of acute ischemic stroke[J].Am J Med Sci,2008,336(1):27-31.
[15]Wu M,Li YG.The expression of CD40-CD40L and activities of matrix metalloproteinases in atherosclerotic rats[J].Mol Cell Biochem,2006,282(1/2):141-146.
[16]Leroyer AS,Rautou PE,Silvestre JS,et al.CD40 ligand+microparticles from human atherosclerotic plaques stimulate endothelial proliferation and angiogenesis a potential mechanism for intraplaque neovascularization[J].J Am Coll Cardiol,2008,52(16):1302-1311.
