浓缩乳清蛋白粉溶液荧光光谱特性研究
2015-01-02赵挺
赵 挺
(蚌埠医学院 数理教研室,安徽 蚌埠 233030)
浓缩乳清蛋白粉是当今最为常见的蛋白质补充来源,被广泛应用于婴幼儿配方奶粉、运动员营养补剂,中老年保健品的生产.食品安全与原料质量密切相关,因此加强浓缩乳清蛋白粉的质量检测十分必要.我国市场上的浓缩乳清蛋白粉多从外国进口,这使得我们无法从生产源头监控其质量.同时随着人们对乳清蛋白粉日渐追捧,不法商贩往往通过掺假的方式(如加入大豆蛋白,植脂末等),追求暴利.而当前检测浓缩乳清蛋白粉的方法(见国标GBT11674-2010),大都是化学方法,其检验过程步骤繁琐,需时较长,这就需要找到一种快速有效的检测方法.荧光光谱技术可以快速提供待测样品物质成分,分子结构以及所处状态等大量信息.本文利用荧光光谱技术,分析浓缩乳清蛋白粉的荧光特性和形成机理.希望通过研究,可以为浓缩乳清蛋白粉的质量检测,提供一定的方法参考和理论依据.
1 浓缩乳清蛋白粉水溶液的三维荧光光谱
我们选择了3种品牌的进口浓缩乳清蛋白粉作为研究对象.通常人们在食用以浓缩乳清蛋白粉作为原料的类似食品(如婴儿配方奶粉等)时,往往是加水冲调制成饮料.为了能够更加接近浓缩乳清蛋白粉的实际存在环境,我们以浓缩乳清蛋白粉水溶液作为研究对象.由于三维荧光光谱法可以同时记录被测量样本荧光光强与激发和发射波长之间的关系,能够较全面的反映样本的荧光特性[1],为此我们首先检测浓缩乳清蛋白粉水溶液的三维荧光光谱.
1.1 实验仪器
本文所有实验均采用天津市津维电子仪表有限公司生产的F-450荧光分光光度计.
1.2 样品制备及实验方法
实验样品为市场上购买的三个品牌的浓缩乳清蛋白粉:
(1)Fonterra浓缩乳清蛋白粉,生产商为新西兰恒天然集团.
(2)Glanbia浓缩乳清蛋白粉,生产商为美国爱尔兰哥兰比亚营养有限公司.
(3)Hilmar浓缩乳清蛋白粉,生产商为美国希尔马奶酪公司.
这三种蛋白粉中的蛋白质含量均标称达到80%.在前期的实验中发现,浓度为1mg/ml的浓缩乳清蛋白粉水溶液的荧光强度最大,故我们以实验室去离子水为溶剂,分别将样品配制成浓度为1mg/ml的浓缩乳清蛋白粉水溶液.
实验中设置激发波长范围:240nm~310nm.为避免散射光的影响,设定起始发射波长为330nm,以此避开一级散射;设定最终发射波长为460nm,避开二级散射.同时设定激发波长和发射波长的扫描步距皆为1nm;激发与发射的狭缝缝宽均为5nm;扫描速12000nm/min.
1.3 实验结果
在实验中分别得到了三个品牌浓缩乳清蛋白粉水溶液在浓度为1mg/ml时对应的三维荧光光谱.我们分别采用三维投影图和等高线图两种方式表示出来,见图1.
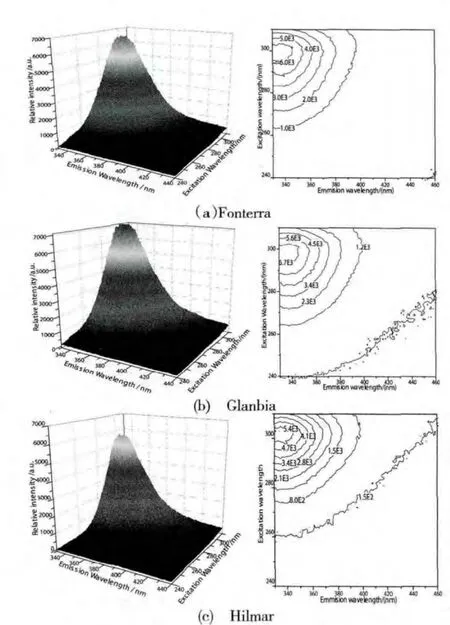
图1 不同品牌的三维荧光光谱和等高线图
从图中可以看出,三种不同品牌的浓缩乳清蛋白粉水溶液荧光光谱的谱峰分布规律很相似,当激发光波长改变时,发射峰波长都是在340nm附近,只是谱峰的强度略有不同,其中Glanbia的强度相对较大,其他两个品牌强度则稍弱,根据荧光的产生原理,当分子从第一激发态的最低振动能级跃迁至基态的任意能级时产生荧光,因此荧光的产生和分子被激发至哪个能级无关,即发射峰与激发波长无关[1],所以我们判断340nm附近的发射峰应是荧光峰.
当激发波长在240nm到260nm范围内,荧光峰的强度随着激发波长的增加而变强.当激发波长超过260nm时,荧光峰的强度开始迅速变大,在300nm附近达到最大值,之后开始减弱,我们推断激发峰处于300nm附近.
为了更准确地确定激发峰和发射峰的具体位置,我们又测量了三个品牌在发射光为340nm时的激发谱和激发波长为280nm时的发射谱,如图2和图3所示.通过比较可以看出,3种品牌的浓缩乳清蛋白粉水溶液,激发谱的范围主要都在240nm~320nm,激发峰在298nm处;发射谱都在300nm~500nm范围内,发射峰在336nm处.
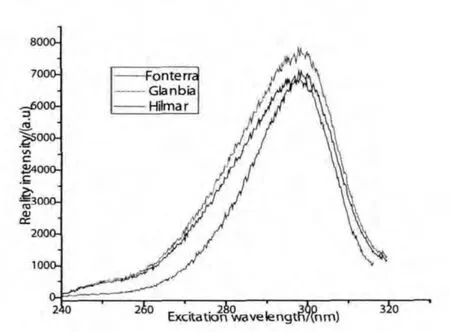
图2 不同品牌在发射光为340nm时的激发谱
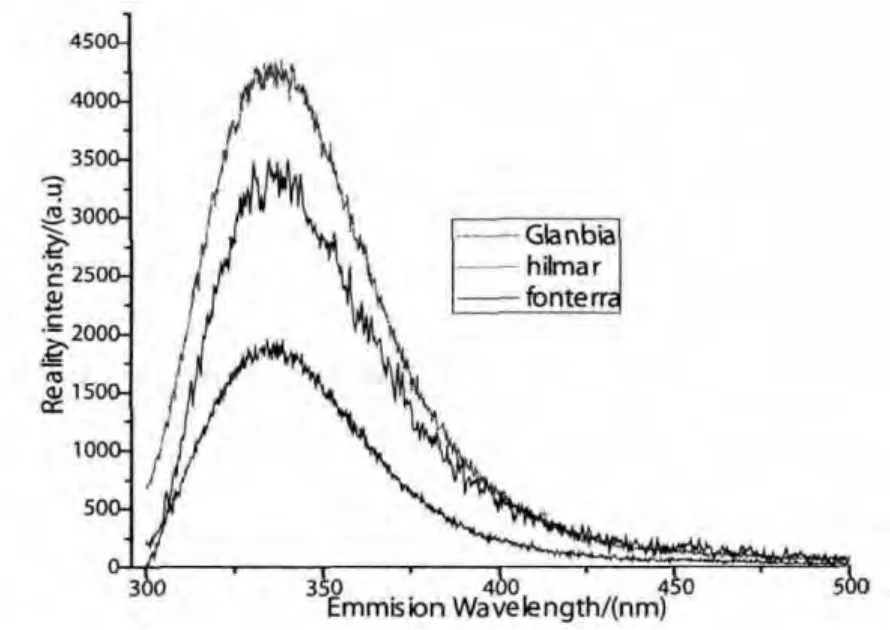
图3 不同品牌在激发光为280nm时的发射谱
由此可以确定,三者水溶液的激发谱和发射谱虽然强度不同,但变化规律相似,说明三个品牌的成分几近相同,所以在下面的实验中我们将Glanbia浓缩乳清蛋白粉水溶液作为样本.
1.4 实验结果分析
根据浓缩乳清蛋白粉的食品成分标签,我们发现浓缩乳清蛋白粉主要成分为蛋白质以及少量的乳糖和脂肪,我们知道蛋白质可以发出内源荧光,而色氨酸﹑酪氨酸﹑苯丙氨酸三者的残基正是这种荧光的主要来源[2],处于游离态时,这三种荧光生色团对应的荧光峰,见表1:
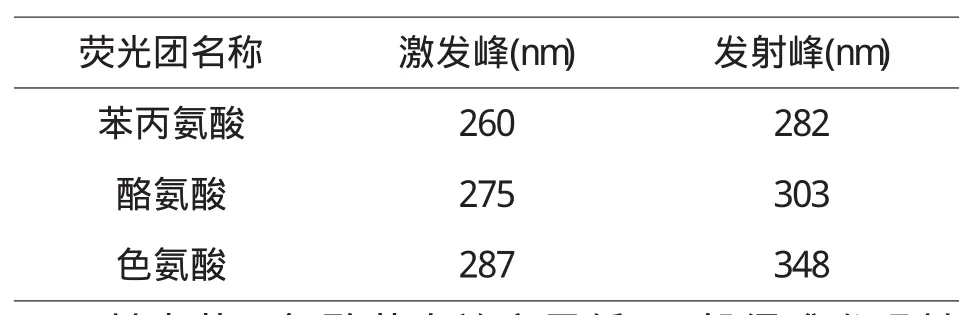
表1 3种生色团的荧光特征峰[2]
其中苯丙氨酸荧光效率最低,一般很难发现其荧光,因此常见的蛋白质荧光主要来自于其他两种氨基酸残基,蛋白质中的酪氨酸残基,其荧光特征峰位于313nm[2];而色氨酸残基对所处微环境的改变十分敏感,其荧光峰在325nm-352nm范围内变动[3].在实验中,三个品牌的荧光峰都位于336nm处,推测此荧光峰主要来自于蛋白质中的芳香族氨基酸残基.
2 不同浓度浓缩乳清蛋白粉水溶液的荧光光谱
不同浓度的浓缩乳清蛋白粉水溶液,其内部的荧光团所处环境以及溶液的透光能力都会有所变化,即溶液荧光特性会随着溶液浓度的改变而发生变化.因此我们又测量了不同浓度下的发射谱,确定了浓度与荧光强度,以及荧光峰位置之间的关系.
2.1 样品制备及实验方法
我们利用电子天平称取浓缩乳清蛋白粉,用少量去离子水溶解后移入容量瓶,分别配制成浓度为0.1mg/ml﹑0.2mg/ml﹑0.4mg/ml﹑0.6mg/ml﹑0.8mg/ml﹑1mg/ml﹑2mg/ml﹑4mg/ml﹑6mg/ml﹑8mg/ml﹑10mg/ml﹑20mg/ml﹑40mg/ml、60mg/ml﹑80mg/ml﹑100mg/ml共 16份样品,之后用滴管将溶液移入石英皿,测量相应的发射谱.
根据上节实验结果,我们将荧光分光光度计设置为:激发波长280nm;发射波长范围:300nm~500nm;步距1nm.激发和发射狭缝缝宽和扫描速度设置与上节相同.
2.2 实验结果
2.2.1 荧光光强与浓度的变化关系
我们将280nm光激发的、不同浓度的浓缩乳清蛋白粉水溶液荧光发射光谱,表示成三维荧光光谱的形式,如图4所示.从图中可以看出,随着浓度不断增加,溶液荧光强度先变大再变小,溶液浓度超过40mg/ml后,荧光强度十分微弱.为了便于进一步分析,我们将不同浓度段荧光强度的变化情况列于图5中.
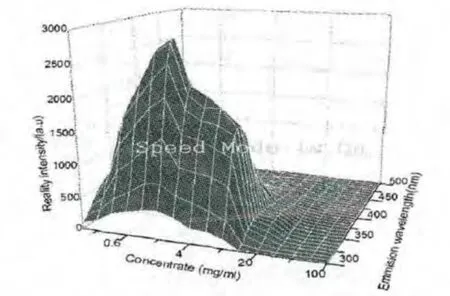
图4 浓度-发射三维荧光谱
由图5-a可以看出,当浓缩乳清蛋白粉水溶液浓度在0.1mg/ml~1mg/ml范围时,荧光强度不断增强,其中在0.1mg/ml~0.4mg/ml时,荧光强度变化最为迅速,强度扩大35倍.根据荧光强度与溶液浓度的关系有[1]:

当溶液浓度很低,公式近似为:

在图5-a中还可以看出,在0.1mg/ml~0.4mg/ml范围内,由于溶液浓度c较小,此时荧光强度与溶液浓度之间的关系符合(1-1)式,即两者成线性变化趋势.当超过0.4mg/ml后,由于浓度c较大,此时荧光强度又符合(1-2)式的规律,其增加速度趋缓,当浓度达到1mg/ml时,由于式(1-1)中的e-abc已趋近于零,此时荧光强度达到了最大值.溶液浓度大于1mg/ml时,如图5-a所示,荧光强度开始减少,即溶液进入荧光淬灭阶段,其中在1mg/ml~2mg/ml范围内下降速度变得缓慢.当浓度超过8mg/ml时,荧光强度又开始突然迅速减少,大于40mg/ml时,如图5-c所示,溶液荧光强度已十分微弱.
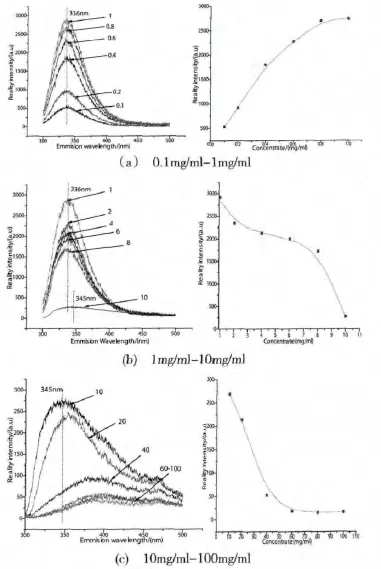
图5 不同浓度下的发射谱和浓度-荧光强度曲线
2.2.2 荧光峰与浓度的变化关系
观察图5可以发现,当浓缩乳清蛋白粉水溶液浓度小于8mg/ml时,其发射峰固定在336nm处.浓度超过8mg/ml之后,荧光峰持续红移.为了表示此时荧光峰位置与溶液浓度之间的关系,我们给出了图6,从图中可以发现,在10mg/ml~60mg/ml范围内,荧光峰呈线性的移动变化趋势.
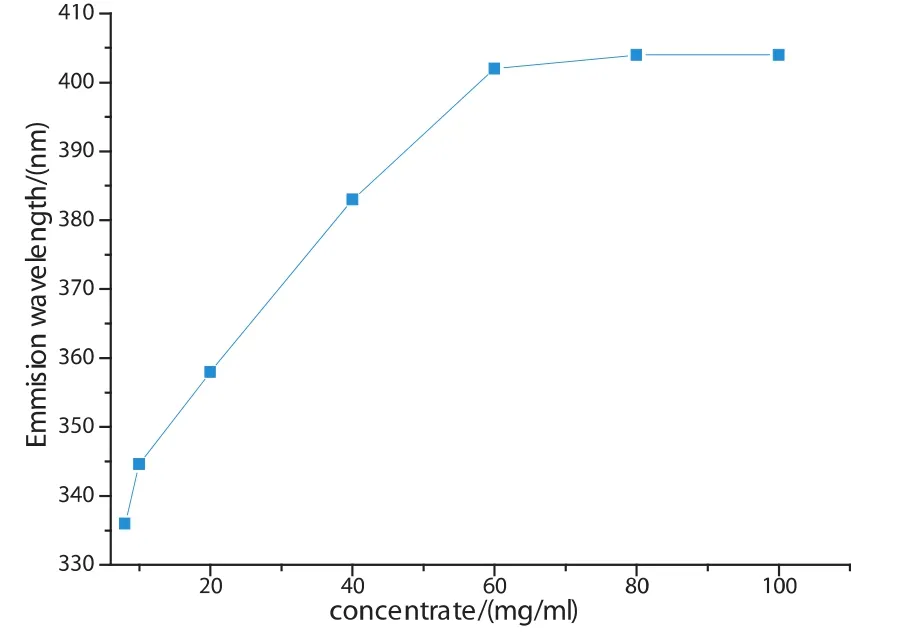
图6 不同浓度下发射峰的位置
2.3 实验结果分析
在实验中溶液浓度超过1mg/ml之后溶液荧光减弱,分析认为此现象由以下几点因素造成:
当浓度较高时,溶液中杂质引起的内滤效应变强,降低了激发光的强度;其次随着浓度的增大,位于比色皿前段的荧光物质对于入射光的吸收变强,而中后段的荧光物质受到的入射光减弱,使得处于比色皿的中段的的仪器探测窗口接受到的荧光减弱[1].当浓度超过40mg/m l时,溶液荧光强度十分微弱,由于过渡金属离子会与蛋白质分子发生配合作用,产生的配合物往往是不发光的,此即是过渡金属离子对蛋白质溶液荧光的静态猝灭作用[4].表2标明了浓缩乳清蛋白粉中主要的矿物质含量,从中可看出,虽然经过超滤等工序,但是浓缩乳清蛋白粉仍然存在有钠,钙,钾,镁,铁等微量的金属离子.表2中Fe为过渡金属离子[5],当其浓度增大时,造成了溶液发生静态猝灭.

表2 浓缩乳清蛋白粉中主要离子及其含量
一些金属离子会与芳香族配位体产生配合作用,在配位体的配位位置上产生正极化作用,从而使荧光峰红移[6].根据上节实验的结论,浓缩乳清蛋白粉水溶液的荧光主要来自于蛋白质中的芳香族氨基酸残基,因此我们认为当溶液浓度增大时,金属离子与残基这种配合作用会越来越明显,从而使得荧光峰不断红移.
3 小结
本文测量了市场上主要3个品牌的浓缩乳清蛋白粉水溶液的三维荧光光谱,确定了其激发峰和发射峰的位置,之后以Glanbia浓缩乳清蛋白粉水溶液为样本,测量了不同浓度下的发射谱,确定了浓度与荧光强度,以及荧光峰位置之间的关系,并对其产生机理做了分析.通过研究我们发现:
3.1 三个品牌的浓缩浓缩乳清蛋白粉水溶液,除强度以外,其三维荧光光谱分布规律相同,浓度为1mg/ml时,三个品牌激发谱的范围主要都在240nm到320nm,激发峰都在298nm处;发射谱都在300nm到500nm范围内,发射峰都在336nm处.经分析认为:浓缩乳清蛋白粉水溶液的发射峰,主要来自于蛋白质中的芳香族氨基酸残基.
3.2 280nm光激发的不同浓度的浓缩乳清蛋白粉水溶液荧光发射谱,在浓度小于1mg/ml时荧光强度存在线性增大,之后进入了荧光淬灭阶段.浓度小于8mg/ml时,发射峰均在336nm处,符合荧光发射特征.浓度超过8mg/ml之后荧光峰持续红移,在10mg/ml-60mg/ml范围内荧光峰的移动成线性变化趋势.我们认为含有芳族氨基酸残基的蛋白质与微量金属离子发生的配合作用,引起的正极化作用,使得浓度增大时荧光峰不断红移.当浓度超过40mg/ml时,溶液荧光强度十分微弱,我们提出这是浓缩乳清蛋白粉溶液中的过渡金属离子与蛋白质的配合作用,造成溶液发生静态猝灭所致.
〔1〕许金钩,王尊本.荧光分析法[M].北京:科学出版社,2007.7-13,154-160.
〔2〕陶慰孙.蛋白质分子基础[M].北京:人民教育出版社,1981.229.
〔3〕王守业,徐小龙,刘清亮,等.荧光光谱在蛋白质分子构象研究中的应[J].化学进展,2001,13(4):258.
〔4〕黄淑萍,陈亮,李玉红.比较与研究金属离子与三种蛋白的配位机理 [J].光谱学与光谱分析,1995,15(5):85-87.
〔5〕曹锡章,宋天佑,王杏乔.无机化学[M].北京:高等教育出版社,1994.931-940.
〔6〕陈国珍,黄贤智,郑朱梓,许金钩,王尊本.荧光分析法[M].北京:科学出版社,1990.108-109.
