江苏省葫芦科作物6种病毒的多重RT-PCR方法及应用
2015-01-01任春梅程兆榜周益军
任春梅, 程兆榜, 杨 柳, 缪 倩, 周益军
(江苏省农业科学院植物保护研究所,江苏 南京 210014)
葫芦科作物是一种仅次于禾本科、豆科和茄科作物的世界性重要经济作物,主要分布于热带和亚热带[1-2]。与大田作物相比,该类作物类型多,品种杂,单品种面积小。葫芦科作物病害中病毒病害的发生最为严重,国际病毒分类委员会(ICTV)发布的侵染葫芦科作物的病毒达38个确定种和9个暂定种[3]。不仅病毒种类繁杂,株系众多,而且不同病毒同时侵害引起的复合侵染现象普遍,病害发生年度间变化大,给防控和检测都带来很大难度[4]。
江苏省自种植结构调整发展高效农业以来,蔬菜种植业发展迅速,目前复种面积已达1.3×105hm2以上(含西瓜甜瓜),生产中病毒病是其主要病害问题之一。江苏省葫芦科作物病毒病原种类主要有 西 瓜 花 叶 病 毒[5](Watermelon mosaic virus,WMV)、小西葫芦黄花叶病毒[6](Zucchini yellow mosaic virus,ZYMV)、黄瓜花叶病毒[7](Cucumber mosaic virus,CMV)和黄瓜绿斑驳病毒[8](Cucumber green mottle mosaic virus,CGMMV),烟草花叶病毒[9](Tobacco mosaic virus,TMV)和番木瓜环斑病毒[10](Papaya ringspot virus,PRSV)偶有发生,在田间常发生复合感染现象。针对这一具体情况,开发简便、快捷、稳定、实用以及能够同时检测多个病毒的技术用于生产上病毒病害发生动态的监测,对于葫芦科作物病毒病防控至关重要。
多重RT-PCR检测技术最早由Chamberian等[11]于1988年提出,现已广泛应用于生命科学各个领域,在植物病毒病的检测中也已成为一种重要的检测手段[12-16]。与其他检测方法(生物学、血清学、电镜观察、单重 RT-PCR、核酸杂交等[17])相比,多重RT-PCR检测技术具有诸多优点,它能在同一个PCR体系中同时扩增多个目的基因,省时,省力,效率高,特别是节省昂贵的实验试剂和珍贵的实验材料。由于葫芦科病毒病的病原多,感染情况复杂,针对单一病毒的检测方法已远远不能满足检测工作的需求,所以国内外已有一些此类病毒的多重RTPCR检测报道。王威麟等[18]针对西瓜上普遍发生的ZYMV、WMV、TMV、SqMV和CMV 5种病毒建立了一步RT-PCR检测方法;赵丽等[19]建立了一种同时检测葫芦科作物3种主要病毒ZYMV、WMV和CMV的多重RT-PCR方法;Kwon等[20]用2个多重PCR系统检测侵染韩国葫芦科作物的7种病毒。根据前人的研究结果,本试验针对江苏省葫芦科作物病毒病发生的种类和特点,建立一种适用于江苏省葫芦科作物病毒病检测的多重RT-PCR方法,并对江苏省各地采集的样品进行检测应用,以期为江苏省葫芦科作物病毒病害的发生动态进行长期有效的监测,从而有针对性地采取防控措施。
1 材料与方法
1.1 毒源和试剂
WMV、ZYMV、CMV、CGMMV、TMV 和 PRSV 6种病毒的分离物于2012-2014年从江苏省南京市、盐城市盐都区、徐州市、洪泽县、淮安市等地发病的甜瓜、西葫芦、西瓜、南瓜等上采集,通过6种病毒的血清学诊断试剂盒(Agdia公司)找到6种病毒单独侵染的样品,并在西葫芦上接种繁殖,样品保存于-70℃冰箱中。总 RNA提取试剂 Trizol购自Invitrogen公司,Taq DNA 聚合酶、dNTP、BamHⅠ、SalⅠ购自大连宝生物公司,反转录酶M-MLV、RNA酶抑制剂购自Promega公司,琼脂糖凝胶回收试剂盒、大肠杆菌(E.coli DH5ɑ)感受态细胞、pMD18-T载体购自上海生工生物工程技术服务有限公司。
1.2 总RNA提取
在单重RT-PCR中,分别称取各病毒单独侵染叶片0.1 g;在多重RT-PCR中,分别称取等量单独侵染6种病毒的叶片,WMV、ZYMV、CMV和CGMMV 4种叶片充分混合(标记为H4),TMV和PRSV 2种叶片充分混合(标记为H2),H4、H2各取0.1 g。单重和多重RT-PCR中,都以健康西葫芦叶片为阴性对照(标记为CK),也取0.1 g。叶片在冰浴条件下迅速彻底研磨,然后用Trizol试剂盒按产品说明书提取总RNA。
1.3 引物设计与合成
根据GenBank上登录的各病毒相对保守基因的序列,应用Primer Premier 5.0软件设计各病毒特异性引物。引物设计完成后,通过NCBI对其特异性进行鉴定,结果表明均具有良好的特异性(表1)。引物由上海英俊生物技术公司合成。

表1 多重RT-PCR扩增6种病毒的特异性引物Table 1 Specific primers for multiple RT-PCR detection of 6 viruses
1.4 单重RT-PCR
以 WMV、ZYMV、CMV、CGMMV、TMV 和 PRSV单一病毒的RNA为模版,oligodT18引物[21]反转录得到 cDNA第一链,反应程序参照 M-MLV说明书,15.0 μl 反应体系为:3.0 μl RNA,1.0 μl oligodT18(10 μmol/L),6.0 μl DEPC-ddH2O,65 ℃变性5 min,迅速置冰上5 min;再加入2.5 μl 5×RT buffer,0.5 μl dNTP( 各 2.5 mmol/L),0.5 μl RNase Inhibitor(40 U/μl) 和 0.5 μl M-MLV 反转录酶(200 U/μl),短暂离心后DEPC-ddH2O补足至 15.0 μl,42 ℃ 水浴 1 h,70 ℃ 灭活 5 min,置冰上待用。
25.00 μl PCR 标准反应体系:15.75 μl ddH2O,2.50 μl 10 × PCR buffer(Mg2+free),1.50 μl MgCl2(25 mmol/L),2.00 μl dNTP Mixture(各 2.5 mmol/L),1.00 μl上游和下游引物混合物(各 10 μmol/L),0.25 μl r-Taq DNA 聚合酶(5 U/μl) 和2.00 μl cDNA模板。PCR反应程序:94℃预变性5 min;94℃变性50 s,53℃退火50 s,72℃延伸1 min,循环35次;72℃延伸10 min。取5 μl PCR产物经2%琼脂糖凝胶电泳,通过凝胶成像系统进行观察分析。
1.5 多重RT-PCR及体系优化
多重RT-PCR分4重和2重2个反应。4重和2重RT反应体系:加入混合提取的4种和2种病毒的总 RNA(H4 和 H2)各 3.0 μl,同时将 1.0 μl oligodT18的反转录引物加入同一反应管中,其他条件与单重RT相同。多重PCR体系在上述25.0 μl单重PCR标准反应体系基础上,4重PCR的4对引物混合物为4.00 μl[WMV和 CMV上下游引物各0.60 μl,ZYMV 和 CGMMV 上下游引物各 0.40 μl(各10 μmol/L)],2重 PCR 的2对引物混合物为2.00 μl[TMV 和 PRSV 上下游引物各0.5 μl(各10 μmol/L)],PCR反应程序参数同上。取5 μl PCR产物进行2%琼脂糖凝胶电泳。
在有效mRT-PCR条件下,考察影响mPCR的主要因素,对某一因素进行考察时,其他因素不变。在试验过程中对Taq DNA聚合酶浓度分别设0.02 U/μl、0.04 U/μl、0.06 U/μl、0.08 U/μl、0.10 U/μl和0.12 U/μl 6个处理,Mg2+浓度分别设 1.0 mmol/L、2.0 mmol/L、3.0 mmol/L、4.0 mmol/L、5.0 mmol/L和6.0 mmol/L 6个处理,dNTPs浓度分别设0.10 mmol/L、0.25 mmol/L、0.40 mmol/L、0.55 mmol/L、0.70 mmol/L和 0.85 mmol/L 6 个处理,退火温度分别设48℃、51℃、53℃、56℃、58℃和60℃,延伸时间分别设50 s、60 s、70 s、80 s、90 s和 100 s,循环次数设20、25、30、35、40 和45,进行多重 RTPCR体系优化。
1.6 多重RT-PCR产物的克隆和测序
多重RT-PCR扩增DNA靶片段采用Axygen柱式胶回收试剂盒(上海生工生物工程技术服务有限公司)回收,回收DNA溶于30 μl的溶解液中。回收产物与pMD18-T载体连接(参照pMD18-T试剂盒说明书)。连接产物转化大肠杆菌DH5ɑ感受态细胞,碱裂解法提取质粒,经PCR及酶切鉴定筛选重组质粒。每个分离物挑选2个阳性克隆进行测序,测序由上海生工生物工程技术服务有限公司完成。
1.7 多重RT-PCR的灵敏度测定
取混合样品H4和H2提取的病毒总RNA各5 μl,用BioPhotometer plus核酸蛋白检测仪测定OD260和OD280,计算各自总RNA浓度。分别以100、10-1、10-2、10-3、10-4和 10-5的倍数进行稀释,用建立的4重和2重RT-PCR方法进行检测,观察结果,分析2种多重RT-PCR方法检测的灵敏度。
1.8 多重RT-PCR的检测应用
应用建立的2种多重RT-PCR方法对2014年采自江苏省13个市县的210份葫芦科作物发病样品进行检测,并随机挑选15个样品用单重RT-PCR方法进行验证,分析江苏省葫芦科作物病毒病的种类及分布状况。
2 结果与分析
2.1 多重RT-PCR的特异性
用单重、4重和2重RT-PCR法分别从6种病毒单独侵染、4种病毒混合侵染(H4)、2种病毒混合侵染(H2)的组织中扩增出单一、4条或2条特异性目标条带,大小约为390 bp、480 bp、670 bp、1 200 bp、330 bp和400 bp,扩增条带的大小与待检6种病毒基因预期条带大小基本一致;阴性对照没有扩增出任何条带,且均未出现非特异性条带(图1)。结果表明:4重和2重RT-PCR具有较高的特异性,在 4重 RT-PCR中检测到 CMV、WMV、CGMMV和 ZYMV,在2重 RT-PCR中检测到TMV和PRSV,且两步反应中的各条带大小间有差异,可以明显地进行区分。
2.2 多重RT-PCR主要影响因素的优化
2.2.1 多重RT-PCR反应体系的优化 为了摸索出既高效又经济的多重RT-PCR扩增体系,在保证2个反应体系中都有足够量的r-Taq DNA聚合酶和dNTPs的基础上,设置 dNTPs、r-Taq DNA聚合酶、Mg2+的浓度梯度。结果(图2)表明:当dNTPs浓度在0.25~0.85 mmol/L时,4重和2重PCR都能产生较好的条带;当r-Taq DNA聚合酶浓度为0.10~0.12 U/μl时,4重PCR能扩增出4条带,2重PCR能扩增出2条带,浓度越高条带越亮;当Mg2+浓度达到3.0 mmol/L时,4重和2重PCR都能分别较好地扩增出4条和2条特异性条带,随浓度增加条带变亮,但4重PCR中浓度增加到一定值后反而减弱了mRT-PCR的扩增效果。因此优化后的4重和2重反应体系各参数最终都确定为:dNTPs浓度0.25 mmol/L,r-Taq DNA 聚合酶浓度为 0.10 U/μl,Mg2+浓度3.0 mmol/L。

图1 多重RT-PCR的特异性Fig.1 Specificity of multiple RT-PCR
2.2.2 多重RT-PCR反应条件的优化 对4重和2重PCR的退火温度、循环次数和延伸时间都进行了优化。结果(图3)显示,4重PCR的退火温度从53℃到58℃都能获得理想的条带,但61℃时扩增效果变弱;循环数在 30~40次时扩增的条带都较清晰,延伸时间80 s时PCR条带的亮度最为合适。2重PCR的退火温度从53℃到61℃时条带都较为清晰;循环数25~35次时均能获得特异而清晰的目的条带;延伸时间从50 s到80 s均能同时出现2条带,但在60s时条带最清晰。因此最终确定多重RT-PCR反应的条件为:4重PCR的退火温度为53℃,循环次数35次,延伸时间80 s;2重PCR的退火温度为56℃,循环次数30次,延伸时间60 s。
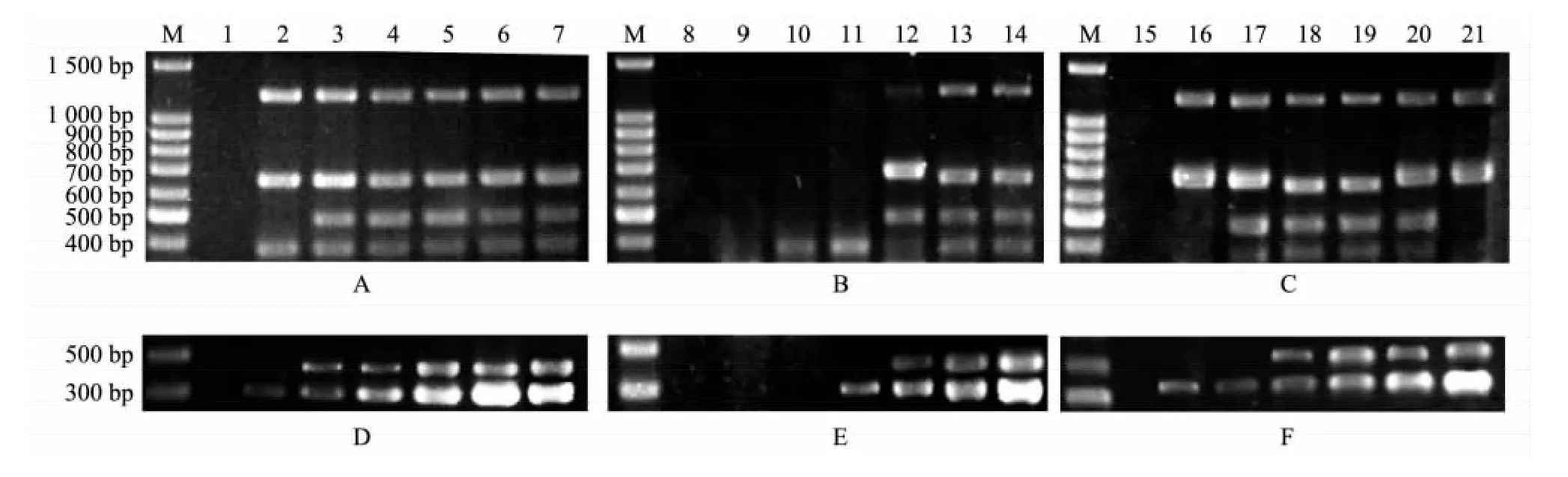
图2 多重RT-PCR反应体系的优化Fig.2 Optimization for the reaction conditions of mRT-PCR

图3 多重RT-PCR反应条件参数的优化Fig.3 Optimization for the reaction conditions of mRT-PCR
2.3 多重RT-PCR产物的序列分析
4重和2重RT-PCR扩增产物经割胶回收,分别与pMD 18-T vector进行体外连接,挑取阳性克隆,提取质粒测序。测序结果表明,ZYMV、WMV、CMV、CGMMV、TMV和PRSV的扩增产物序列分别由1 180、485、389、660、410 和325 个核苷酸组成,与设计的PCR产物大小相同,分别为ZYMV-cp基因、WMV-cp基因、CMV-复制酶基因、CGMMV-cp基因、TMV-cp基因和PRSV-cp基因的部分序列。序列同源性分析结果表明,所得序列与GenBank中参考序列的同源性分别达到98.25% 、99.01%、99.93%、98.22%、97.33%和99.32%,证明了2种多重RTPCR检测结果的可靠性。
2.4 多重RT-PCR的灵敏度
经核酸蛋白检测仪测定H4和H2的RNA浓度分别为 35.60 μg/μl和 19.33 μg/μl。灵敏度检测结果(图4)显示,4重RT-PCR中RNA稀释倍数为10-2后有些病毒的条带微弱或消失,这可能与组织中病毒含量的过低有关,所以能够同时检测到4条清晰条带的最大稀释倍数为10-2,也即该体系中4重RT-PCR的RNA检测浓度为0.356 μg/μl;2重RT-PCR中RNA稀释倍数为10-3时能够同时检测到2条清晰的条带,所以该体系中2重RT-PCR的RNA检测浓度为19.33 ng/μl。

图4 2个多重RT-PCR的灵敏度Fig.4 The sensitivities of two mRT-PCR techniques
2.5 多重RT-PCR的检测应用
应用建立的2种多重RT-PCR方法对采自江苏省13个市县210份葫芦科作物病样进行检测。首先随机选出15个病样分别进行单重RT-PCR检测,再进行2种多重RT-PCR检测(图5)。将检测图谱进行比较,结果显示各样品多重RT-PCR检测结果与单重RT-PCR结果相一致,说明建立的2种多重RT-PCR方法可应用于田间样品的检测。田间样品检测结果(表2)表明,210份检测样品中单独侵染率仅为24.76%,复合侵染率达75.24%,其中有3个病样为6种病毒的复合侵染。进一步分析发现江苏省13个市县葫芦科作物病毒的种类以ZYMV和CGMMV为主,主要分布在西瓜、南瓜、葫芦、甜瓜等作物上,WMV和CMV次之,主要分布在黄瓜、甜瓜、南瓜等作物上,TMV和PRSV只在极少数作物上检测到,主要在丝瓜、南瓜等上。6种病毒没有明显的地域分布倾向,究其原因可能与这几种病毒的传播途径有关。

表2 田间210份葫芦科作物病样多重RT-PCR检测结果Table 2 Detection results of 210 naturally infected samples collected from fields by multiplex RT-PCR

图5 多重RT-PCR的检测应用Fig.5 The detection of six viruses in Cucurbit crops by mRT-PCR
3 讨论
江苏省是农业大省,近年来设施农业迅猛发展,据统计近几年江苏省葫芦科作物的种植面积每年稳定在400 000 hm2左右,其中西瓜和甜瓜种植面积约130 000 hm2,已经成为江苏省农业的支柱产业之一。设施农业的发展,使病毒及其传毒蚜虫在棚内顺利越冬后,在早春即散布于棚外并大量复制和繁殖,从而导致病害的提前发生和生长季节早期病毒累积量的偏高,形成恶性循环。以上因素加大了病毒病的发生频率,提高了流行风险,从而加重了病害。根据前期我们对江苏省设施大棚中葫芦科作物病毒病的调查,发现4种主要病毒(ZYMV、WMV、CMV、CGMMV)对葫芦科作物种植业造成的危害日趋严重,2种次要病毒(TMV和PRSV)的危害也不容忽视。本研究根据江苏省葫芦科作物生产上病毒病的发生情况,建立了能同时检测这6种病毒的多重RT-PCR方法,在葫芦科作物的栽培生产中,能够既快速、准确,又简便、经济地检测出幼苗带毒情况。对控制病害在田间的发生,减少经济损失,抗病筛选和病害流行预测具有十分重要的意义。
考虑到6种病毒的特点和数量,将其检测分成2个RT-PCR反应进行,一个PCR反应中同时检测4种主要病毒(WMV、ZYMV、CMV、CGMMV),另一个RT-PCR反应中同时检测2种次要病毒(TMV和PRSV)。该方法的关键因素为特异性引物的选择,首先使用DNAMAN5.0软件,对GenBank中收录的WMV、ZYMV、CMV、CGMMV、TMV 和 PRSV 病毒各株系、各区域分离物全基因组序列进行比对,确定病毒序列中相对保守区域,在选定的保守区域内使用Oligo5.0软件设计引物,再通过BLAST分析确保引物的特异性,还利用DNAStar 5.0对这6对引物进行了同源性、二级结构分析,以避免2个多重RTPCR反应引物之间形成复杂的二级结构及引物二聚体而影响扩增效果,最终选择了G+C含量为45% ~60%、退火温度相近、扩增片段大小易区分的6对引物。在反转录中选择了OligodT18作为其引物,此引物较为适合植物样品RNA的反转录,能够较为完整地保留cDNA基础含量,特异性较高,而且只需一次反转录,大大节省了时间和实验材料。在2个RT-PCR反应中又整合优化了各自体系所需的引物、Mg2+、DNA聚合酶、dNTPs浓度,以及退火温度、延伸温度和循环数,对各自PCR体系的灵敏度进行了测定,最终建立了6种病毒多重RT-PCR的方法。用此方法对江苏的210份葫芦科作物病样进行检测,结果显示多重RT-PCR和单重RT-PCR检测结果相当,充分说明了多重RT-PCR方法的实用性。跟踪监测2014年江苏省设施大棚中葫芦科作物的病毒种类,发现主要以种子传播的CGMMV和ZYMV病毒为主,提示我们此病害的控制应从源头出发,对种子和幼苗进行早期检测和处理,也体现了快捷、高效、低成本检测方法研制的必要性。
本研究根据江苏省生产上葫芦科作物易受多种病毒复合侵染的特点,选择性地对这些病毒进行了2种多重RT-PCR筛选鉴定,较之单一RT-PCR方法具有能节省时间、降低成本、提高效率等优点。以往报道的5重及以上RT-PCR方法[12-16]在实际应用过程中存在干扰因素多、灵敏度低和检出率低等缺陷,本方法能够减少污染和反应中的影响因素,提高检测灵敏度,大大降低漏检几率。在葫芦科作物的生产上,本方法可实现对病毒病的早期诊断,实现实验室内对病毒病害种类的快速、高效、低成本、大批量检测,对病害的流行预测预报具有十分重要的意义。
[1] PROVIIDENTI R.Resistence to viral disease of cucurbits.Resistence to viral disease of vegetables:genetics and breeding[M].Oregon:Timer Press,1993:8-43.
[2] ABOU J Y,SOBH H E,ZAMMAR S,et al.Incidence and management of virus disease of cucurbits in Lebanon [J].Crop Protection,2000,19(4):217-224.
[3] 陈洁云,陈集双,柴立红,等.两种葫芦科病毒的分子检测和致病性研究[J].植物病理学报,2003,33(5):449-455.
[4] 古勤生.葫芦科作物主要病毒病防治研究进展[J].中国西瓜甜瓜,2002(4):27-30.
[5] 任春梅,程兆榜,缪 倩,等.江苏西瓜花叶病毒的分子鉴定和序列分析[J].南方农业学报,2013,44(9):1464-1470.
[6] LIN S S,HOU R F,YEH S D.Hetrodup lexmobility and sequence analyses for assessment of variability of zucchini yellow mosaic virus[J].Phytopathology,2000,90(3):228-235.
[7] LIN H X,RUBIO L,SMYTHE A,et al.Genetic diversity and biological variation among California isolates of cucumber mosaic virus[J].Journal of General Virology,2003,84:249-258.
[8] 任春梅,程兆榜,缪 倩,等.江苏黄瓜绿斑驳花叶病毒的鉴定[J].江苏农业学报,2013,29(1):65-70.
[9] 黄金光,邓丛良,范在丰,等.烟草花叶病毒丁香分离物的分离与鉴定[J].植物病理学报,2004,34(3):215-222.
[10] KO S J,LEE Y H,CHO M S,et al.Theincidence of virus diseases on melon in Jeonnam Province during 2000-2002[J].Plant Pathol J,2007,23:215-218.
[11] CHAMBERIAN J S,GIBBS R A,RANIER J E,et al.Detection screeninn of the duchenne muscular dystrophy locus via multiplex DNA amplifieation [J].Nuel Acids Res,1988,16:1141-1156.
[12] DAI J,CHENG J L,HUANG T,et al.A multiple reverse transcription PCR assay for simultaneous detection of five tobacco viruses in tobacco plants[J].Journal of Virological Methods,2012,183:57-62.
[13] BHAT A I,SIJU S.Development of a single-tube multiplex RTPCR for the simultaneous detection of cucumber mosaic virus and piper yellow mottle virus associated with stunt disease of black pepper[J].Current Science,2007,93:973-976.
[14] UGA H,TSUDA S.A one-step reverse transcription-polymerase chain reaction system for the simultaneous detection and identification of multiple topovirus infections[J].Phytopathology,2005,95:166-171.
[15] SUGIYAMA S,MASUTA C,SEKIGUCHI H,et al.A simple,sensitive,specific detection of mixed infection of multiple plant viruses using macroarray and microtube hybridization[J].Journal of Virological methods,2008,153:241-244.
[16]牛建新,马兵钢,何 梅,等.库尔勒香梨主要病毒多重RTPCR检测技术研究[J].植物病理学报,2006,36(1):12-21.
[17] YU C,WU J X,ZHOU X P.Detection and subgrouping of cucumber mosaic virus isolates by TAS-ELISA and immunocapture RT-PCR [J].Journal of Virological Methods,2005,23:155-161.
[18]王威麟,张 昊,于祥泉,等.侵染西瓜的5种病毒ZYMV、WMV、TMV、SqMV和CMV的多重 RT-PCR检测体系的建立与检测应用[J].植物病理学报,2010,40(1):27-32.
[19]赵 丽,古勤生,陈红运,等.葫芦科作物3种主要病毒的多重RT-PCR方法的建立[J].果树学报,2008,25(5):703-707.
[20] KWON J Y,HONG J S,KIM M J,et al.Simultaneous multiplex PCR detection of seven cucuibit-infecting viruses[J].Journal of Virological Methods,2014,206:133-139.
[21] NIE X H,SINGH R P.Detection of multiple potato viruses using an oligo(dT)as a common cDNA primer in mutiple RT-PCR[J].Journal of Virological Methods,2000,86:155-161.
