不同培养条件对摩西球囊霉生长发育的影响
2014-12-29周国英徐海舟闫瑞坤
周国英 ,徐海舟,晏 俊 ,张 磊 ,伍 南 ,闫瑞坤
(1.中南林业科技大学,教育部经济林培育与保护重点实验室,湖南 长沙 410004;2.阿克苏地区林业局,新疆 阿克苏 8430002)
不同培养条件对摩西球囊霉生长发育的影响
周国英1,徐海舟1,晏 俊1,张 磊1,伍 南2,闫瑞坤2
(1.中南林业科技大学,教育部经济林培育与保护重点实验室,湖南 长沙 410004;2.阿克苏地区林业局,新疆 阿克苏 8430002)
为了获得大量杉木内生菌根菌的接种菌剂,以摩西球囊霉Glomus mosseae为研究对象,对其宿主植物、培养基质、栽培密度和营养液浓度四方面培养因素进行了研究。结果表明:摩西球囊霉的最佳宿主植物为高粱,最佳培养基质为3号培养基质处理,即沙:蛭石:土的比例为2∶1∶1(体积比),最佳栽培密度为20株/5L盆,最佳的营养条件为追施用浓度为30%的Hoagland’s营养液。
摩西球囊霉;AM真菌;扩繁;生长发育
AM菌根真菌(Arbuscular mycorrhizal fungi)广泛分布于自然界,能与世界上80%以上的植物形成共生体系[1-2]。大量研究表明,AM菌根真菌能促进宿主对土壤中矿质元素P、N、K、Cu、Zn等元素的吸收,从而促进植物生长,提高宿主根系对根部病菌的抵抗力和增强植物对干旱、高温、重金属的抗性[3-5]。李琳等[6]对我国南方杉木林根际的菌根菌资源进行调查,结果发现摩西球囊霉、根内球囊霉和光壁无梗囊霉属于优势种,缩球囊霉和幼套球囊霉属于常见种。本文对其中优势种摩西球囊霉的扩繁条件进行筛选,探讨了宿主植物、培养基质、栽培密度和营养液浓度四种因素对摩西球囊霉生长发育的影响,旨在为研制出适用于南方杉木林的生物肥料提供支持和依据。
1 材料与方法
1.1 实验材料
实验菌种:采用杉木优势内生菌根菌——摩西球囊霉(Glomus mosseae),中南林业科技大学实验室提供。
供试植株:高粱、三叶草、玉米和葱种子均从市场上购买。
培养基质:沙蛭石混合物(1号),其沙和蛭石体积比为3∶1;沙土混合物(2号),其沙和土体积比为3∶1;沙蛭石土混合物(3号),其沙、蛭石和土体积比为2∶1∶1;沙土混合物(4号),其沙和土体积比为1∶1。其中河沙采中南林业科技大学校园建筑用河沙,土为黄壤土(均用5 mm筛过筛)。
1.2 实验方法
1.2.1 宿主植物的筛选
将4号培养基质在100℃条件下间歇灭菌2次。用高锰酸钾对容积为5 L塑料盆进行消毒。种子用10%(体积分数)的H2O2消毒,28℃催芽,70%种子露白即播种。播种时,每盆分别先装2 kg基质,后铺30 g菌剂,再覆0.5 kg基质。每种宿主植物设3次重复,共12盆。出苗后1周定苗,每盆玉米、高粱15株,葱、和三叶草均为20株,试验期间根据需要浇水及Hoagland’s营养液,三个月后收获,取样用于相关指标测定。
1.2.2 培养基质的筛选
将1、2和3号培养基质在100℃间歇灭菌两次。将上一步实验筛选出的最适宿主植物消毒后,播种方法同上,每种培养基质设3次重复,共9盆。出苗1周后定苗。试验期间根据需要浇水及Hoagland’s营养液,三个月后收获,取样用于相关指标测定。
1.2.3 栽培密度的筛选
以筛选出来的最适宿主植物及培养基质接种,设10株/盆、20株/盆、40株/盆和60株/盆的四种处理,每个处理重复3次,共12盆。播种方法同上,出苗1周后定苗。试验期间根据需要浇水及Hoagland’s营养液。三个月后收获,取样用于相关指标测定。
1.2.4 营养液浓度的筛选
对摩西球囊霉筛选出以上最适培养条件后,按同样的方法消毒播种,出苗1周后定苗。分 别 设 浓 度 为10%、20%、30%、50%、100%Hoagland’s营养液5种处理,每个处理重复3次,共15盆。从出苗起每周用不同处理的营养液灌施一次,每次每盆100 mL,第8周起每次每盆200 mL,至12周停止灌施。试验期间根据需要浇水。三个月后收获,取样用于相关指标测定。
1.2.5 实验数据测定
根据Phillips & Hayman方法[7]测定AM真菌不同结构(菌丝、泡囊、丛枝)的侵染率及菌根侵染率,计算公式为:侵染率=(AM真菌侵染根段数/检查总根段数)×100%,菌根长度=根长×侵染率。
基质风干后采用湿筛倾注法测定 AM真菌孢子数[8]。本实验中孢子密度为每mL干土中所含的AM真菌孢子数量。采用称重法测量植物地上部分与地下部分干重。
1.2.6 数据处理
使用SPSS 17.0软件进行数据分析,采用Duncan’s法对均值检测其差异显著性(P=0.05)。
2 结果与分析
2.1 不同宿主植物对摩西球囊霉生长的影响
摩西球囊霉与供试的4种宿主植物都能正常共生。由表1可知,与高粱共生培养后,其孢子密度达到84个·mL-1,菌丝含量达到75.7%,侵染率高达86.9%,与其他三种宿主植物相比具有显著性差异。这表明:高粱对摩西球囊霉的扩繁较为有利。
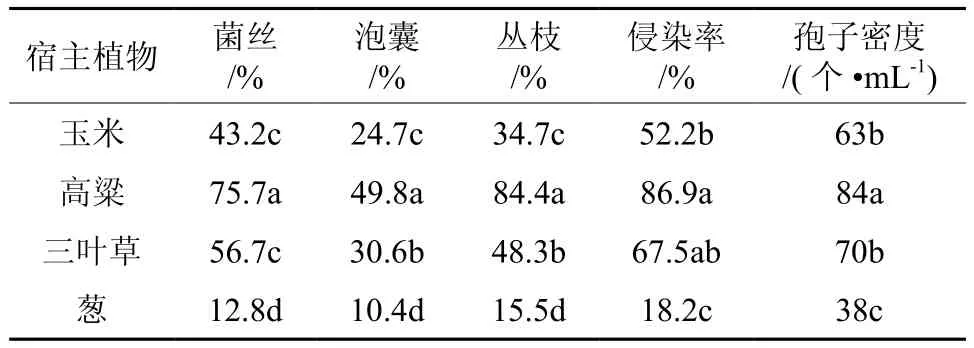
表 1 不同宿主植物对摩西球囊霉生长发育的影响Table 1 Effects of different host plants on growth of Glomus mosseae
2.2 不同培养基对摩西球囊霉生长的影响
3种培养基质的养分都较贫乏,但也存在一定的差异,主要差异表现在有机质、速效磷和速效钾上(表2)。

表2 基质的基本理化性状Table 2 Chemical and physical properties of different substrates
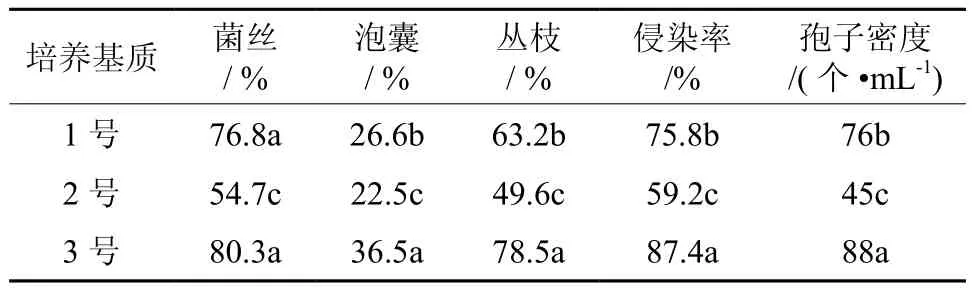
表3 不同培养基质对摩西球囊霉生长发育的影响Table 3 Effects of different culture substrates on growth of Glomus mosseae
由表3可以看出,摩西球囊霉的菌丝含量、侵染率和孢子密度明显受到了培养基质的影响。3号培养基质处理的菌丝含量、侵染率和孢子密度均达到了最大值,分别为80.3%、87.4%和88个·mL-1。不同培养基质对于摩西球囊霉处理下的宿主高粱的生长状况也表现出一定的差异(表4)。摩西球囊霉与3号基质组合处理下高粱的地上部、地下部干重和菌根长度均显著高于其他处理,分别为 16.19 g·盆-1、2.03 g·盆-1和 98.25 cm·盆-1。由于地上部及地下部生物量不一致,根冠比发生变化,而3号基质处理的高粱的根冠比最小,说明3号基质最有利于高粱的生长。3号处理的菌根长度显著高于其他处理,1号最低。
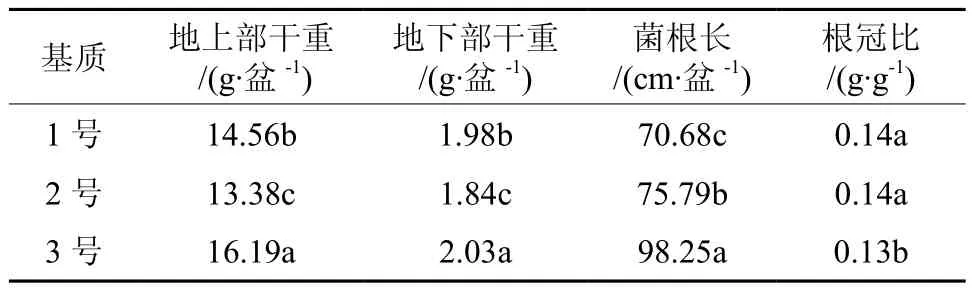
表4 不同基质处理对宿主高粱生物量的影响Table 4 Effects of different culture substrates on biomass of sorghum
2.3 不同栽培密度对摩西球囊霉生长的影响
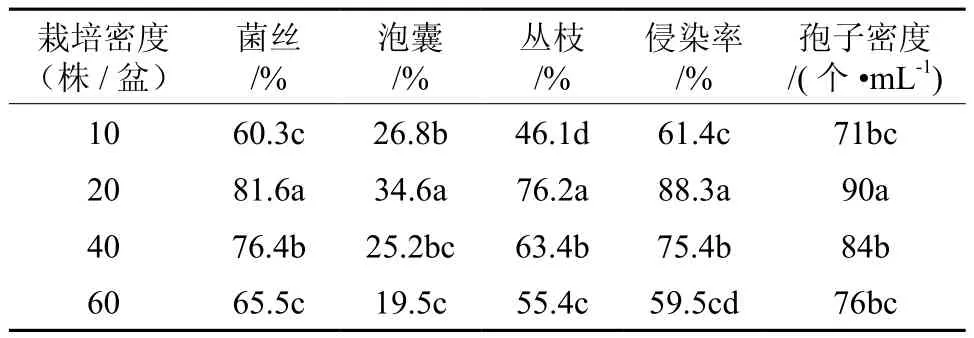
表5 不同栽培密度对摩西球囊霉生长发育的影响Table 5 Effects of different planting density on growth ofGlomus mosseae
由表5可知,栽培密度能够调节菌丝含量、侵染率和孢子密度。当栽培密度为20株/5L盆时,其菌丝含量81.6%、菌根的侵染率为88.3%和孢子密度为90个·mL-1,显著高于其他处理组。结果还表明:菌丝含量、侵染率和孢子密度在一定范围内随着栽培密度的增加而增大,超过一定范围,随着栽培密度的增加,菌丝含量、侵染率和孢子密度反而减小。因此,栽培密度可以作为调节手段来控制侵染根段、菌丝及孢子等繁殖体数量的目的。
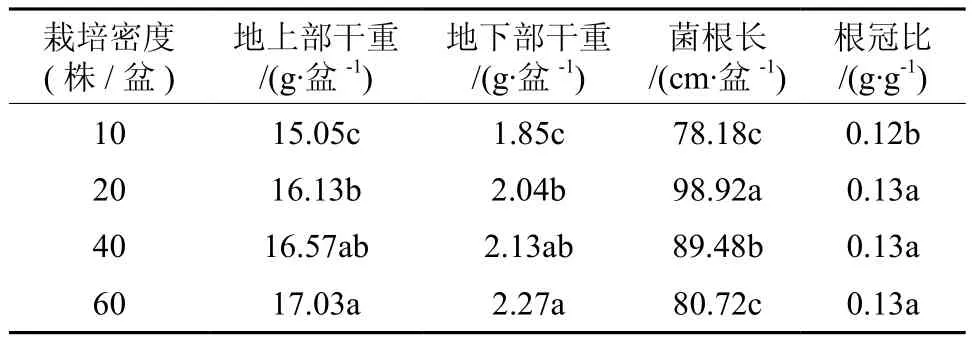
表6 不同栽培密度对宿主高粱生物量的影响Table 6 Effects of different planting density on biomass of sorghum
由表6可知:高粱地上部干重和地下部分干重与栽培密度成正比的关系。研究表明,植物中同化产物的分配情况和植物的生长状况可以通过根冠比反映出来,一般情况下根冠比越大,植物生长受到抑制的程度越强。高粱根冠比随栽培密度的增加而增大,当栽培密度为60株/5L盆时,根冠比达到了最大值。这表明:随栽培密度不断增加,物质更多地向根中分配,植物受抑制的程度越明显。
菌根长度测定结果表明:不同栽培密度的高粱菌根长度存在一定差异,当栽培密度为20株/5L盆时,菌根最长,达到了98.92 cm·盆-1。同时还表明:菌根长度起初随栽培密度的增加而增大,当到达一定栽培密度之后,又随之增大而减少。
2.4 不同营养液浓度对摩西球囊霉生长的影响

表7 不同营养液浓度对摩西球囊霉生长发育的影响Table 7 Effects of different nutrient solution concentration treatments on growth of Glomus mosseae
根据表7,不同浓度的营养液能明显影响菌丝含量、泡囊含量、丛枝含量、菌根侵染率和孢子密度,这些指标均表现出了基本一致的规律,即低浓度时随营养液浓度的增加而增加,达到一定水平后又随着营养液浓度的增加开始下降。在本试验条件下,追施30%营养液的处理组中,其相关指标均为最高。这说明菌根共生体中真菌的生长状况和繁殖体数量是可以通过人工调控的方法来控制的。
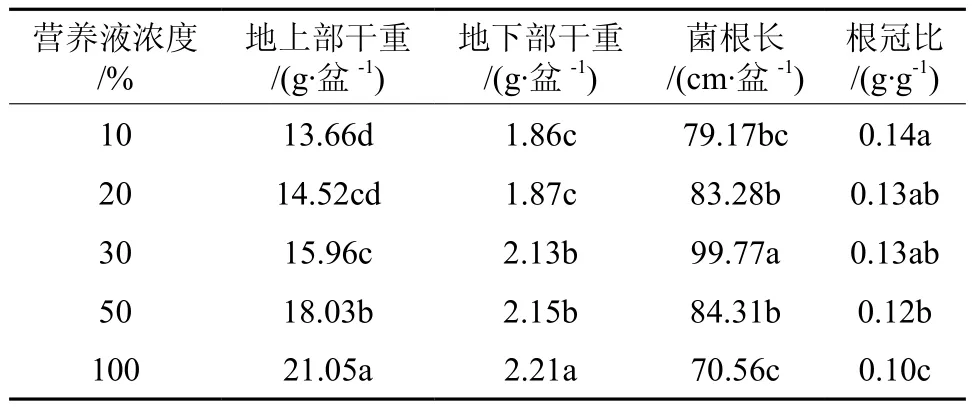
表8 不同营养液浓度对宿主高粱生物量的影响Table 8 Effects of fertilized with different strength nutrient solutions on biomass of sorghum
由表8结果表明:不同的营养液浓度一定程度上影响了高粱各部分生物量,随着浓度的增大,地上部和地下部干重也随之增大,在浓度由30%增加到100%,地上部和地下部急速增加。高粱根冠比则表现出与营养液浓度呈反比的关系,根冠比最小的是100%浓度营养液处理组。实验结果表明:在养分胁迫的条件下,高粱的生长状况随着施用营养液强度的增加而逐步得到改善,其生长受抑制的程度也相应地逐步得到缓解。
菌根长度测定结果表明:追施浓度为30%营养液菌根长度最长,追施100%的浓度菌根长度最短。这表明,根系的生长发育受到宿主植物的营养状况的影响。因此,通过调节营养液的强度,可以调控宿主植物根系的生长。
3 讨论与结论
AM真菌生长发育受宿主植物、栽培基质、营养等诸多因素的影响[9-11],而且对宿主植物也有选择性。本实验采用的摩西球囊霉能与较多的宿主植物共生,可以看出它与供试的4种宿主植物的共同状况有所不同。高粱处理组中,菌丝含量、侵染率和孢子密度等指标都最高。由此看出,该共生体对AM真菌生长比较有利。
土壤有机质含量能影响丛枝菌根真菌的生长发育,丛枝菌根真菌的数量在一定范围内随有机质含量的升高而增多,超过这一范围,丛枝菌根真菌的数量反而减少[12]。采用的3种培养基质都属于贫养分基质,相比之下,3号基质养分较高。有研究表明,菌根侵染率明显受到土壤磷水平的影响,进而影响菌丝和孢子的数量。在一定范围内,增加磷元素的供给能促进菌根真菌的生长发育,但超过一定值,反而会抑制其生长发育。氮元素也能影响菌根真菌的生长发育,其规律与磷相一致[13],但没有磷营养关系密切。在3号培养基下的宿主植物的侵染率、生物量等指标与其它两种培养基有显著差异。说明本试验中所用基质的有机质、氮元素和磷元素等养分含量在促进丛枝菌根真菌生长发育的范围之内,因此在选定基质基础上,适当增加基质中的养分,促进宿主植物的生长,进而促进菌根真菌的生长发育。综合考虑侵染根段、菌丝和孢子,沙蛭石土混合物(体积比为2∶1∶1)是以高粱作为宿主植物扩繁摩西球囊霉的最佳培养基。
栽培密度显著影响了高粱的生长。在栽培密度迅速增加时,高粱干重基本维持不变,这表明高粱长势逐渐变瘦弱了。但在一定范围内仍可以满足真菌生长发育的需要。菌丝含量、侵染率和孢子密度在一定范围随着密度增大而逐渐增大。其原因可能是:一方面菌根共生体中,真菌完全从宿主植物获取碳源,其利用量占植物固定量的1~5%[12]。适当增加栽培密度,提高了植物群体光合势,同化产物更多地向根部供应,促进了AM真菌的生长。另一方面适当增加栽培密度,植物需要更多的养分,因此需要大量的根外菌丝来帮助宿主植物吸收根系本身在空间位置上吸收不到的养分,这为菌根真菌发挥其养分吸收功能提供了良好机会。实验说明:密度可以作为一种调节手段来获得最大数量的侵染根段、菌丝及孢子等繁殖体,而使植物的生长维持在较低水平,真菌生长处于较高水平。本实验中,栽培密度为20株/5 L盆时,摩西球囊霉生长发育最好。
当培养基里养分含量很低且施用低浓度的营养液时(10%、20% Hoagland’s营养液),一方面因为基质中养分含量很少,菌根真菌吸收不到充足的养分,抑制了菌根的侵染及根外菌丝的生长发育,另一方面抑制了宿主植物的生长发育,因而提供给菌根真菌其生长发育所需的碳水化合物就会很少,抑制了共生体的建立和发展;随着营养液强度的不断增强(30%Hoagland’s营养液),可利用的养分逐渐增多,共生关系得到进一步发展,共生体双方生长状况都日趋改善,植物的生长状况和真菌的生长发育都较好;但当施加营养液的强度达到一定程度时,基质中营养能充分满足植物生长的需要,植物也变得十分健壮,不再需要菌根真菌提供养分,并在与真菌的竞争中处于优势地位,抑制了菌根真菌的生长发育。因此,宿主植物—菌根真菌之间共生关系是建立在养分的条件上,互惠共生关系的建立和发展与基质中养分有着密切的关系。在本实验中,向基质中追施30%强度Hoagland’s 营养对菌根真菌的生长发育最有利。因此,在养分贫乏的基质中进行菌剂培养时,必须追施适当的营养液。追施中等强度营养液(30%),最能促进真菌的生长发育。此时,宿主植物的生长虽然在一定程度上受到抑制,但其制造的碳水化合物完全能满足菌根真菌生长发育的需要。
本实验主要对摩西球囊霉的扩繁的宿主植株、培养基质、栽培密度和营养液浓度四种条件进行了研究,确定了最佳的扩繁条件:宿主植物为高粱,培养基质为3号培养基质处理,即沙∶蛭石∶土的比例为2∶1∶1(体积比),栽培密度为20株/5 L盆,营养条件为追施用浓度为30%的Hoagland’s营养液。
[1] Maria J. Harrison. The arbuscular mycorrhizal symbiosis: an underground association[J]. Trend in plant science, 1997, 2(2):54-60.
[2] 杜永吉,孙鑫博,韩烈保. 内生真菌感染对高羊茅光合和形态特性的影响[J]. 中南林业科技大学学报,2010,31(1):41-47.
[3] 邓小军,周国英,刘君昂,等. 湖南油茶林丛枝菌根真菌多样性及其群落结构特征[J]. 中南林业科技大学学报,2011,31(10): 38-42.
[4] 赵 昕.丛枝菌根真菌对喜树幼苗的接种效应[D].哈尔滨:东北林业大学, 2006.1-6.
[5] 李冬霞,张 猛,李 贺,等. 枣树越冬期内生真菌的分离鉴定及抑菌研究[J]. 经济林研究,2010,28(1):86-89.
[6] Li Lin, Zhou Guo-ying, Liu Jun-ang,et al.The resource investigation and community structure characteristics of mycorrhizal fungi associated with Chinese fi r[J]. African Journal of Biotechnology, 2011,10(30):5719-5724.
[7] Phillips J M,Hayman D S. Improved procedures for clearing and staining parasitic and vesicular-arbuscular mycorrhizal fungi for rapid assessment of infection[J]. Trans Br Mycol Soc, 1970,55: 158-161
[8] Gerdemann J W, Nicolson T H. Spores of mycorrhizal endogone species extracted from soil by wet sieving and decanting[J].Trans Br Mycol Soc, 1963,46:235-244
[9] 陈 宁,王幼珊,李晓林,等.宿主植物栽培密度对AM真菌生长发育的影响[J].菌物系统,2003,22(1): 88-94.
[10] Gaur A, Adholeya A. Effects of the particle size of soilless substrates upon AM fungus inoculum production[J]. Mycorrhiza,2000, 10: 43-48.
[11] 陈 宁,王幼珊,李晓林,等.营养液强度对AM真菌生长发育的影响[J].菌物系统,2003,22 (22): 394-401.
[12] 李晓林,冯 固.丛枝菌根生态生理[M].北京:华文出版社,2001: 1-358.
[13] 陈 宁,王幼珊,杨延杰,等. 不同氮磷比例营养液对AM真菌生长发育的影响[J]. 植物营养与肥料学报,2007,13(1):143-147.
Effects of different culture conditions on growth of Glomus mosseae
ZHOU Guo-ying1, XU Hai-zhou1, YAN Jun1, ZHANG Lei1, WU Nan2, YAN Rui-kun2
(1. Key Lab. for Economic Forest Cultivation and Conservation of Chin Education Ministry, Central South University of Forestry and Technology, Changsha 410004, Hunan, China; 2. Forestry Bureau of Akesu, Akesu 843002, Xinjiang, China)
In order to obtain lots of inocula of endomycorrhiza from Chinese fir, the culture conditions of the fungi including host plants, culture substrate, planting density and nutrient solution concentration were studied. The results show that the best host plant was sorghum, the optimum culture medium was the culture medium No.3 (volume ratio was sand∶vermiculite∶soil =2∶1∶1), the optimum planting density was 20 plants / 5 L pot and the optimal nutrition condition was Hoagland’s solution with 30% concentration by means of topdressing concentration.
Glomus mosseae; arbuscular mycorrhizal fungi; propagation; growing development
S718.8
A
1673-923X(2014)10-0010-04
2013-10-24
国家林业公益性行业科研专项(201004014);湖南省大学生创新项目(601000232)
周国英(1966-),女,湖北应城人,教授,博士,主要从内生菌根菌繁殖技术研究;E-mail:gyzhou2118@163.com
[本文编校:吴 彬]
