Fe3O4@ZIF-8的制备及其在磁固相微萃取中的应用
2014-12-28
(济宁职业技术学院,山东济宁272037)
多环芳烃(polycyclic aromatic hydrocarbons,PAHs)是由煤、石油、木材、烟草、有机高分子化合物等不完全燃烧所产生,是环境和食品的主要污染物。迄今已发现的200多种多环芳烃中,多种具有致癌性。环境中多环芳烃浓度较低,常以痕量存在,需要经过复杂富集程序,给分析检测工作带来较大困难。
有报道称将涂有金属有机骨架化合物(metal-organic frameworks,MOFs)材料的固相微萃取装置与涂有MOFs材料的气相色谱柱联用,可实现对复杂样品的高选择性净化、高效分离和特异性检测[1],广泛用于储氢、吸附CO2及甲烷、催化、药物释放、发光材料等方面的研究[2-4],但大部分的MOFs材料水稳定性较差[5-6],限制了其对水样中多环芳烃的富集。沸石-咪唑框架结构材料(zeolitic imidazolate frameworks,ZIFs)是一类新型的MOFs材料,具有无机沸石的高稳定性及MOFs的高孔隙率和有机功能,有望解决水样中多环芳烃难富集问题[7]。沸石-甲基咪唑锌(ZIF-8)具有高度的水稳定性、高疏水性、大曲面面积、开放的金属位点、化学稳定性、高孔容等特点。
作者在此制备了Fe3O4@ZIF-8磁纳米复合材料,并以其作为吸附剂,建立快速高效的磁固相微萃取方法,实现了对环境水样中痕量多环芳烃的快速灵敏测定。
1 实验
1.1 材料、试剂与仪器
环境水样,采集于曲阜市护城河,经0.2μm 滤膜过滤,备用。
三氯化铁、结晶醋酸钠、乙二醇、巯基乙酸、2-甲基咪唑、硝酸锌、甲醇、萘、蒽、咔唑、芴、联苯等均为分析纯;去离子水。
P230型液相色谱仪;SHZ-82型气浴恒温振荡器;101型电热鼓风干燥箱;科生牌超声波清洗机;DHT型磁力加热搅拌电热套;恒温不锈钢水浴锅;真空干燥箱;电子天平。
1.2 方法
1.2.1 Fe3O4纳米球的制备
将1.73g(6.40mmol)FeCl3·6H2O 溶于35mL乙二醇中,加入3.83g CH3COONa·3H2O,继续搅拌30min后,转移到有聚四氟乙烯内衬的100mL 不锈钢高压釜中,调温至200 ℃,反应8h,冷却至室温,加磁铁分离沉淀物,Fe3O4纳米球用蒸馏水和无水乙醇洗涤,于60 ℃真空干燥12h。
1.2.2 Fe3O4纳米球的羧基功能化
称取0.05g(0.22 mmol)Fe3O4纳米球加入10 mL巯基乙酸的乙醇溶液(0.29mmol·L-1)中,室温振荡24h,改性结束后,用外加磁铁回收,分别用蒸馏水(10mL)和无水乙醇(10mL)各洗涤3次,得巯基乙酸改性的Fe3O4纳米球,分散于无水乙醇中,保存备用。
1.2.3 Fe3O4@ZIF-8微球的制备
将16.6mg(0.202mmol)2-甲基咪唑和6.0mg(0.02 mmol)Zn(NO3)2·6H2O 溶于0.8 mL 甲醇中。将3mg巯基乙酸改性的Fe3O4纳米球加入上述溶液中,于70 ℃水浴反应10 min,冷却至室温,用外加磁铁分离收集,用大量甲醇洗涤。重复上述操作3次后,于60 ℃真空干燥10h。
1.2.4 萃取条件的优化
采用P230型液相色谱仪,依据单一变量原则分别从微球用量、萃取时间、解吸溶剂种类、解吸溶剂用量、解吸时间等方面对磁固相微萃取的效果进行优化,建立记录表格及效率走势图,确定最佳萃取条件。
1.2.5 HPLC-UV 方法的建立与评估
1.2.5.1 方法建立
以待测原溶液为分析物建立HPLC-UV方法,以峰面积为响应信号,作为萃取条件优化实验的测量指标进行环境水样中多环芳烃的定量分析,并进行方法评估。
色谱条件:SinoChrom ODS-BP 型色谱柱(4.6 mm×200mm,5μm),流动相为80%甲醇-水溶液,流速1.000mL·min-1,进样量20μL,柱温25 ℃,检测波长254nm。每次进样前用流动相平衡色谱柱10 min。
1.2.5.2 方法评估
1)线性回归方程及相关系数
取待测溶液,按照色谱条件测定峰面积,以峰面积(y)为纵坐标、待测溶液浓度(x)为横坐标绘制标准曲线,得各多环芳烃的线性回归方程及相关系数。
2)回收率
取10mL待测溶液3 份,在最优萃取条件下,各加入10mg微球,萃取15min,用外加磁铁分离,再用1mL甲醇作为解吸溶剂,解吸15min,取20μL 解析溶液,注入液相色谱仪,根据5种多环芳烃的峰面积,由线性回归方程确定其浓度,按下式计算回收率:

式中:csed为解吸溶液中分析物浓度,由线性回归方程计算而得;c0为最初的水相分析物浓度;Vsed为解吸溶液的体积;Vaq为水样本体积。
1.2.6 环境水样的检测
将环境水样用磁固相微萃取方法进行富集,采用HPLC-UV 方法检测,对水样中多环芳烃的富集情况进行分析。
2 结果与讨论
2.1 萃取条件的优化
2.1.1 微球用量
取10mL待测溶液5份,分别加入3mg、5mg、10 mg、15mg、20mg的微球,萃取15min,再用1mL 甲醇洗涤微球,解吸15min,通过外加磁铁分离沉淀,采用1.2.5.1方法进样分析,确定最佳微球用量,结果见图1。
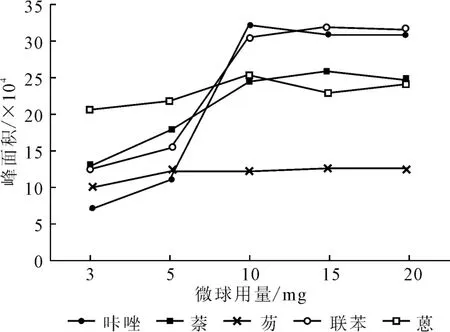
图1 微球用量对萃取效果的影响Fig.1 Effect of the dosage of microspheres on extraction efficiency
从图1可以看出,随着微球用量的增加,峰面积逐渐增大,当微球用量增加到10 mg后,峰面积开始趋于稳定。因此,确定微球用量为10mg。
2.1.2 萃取时间
取10mL待测溶液5份,各加入10 mg微球,分别萃取5min、10min、15min、20min、25min,然后用1mL甲醇洗涤微球,解吸10min,通过外加磁铁分离沉淀,采用1.2.5.1方法进样分析,确定最佳萃取时间,结果见图2。
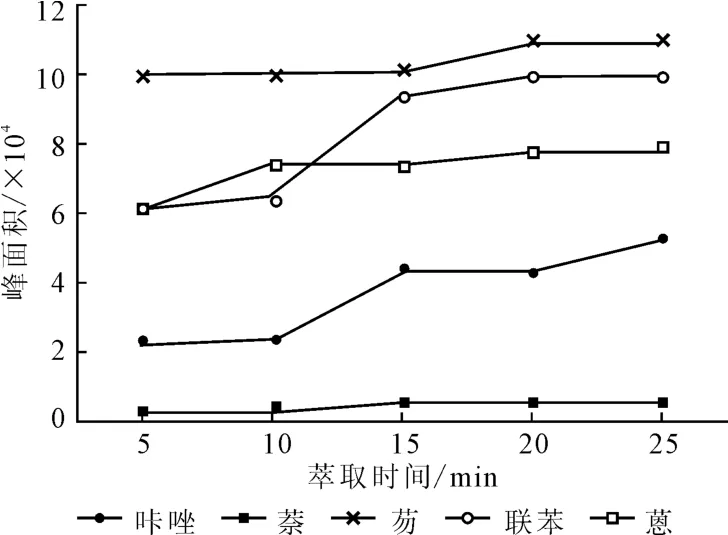
图2 萃取时间对萃取效果的影响Fig.2 Effect of extraction time on extraction efficiency
从图2可以看出,随着萃取时间的延长,峰面积逐渐增大,萃取15min后峰面积趋于稳定。因此,确定萃取时间为15~20min。
2.1.3 解吸溶剂种类
取10mL待测溶液4份,各加入10 mg微球,萃取10min,分别用1mL等浓度的乙腈、甲苯、正己烷、甲醇作解吸溶剂,洗涤微球,解吸10min,通过外加磁铁分离沉淀物,采用1.2.5.1方法进行分析,确定最佳解吸溶剂,结果见图3。

图3 解吸溶剂种类对萃取效果的影响Fig.3 Effect of the type of desorption solvent on extraction efficiency
从图3可以看出,以甲醇作为解吸溶剂时的峰面积较大。因此,确定甲醇为解吸溶剂。
2.1.4 解吸溶剂用量
取10mL待测溶液5份,各加入10 mg微球,萃取15 min 后,各加入0.3 mL、0.5 mL、0.8 mL、1.0 mL、1.5mL甲醇作为解吸溶剂,洗涤微球15min,通过外加磁铁分离沉淀;而后向解吸溶液中分别加入1.2mL、1.0mL、0.7mL、0.5mL、0mL甲醇,使它们体积相同,采用1.2.5.1方法进样分析,确定最佳解吸溶剂用量,结果见图4。

图4 解吸溶剂用量对萃取效果的影响Fig.4 Effect of the dosage of desorption solvent on extraction efficiency
从图4可以看出,当解吸溶剂用量从0.3 mL 增加到0.5 mL 时,只有咔唑和萘的峰面积变化比较明显;继续增大用量时,5种多环芳烃的峰面积变化均不大。因此,确定解吸溶剂用量为0.5mL。
2.1.5 解吸时间
取10mL待测溶液5份,各加入10 mg微球,萃取15min,用1mL甲醇洗涤微球,分别解吸5min、10 min、15min、20min、25min,通过外加磁铁分离沉淀,采用1.2.5.1方法进样分析,确定最佳解吸时间,结果见图5。
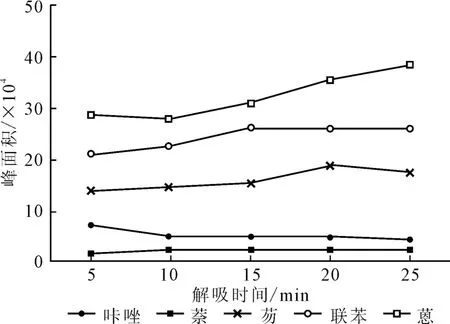
图5 解吸时间对萃取效果的影响Fig.5 Effect of desorption time on extraction efficiency
从图5可以看出,随着解吸时间的延长,咔唑峰面积逐渐减小,联苯、芴峰面积先增大后减小,萘、蒽峰面积增幅不大,但存在增大的趋势。因此,确定解吸时间为15~20min。
2.2 方法评估
HPLC-UV 方法的线性回归方程及相关系数见表1。

表1 HPLC-UV方法的线性回归方程及相关系数Tab.1 Linear regression equations and correlation coefficients of HPLC-UV method
从表1可以看出,相关系数R均接近1,说明5种多环芳烃在实验范围内均有良好的线性响应。
在确定的最优萃取条件下,测定咔唑、萘、芴、联苯、蒽5种多环芳烃的回收率在57%~97%之间。
2.3 环境水样的检测结果(图6)
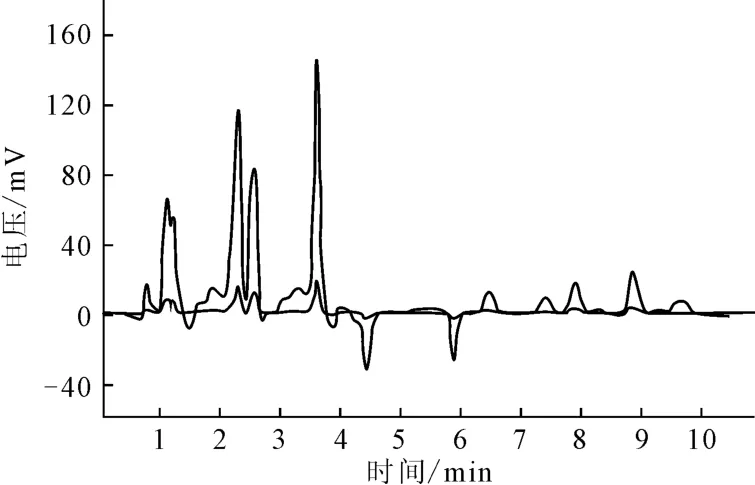
图6 对环境水样中痕量多环芳烃的富集图谱Fig.6 Enrichment spectrum of the traces of PAHs in environmental water samples
从图6可以看出,Fe3O4@ZIF-8微球对水样中的多环芳烃有较好的吸附富集作用。
3 结论
首次将ZIF-8 用于磁固相微萃取领域,制备了Fe3O4@ZIF-8磁纳米复合材料,以其作为吸附剂建立了快速高效的磁固相微萃取方法,得到了最佳的萃取工艺为:每10mL待测溶液加入10mg Fe3O4@ZIF-8微球,萃取15min,用0.5mL 甲醇作解吸溶剂,解吸15min,在该萃取工艺条件下的萃取效果最好。该方法操作简单易行,有机溶剂消耗少,萃取效率高。对环境水样进行了富集分析,效果比较理想。
[1]HORCAJADA P,CHALATI T,SERRE C,et al.Porous metal-organic-framework nanoscale carriers as a potential platform for drug delivery and imaging[J].Nat Mater,2010,9(2):172-178.
[2]WANG C,XIE Z,de KRAFFT K E,et al.Doping metal-organic frameworks for water oxidation,carbon dioxide reduction,and organic photocatalysis[J].J Am Chem Soc,2011,133(34):13445-13454.
[3]BAUER C A,TIMOFEEVA T V,SETTERSTEN T B,et al.Influence of connectivity and porosity on ligand-based luminescence in zinc metal-organic frameworks[J].J Am Chem Soc,2007,129(22):7136-7144.
[4]HORCAJADA P,SERRE C,MAURIN G,et al.Flexible porous metal-organic frameworks for a controlled drug delivery[J].J Am Chem Soc,2008,130(21):6774-6780.
[5]YU L Q,YAN X P.Covalent bonding of zeolitic imidazolate framework-90to functionalized silica fibers for solid-phase microextraction[J].Chem Commun,2013,49(21):2142-2144.
[6]BELARDI R P,PAWLISZYN J B.The application of chemically modified fused silica fibers in the extraction of organics from water matrix samples and their rapid transfer to capillary columns[J].Water Pollution Research Journal of Canada,1989,24(1):179-191.
[7]PARK K S,NI Z,COTE A P,et al.Exceptional chemical and thermal stability of zeolitic imidazolate frameworks[J].PNAS,2006,103(27):10186-10191.
