BHK21细胞的悬浮驯化及其悬浮培养参数研究
2014-12-27尚勇良武发菊安芳兰万玉林刘学荣杨进才
田 波,尚勇良,武发菊,安芳兰,万玉林,刘学荣*,杨进才
(1.甘肃农业大学,甘肃兰州730000;2.中农威特生物科技股份有限公司,甘肃兰州730046)
随着兽用生物制品产业的发展,近年来动物细胞培养成为国内外研究的热点。BHK21细胞作为WHO推荐的生产兽用疫苗细胞,现已在规模化生产中用悬浮培养的模式在应用。目前人们为适应特定工业化的需要,通过改变细胞的生长方式和生活环境,对工程细胞进行贴壁―悬浮的驯化。贴壁培养细胞经过悬浮驯化可以转变为悬浮生长株[1-2],或添加抗剪切保护剂进行规模化悬浮培养。悬浮驯化过程中细胞易粘附聚集及结团是目前贴壁细胞进行悬浮培养常见的问题[3-4]。由于动物细胞在悬浮培养条件下对生长环境、培养基的要求十分严格,优化BHK21细胞的悬浮培养条件,使之达到最佳生长状态,从而为体外规模化细胞培养平台奠定理论基础。
1 材料与方法
1.1 主要试剂与材料 中农威特生物科技服务有限公司研发部保存的BHK-21细胞,购自ECACC,货号:84111301,来源:Hamster Syrian Kidney,产品编号:05K029,代次:10代。培养基为自制的MEM+7%的胎牛血清,使用前按照产品说明书配制。新生牛血清购自兰州荣晔生物技术有限责任公司。胰酶购自HyClone公司。碳酸氢钠、氢氧化钠、盐酸等常用试剂为国产分析纯。
1.2 主要仪器 细胞计数仪,德国INNOVATIS公司;渗透压测定仪,上海医科大学仪器;T25、T75培养瓶,1 000 ml三角培养瓶购自Nunc公司;5 L生物反应器,BELLCO生物反应器,7.5 L生物反应器,美国NBS公司。
1.3 方法
1.3.1 BHK-21细胞的悬浮驯化。取BHK21贴壁细胞种子,在T75培养瓶中加入新鲜培养基进行复苏培养,接种比例为1∶3,待细胞长满单层并生长良好时,胰酶消化,用移液管轻轻吹打成单细胞悬浮液,以0.75×106个/ml密度接种至1 000 ml三角培养瓶中,在37℃、100 r/min下先搅拌培养。并依此法连续传代,直至40代,培养过程中对每代细胞取样计数并观察细胞形态。
1.3.2 血清含量对悬浮培养细胞的影响。在其他培养条件一致的条件下,将已驯化的悬浮细胞种子传代扩大培养,并以0.5×106个/ml的细胞密度接种至5 L生物反应器培养。培养过程中将GMEM培养基中的血清含量分别调整为1%、2%、5%、8%、15%和20%6个浓度进行培养,培养过程中对每代细胞取样计数并观察细胞形态。
1.3.3 培养液pH对悬浮培养细胞的影响。在其他培养条件一致的条件下,将GMEM培养液的pH分别设置为6.8~7.0、7.0 ~7.2、7.3 ~7.5 和 7.6 ~7.8,37 ℃ 培养 48 h 后,取样计数并观察细胞形态。
1.3.4 溶解氧对悬浮培养细胞的影响。培养条件同“1.3.3”,以不同转速及通气方式进行悬浮培养,第1种:80 r/min,1孔通气;第 2种:80 r/min,2孔通气;第 3种:120 r/min,2孔通气。均在37℃培养48 h后,取样计数并观察细胞形态。
1.3.5 全自动冰点渗透压计测定渗透压。①开机,待显示温度降至-9℃按“↑”键使测量探头升起;②轻轻冲洗探头,并加入0.5 mI样品于样品管中,套紧于测量探头上,按“↑”测量开始;③约5 min测量探头升起,得出测量结果;④记录结果,取下样品管,并按“↑”键使探头回落,最后关机。
1.3.6 细胞培养形态观察及细胞数目和活力的测定。将取出的细胞悬浮液直接滴在载玻片上在显微镜下观察;用细胞分析仪计数细胞,分析细胞活力。
2 结果与分析
2.1 BHK21细胞悬浮驯化培养过程中细胞结团的研究
2.1.1 BHK21细胞悬浮驯化培养过程中细胞形态变化的比较。BHK21细胞在GMEM培养基中生长形态的变化图1。在培养初期(图1a、1b),大多数细胞散在分布,单个细胞透亮,边缘光滑,部分细胞呈花生状分布;随着培养时间的延长,细胞逐渐相互粘附,2~3个细胞或更多聚集在一起(图1c、1d),细胞结团越为明显,更多的细胞粘连,团块变大,但很松散,轻轻吹打细胞,结团即消失,此时结团的细胞在镜下观察仍很透亮,活性好;由于细胞结团给物质的传递带来极为不利的影响,在细胞培养11 d后(图1e),细胞边缘不光滑,细胞体积增大,细胞结团越来越致密,团块内细胞已无明显轮廓界限,不能吹散;在培养后期(图1f),大量细胞开始死亡,结团逐渐消失。

图1 BHK21细胞悬浮驯化培养过程中细胞形态的变化
2.1.2 BHK21细胞驯化培养过程中细胞结团对生长状态的影响。由表1可知,随着培养时间的变化,细胞结团平均粒径、细胞的生长活性和平均比生长速率受到一定的影响。在培养初期,细胞结团的平均粒径较小,在12.81~15.78μm,细胞活性最高,从比生长速率反映出细胞生长速度较快,细胞生长代谢旺盛;在培养至第8天,随着细胞结团数量的增多,结团平均粒径增加,细胞继续保持指数生长期,平均比生长速率达到了最大值2.93,细胞活性在94%左右,此时结团的细胞在镜下观察更加透亮,活性更高;当培养至第11天,结团平均粒径不再增加,细胞活性逐渐下降,比生长速率降低,细胞生长速度减缓。主要是因为在BHK21细胞悬浮驯化生长过程中,细胞结团过大,给物质传递带来较大的阻力,使得团块内的细胞营养物耗竭和代谢副产物积累,细胞生长受到影响;在培养后期,细胞结团松散,细胞活性迅速下降,细胞逐渐崩解。
因此,细胞的结团严重影响了细胞的生长代谢,在细胞培养中应通过不同方法如调节Ca2+浓度,添加肝素、EDTA等物质以避免细胞结团的出现。
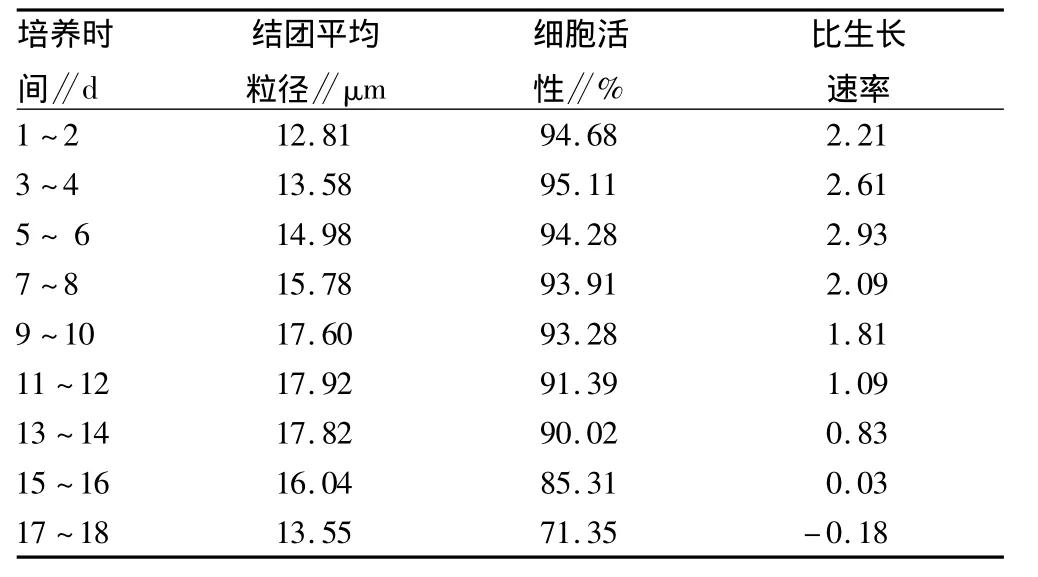
表1 BHK21细胞培养过程中结团的平均粒径与细胞生长状态的变化
2.2 接种浓度对悬浮培养细胞的影响 BHK21细胞在不同接种浓度下培养(其他培养条件相同),当接种浓度过低,即低于0.2×106个/ml时,细胞生长增值明显减缓,细胞浓度的倍增时间由24 h延长至48 h或更多;若接种浓度过高,即1.0×106个/ml时,在培养期间细胞培养液的pH下降较快,不利于BHK21细胞的生存,因而抑制了细胞的生长,细胞倍增速率降低。
2.3 血清含量对悬浮培养细胞生长的影响 BHK21细胞在不同血清浓度的培养液中生长(其他培养条件相同),含15%和20%高浓度血清的培养液可使细胞悬浮传代24 h后,培养液的pH快速下降,可低至6.5~6.8,显微镜下观察,上清液中可见较多杂质,细胞形态一般,胞内有颗粒状物质。为了避免细胞出现老化现象,应及时换液;当血清浓度较低时(1%、2%),细胞生长缓慢,细胞终密度明显低于其他组;血清浓度为5%、8%时,悬浮培养过程中细胞生长较好,与对照组相比无显著差异。因此,综合细胞及生产成本考虑,牛血清的最佳含量为5%。
2.4 培养液p H对悬浮培养细胞的影响 当pH7.0~7.2时,培养液的pH下降较快,细胞生长快,细胞密度比同期其他试验组高,细胞活性也较好。当BHK21细胞培养液pH在7.4或6.8时,培养48 h后细胞生长缓慢,细胞密度显著低于其他试验组。所以BHK21细胞培养液理想的pH为7.0~7.2。
2.5 溶解氧对悬浮培养细胞的影响 该试验中所用的5 L生物反应器有2个通气孔,一孔可与空气过滤器相连,另一孔不用时用螺帽封口,通气时用灭菌的外有牛皮纸包被的多层纱布扎口即可。不同方式培养细胞的结果见表2,由表2可知,在2孔通气的方式80 r/min培养,细胞团块较多,细胞贴覆在罐壁和罐底的情况较多,而采用2孔通气的100 r/min有利于BHK21细胞的生长。

表2 不同转速与通气量对细胞生长的影响
3 结论与讨论
(1)在贴壁细胞悬浮驯化培养中,细胞聚集成团是影响细胞生长的最大障碍。当细胞状态不好时,细胞团块直径可达数毫米,粘附的细胞数目达103个以上。由于细胞的成团聚集给物质传递带来的巨大阻力,使得陷于细胞团中央的细胞得不到充足的营养,细胞由于营养物质的缺乏,细胞活性和生长速率逐渐降低,细胞开始凋亡。随着细胞粘附基质的改变,凋亡发生率增加,从而引起细胞蛋白结构改变等一系列问题,使得细胞表达能力下降[5]。可见,细胞结团对细胞生长状态具有严重的影响,其影响程度的大小取决于细胞团块的疏松度和细胞结团的平均粒径大小。在该试验中,BHK21细胞培养初期,细胞的结团粒径逐渐增加,而细胞活性一直较高,细胞生长速度快;随着培养时间延长,结团平均粒径达到最大值后不再增加,且越来越致密,而细胞活性下降,细胞生长速度减慢,团块逐渐散开,最后细胞死亡。因此,在悬浮细胞培养研究中,通过调控细胞结团尺寸的大小或消除细胞结团可提高细胞活性和培养密度,能改善细胞生长状态,最终提高目标产品产量。
(2)悬浮培养驯化试验发现,当细胞接种浓度过低时,由于细胞间的相互作用及所分泌的各种细胞生长因子降低,使得细胞生长缓慢;当细胞接种浓度过高时,由于营养物质的快速消耗及代谢副产物积累较多等原因,使得细胞生长缓慢,比生长速率低于正常值。
(3)血清的质量和浓度对细胞培养有直接的影响[6]。一般透明、淡黄色,加热灭活后颜色较深,蛋白沉淀少为优良的血清。在细胞培养中,所用血清应进行无支原体和病毒污染以及无其他微生物污染的检测,及细胞生物学方面的检测。将所用的血清连续传代3次以上培养细胞,确定它是否适宜该细胞系的长期生长[7]。该试验结果表明,血清浓度越高,细胞分化速度越快,细胞生长较快,随着细胞代谢物的增多及其血清中一些抑制因子作用的加强,细胞生长减慢,同时细胞形态也受到影响。目前由于血清来源不稳定且价格昂贵、作用机制不明确及实验和生产的标准化困难等一系列原因,使得开发出经济适用的血清替代品和无血清培养基成为亟待解决的难题。
(4)大规模培养时,影响培养液pH稳定性的主要因素有:①缓冲液的缓冲能力及种类;②对流空间大小;③葡萄糖浓度。培养液中正常的缓冲系统是NaHCO3/CO2系统。它是一种弱缓冲系统,其pKa为6.1,低于生理学最佳要求。这种缓冲系统要求在培养液上面的对流空间加入CO2以防止其丢失及增加羟基离子。也有人使用磷酸缓冲液,但有资料报道磷酸对动物细胞有毒害作用。该试验未做该方面的尝试。另外HEPES生物缓冲剂也可加入NaHCO3/CO2系统,其 pKa为7.0,其缓冲能力为 pH 6.8 ~7.2。但当 HEPES 浓度高于25 mmol/L时,他对大多数动物细胞也有毒害作用。在细胞悬浮培养过程中,由于营养物质的消耗和代谢副产物积累使得培养液的pH下降较快,从而抑制了细胞的生长。通常,大多数细胞的最适生长环境pH在7.0左右,当pH下降至6.8时,会抑制细胞的生长,因此必须对PH进行调控,使培养过程中pH不能下降至6.8以下。
(5)在动物细胞大规模培养时,如何提供足够的氧非常重要[8]。同期搅拌的目的主要有:①提供细胞代谢所需的足够氧气;②使培养液处于均匀悬浮状态,有利于传质过程。对于一定的设备而言,增大搅拌速度、搅拌功率和通气量都能提高溶氧水平,但三者之间相互关联。
[1]魏明旺,张淑香.动物细胞大规模培养的主流技术[J].生物产业技术,2009,4(7):85 -89.
[2]ZHOU JX,TRESSEL T,YANG X M,et al.Implementation of Advanced Technologies in Commercial Monoclonal Antibody Production[J].Biotechnol J,2008,3:1185 -1200.
[3]RORY M.Adaptation of Chinese Hamster Ovary cells in culture:a literature survey of adhesion proteins[R].Individual Inquiry A,2002:2 -3.
[4]HUWS,AUNINSJG.Large-scalemammalian cell culture[J].Current O-pinion in Biotechnology,1997(8):148 -153.
[5]陈因良,陈志宏.细胞培养工程[M].上海:华东化工学院出版社,1992.
[6]HU WS,AUNINSJG.Large-scale mammalian cell culture[J].Curropin Biotech,1997,8:148.
[7]KALLOS M S,BHEIE L A,VESEOVI A.Extended serial Passaging of mammalina neural stem Cells in suspension bioreaetors[J].Bioteehnol Bioeng,1999,65(5):589 -599.
[8]CHU C,LUGOVTSEV V,GOLDING H,et al.Conversion of MDCK Cell Line to Suspension Culture by Transfecting with Human Gene and Its Application for Influenza Virus Production[J].Proc Natl Acad Sci USA,2009,106(35):14802 -14807.
