微卫星DNA在分析核桃遗传多样性上的应用
2014-12-27肖志娟翟梅枝王振元
肖志娟,翟梅枝,王振元,许 静,李 丽,杨 惠
(西北农林科技大学 林学院,陕西 杨凌 712100)
微卫星DNA在分析核桃遗传多样性上的应用
肖志娟,翟梅枝,王振元,许 静,李 丽,杨 惠
(西北农林科技大学 林学院,陕西 杨凌 712100)
研究不同核桃品种的遗传多样性,为今后新品种的培育和种质创新提供理论依据,以西北农林科技大学资源苗圃的18个核桃品种(包括3个实生优系)嫩叶做材料,选用SSR分子标记技术对其进行了遗传多样性研究。建立了最适PCR反应体系,从27对引物中筛选出多态性强重复性好的12对引物,共检测出174条条带,其中91条呈现多态性,多态性条带的比例平均为67.82%,平均每条引物扩增出多态性位点9.8个。新疆2号与辽宁4号的相似系数最大(0.803 6),青林和西林2号最小(0.159 4)。多态信息含量(PIC)变化范围在0.742 2~0.896 2,平均值为0.815 0,其值均大于0.500 0。基于遗传相似性系数的UPGMA聚类结果表明,在遗传相似系数阈值为0.39左右可将供试品种分成4大类。以上说明12条引物扩增的位点均表现出高度多态,同时表明供试样品遗传资源非常丰富,可作为育种来源。
核桃;SSR分子标记技术;体系优化;遗传多样性
核桃属Juglans植物约有20多种,而核桃是中国栽培范围最广的种,也是我国分布广泛,栽培历史悠久的重要经济树种, 在国际市场上与扁桃、腰果、榛子一起并列为世界四大干果[1],其种仁除含蛋白质、碳水化合物、脂肪外,还含胡萝卜素、硫胺素、核黄素、钙、磷、铁和尼克酸等多种成分[2],具有很高的药用价值、经济价值和营养价值。
核桃种质资源极为丰富,在抗性、丰产性及果实品质和形态特征等方面都存在显著差异,具有丰富的遗传多样性[3]。由于核桃品种众多,在地形、气候条件等不同生态环境条件下, 经长期的异花授粉、自然选择和人工杂交,导致其遗传背景非常复杂。核桃遗传多样性研究是核桃种质资源保护及开发利用的基础,开展核桃种质资源遗传多样性评价对研究核桃的起源、演化具有重要意义。
准确认识核桃种质资源的亲缘关系及遗传多样性,对种质资源的分类、亲本选配、后代遗传变异程度及杂种优势水平的预测提供预见性的指导,这是关系到育种目标能否成功实现的关键[4]。以往对核桃种质资源的研究多依靠形态学[5]、细胞学[6]、酶学[7]等手段。近年来,DNA 分子标记由于具有多态性高、不受组织类别、发育时期和环境条件影响的优点,越来越多地应用于核桃种质资源的研究[8]。分子标记技术具有快速、方便、直观、成本低等特点,已经越来越普遍地应用于植物种质资源的系统演化、遗传多样性、分子辅助育种等方面的研究,成为植物种质资源遗传基础研究的重要技术[9-10],在核桃种质资源研究方面的应用有不少报道[11-14]。吴燕民等[15]用RAPD标记研究了核桃属各个种之间的亲缘关系。王滑等[16]利用SSR标记揭示我国核桃和铁核桃天然居群的遗传多样性及遗传结构,为其遗传资源的保护、可持续利用和遗传改良提供科学依据。国外学者利用形态学、等位酶及RFLP标记对欧洲及亚洲的核桃居群作了分析比较,SSR分子标记技术是近几年发展起来的、以PCR为基础的DNA多态性检测技术,具有共显性、稳定性好、多态性高和遗传信息量大的特点,是较为理想的分子标记[17]。黑核桃SSR的成功提取及对核桃栽培品种的研究显示SSR标记技术可能成为核桃属植物多样性研究的有效工具[18]。笔者运用SSR分子标记对西北农林科技大学资源苗圃的18份核桃材料进行遗传多样性和亲缘关系的分析,为今后选择亲本杂交育种及种质创新提供理论指导。
1 材料和方法
1.1 材料的采集和处理
试验材料包括15个核桃品种和3个实生样品。于四月上旬,采集其新鲜嫩叶,低温带回实验室,放入-80°冰箱中保存待用,所有材料均采集于西北农林科技大学核桃实验基地。(详见表1)

表1 供试核桃品种名称及来源Table 1 Walnuts cultivars collected in the course of this study
1.2 方法
1.2.1 DNA的提取与检测
采用改良的CTAB法[19]提取DNA,用分光光度计和1%的琼脂糖凝胶电泳法检测DNA的浓度与质量(见图1)。获得浓度和纯度符合要求的DNA,将其稀释至100 ng·μL-1,存于-20 ℃备用。DNA质量浓度(ng/μL)=A260×50×稀释倍数
1.2.2 引物
1.2.2.1 引物的合成及来源
SSR 引物来自于黑核桃(J. nigra)和从GenBank数据库开发的引物[20]共27对,由英潍捷基有限公司合成 。

图1 核桃DNA提取物的电泳检测Fig.1 Result of agarose electrophoresis of walnuts DNA
1.2.2.2 引物的筛选和退火温度的确定
选用西洛3号、绿香和艺核1号3个品种对合成的27对引物进行扩增,筛选出扩增条带稳定清晰且多态性好的多条引物进行研究,并探索其退火温度
1.2.2.3 PCR反应程序和体系的优化
SSR反应程序采用:94 ℃变性3 min,94 ℃30 s,Tm 45 ℃退火30 s,72 ℃延伸45 s,30个循环;72 ℃ 5 min 延伸,最后 4 ℃保存。
由于PCR反应体系中各个因素,如Mg2+,Taq酶,dNTP,模板,和引物浓度等的大小直接影响到扩增效率,进而影响到实验结果,因此有必要对反应体系进行优化。体系的优化采用采用五因素四水平L16(45)的正交实验进行,用20 μL的反应体系,Buffer均为2 μL,不足20 μL加水补足,三次重复,各因素水平优化结果为:Taq酶0.5 U,Mg2+4 mmol·L-1,引物 0.8 pm·L-1,模板 120 ng,dNTP0.4 mmol·L-1,10×Buffer2 μL,水 11.9 μL。
1.2.3 电泳及凝胶成像
SSR引物扩增的产物采用8%的聚丙烯酰胺凝胶电泳,250 V欲电泳30 min后,5 μL样与1 μL6×Loading buffer混匀后上样,缓冲液用1×TBE,在250 V电压下电泳3 T。电泳过后用1%的硝酸银染色,再经过15% NaOH显色拍照。
1.2.4 数据分析
以DM2000为标准,同一个引物扩增后,经过电泳,凝胶上同一位置上的条带被认为属于同一位点且具有同源性,每个条带视为一个标记。故根据条带的有无,记录数据,有条带的记录1,无条带的记录0,计算多态信息含量(PIC),并经过NT-SYSpc2.1[21]软件分析得出遗传相似系数(GS)和树状图。
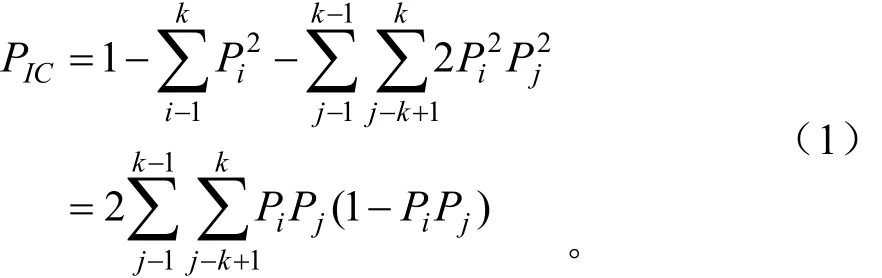
式(1)中:Pi、Pj分别为群体中第i、j个等位基因频率,k为等位基因数。

式(2)中:Ni为供试样品i中出现的扩增片段个数,Nj为供试材料j中出现的扩增片段个数,Nij为供试材料i和j共有的扩增片段个数。用SAHN程序中的UPGMA方法进行聚类分析。
2 结果与分析
2.1 SSR标记结果及其引物的退火温度,PIC值分析
筛选出来的12对引物对供试样品进行扩增之后,把在凝胶上有同一迁移率的条带做为一个同源位点,进行统计,最后从27对SSR引物中筛选出12对有稳定扩增产物,扩增产物的片段的大小大多在100~500 bp之间。12条引物的共扩增出174条谱带,其中多态性条带118条,占总条带数的67.82%。引物WGA33 扩增的条带数最多为17条,引物ZMZ44次之为15条。引物WGA82,ZMZ31,ZMZ45 扩增的谱带数最少,均为6条,平均每个引物扩增的条带数为9.83条。图1为引物ZMZ31扩增后的电泳图谱,图中以50 bp Ladder作为相对分子质量标准。最右侧的 泳道M为来自康为世纪的50 bp Ladder 扩增的结果,其作为分子量大小的标准,中间的从左到右编号为1,2,3,……,17,18等十八个泳道依次为十八个样品的扩增结果。

图2 引物ZMZ31对18份供试材料的ISSR扩增电泳Fig.2 Electrophoresis pattern amplif i ed from 18 tested materials with primer ZMZ31†
对SSR的27对引物进行退火温度的探索,运用梯度PCR进行扩增,温度梯度设为40~56八个浓度梯度,各个引物的Tm均包含在其中。选用形态差异大的3个核桃品种西洛3号,艺核1号,绿香进行实验,结果发现基于SSR的引物采用不同的退火温度进行扩增后,结果表明差异不明显,因此均采用45°进行后续试验。引物特征见表4。
多态信息含量(polymorphism information content,PIC)是表示DNA变异程度的一个指标,反应 DNA多态高低,位点的PIC值均大于0.50,表明具有较高的多态信息量,在核桃组内遗传分析中有广泛的应用价值。当PIC值>0.5 时, 标记具有高度可供信息性;0.50>PIC>0.25 时,标记能够较合理的提供信息;PIC值<0.25 时,标记可供信息性差[22]。12对引物扩增结果的PIC值,最大值为0.896 2,最小值为0.742 2,其平均值为0.815 0,其值均大于0.5,说明本研究中的12对引物扩增的位点均表现出高度多态,表明供试样品遗传资源非常丰富,见表2。
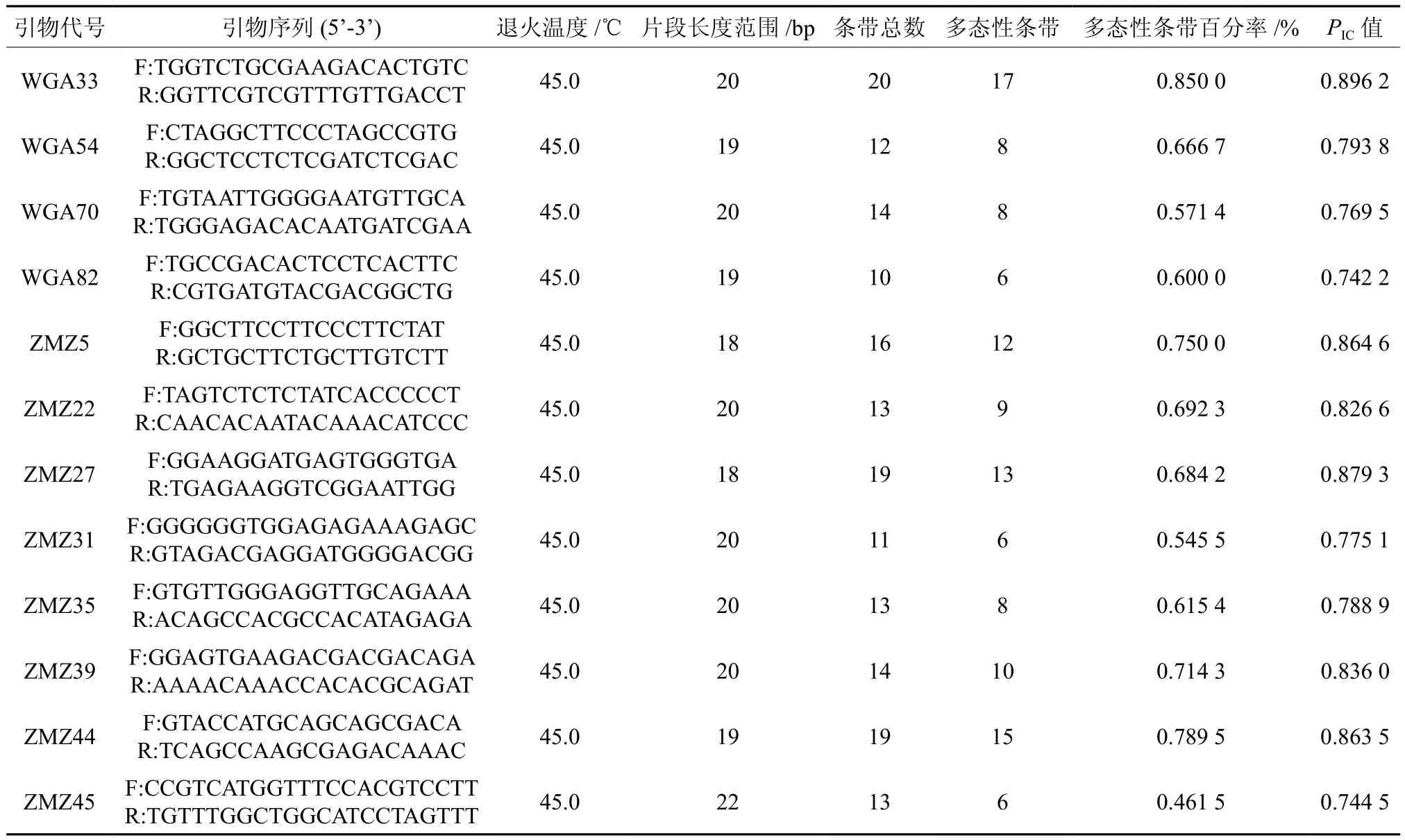
表2 参试8对SSR引物的特征及扩增结果Table 2 Characteristics of eight pairs of SSR primers and PCR results
2.2 遗传相似系数分析
根据Nei等[23]的方法,18个供试样品间的遗传相似系数见表3,其平均遗传相似系数为0.406 9。由表可看出,18个供试品种(优系)中,实生类型的优良株系间相似系数最大。实生优系2和3的相似系数达到了1.000,实生优系1和2,3的相似系数达到了0.888 9,0.888 9。在供试的15个优良品种中,吐莱尔与实生优系的相似程度最大。吐莱尔与实生优系1,2,3的相似系数分别为0.769 2,0.805 6,0.805 6,故推断吐莱尔与3个实生优系亲缘关系较近。品种间新疆2号和辽宁4号遗传相似系数最大,为0.803 6,青林和西林2号之间遗传相似系数最小,为0.159 4。综上可知18个核桃品种丰富,可作为育种来源。
2.3 聚类分析
用软件NSTYS-PC进行数据分析,计算出18个样品的遗传相似系数后,并利用不加权成对算术平均法(UPGMA)对供试材料进行聚类分析得到树状图见图2所示,NSTYS-PC数据分析显示,树状图的r值为0.833 2,在0.8和0.9之间,说明此进化树符合较好。在遗传相似系数阈值为0.39左右可将供试品种分成四大类:第一类1西洛3号 2.S1 3.S2 4.S3 5.清香6.西林3号 10.香玲11.吐莱尔12.温185 13.辽宁4号 15.新疆2号;第二类7.西林2号;第三类8.维纳9.契可14.艺核1号;第四类,16.青林 17.W06-1 18.绿香。
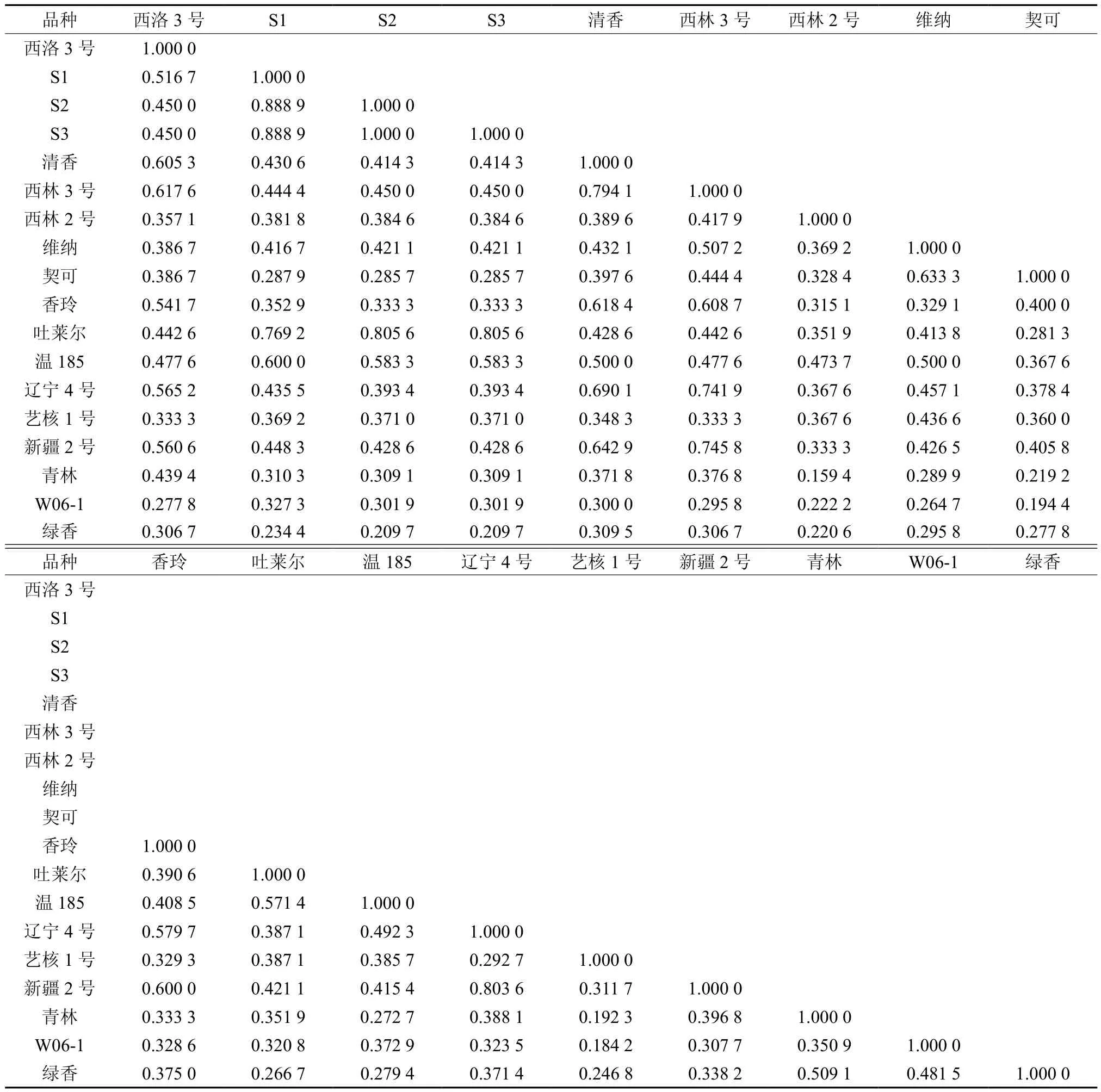
表3 供试样品的相似系数Table 3 Similarity coefficients of tested samples

图3 18个核桃品种的遗传多样性聚类†Fig.3 Dendrogram of 18 walnut varieties based on genetic similarity
3 讨 论
简单重复序(SSR)也称微卫星DNA,在真核生物中,存在许多2~5 bp简单重复序列,称为“微卫星DNA”其两端的序列高度保守,可设计双引物进行PCR扩增,揭示其多态性。 SSR长度变异极大,标记的多态性非常高,信息量也很丰富;而且一旦开发出合适的特异引物,检测分析就变得简单易行,因而在品种鉴定和多样性分析中有很高的应用价值。但SSR标记两端序列保守,所以设计的引物必须与两端保守序列互补,这给微卫星标记的开发和应用带来一定的困难。因此要想开发一套某种生物的微卫星标记,是一个过程繁琐、工作量大、效率低、花费大的工作,从而使得SSR的应用受到一定限制。目前,核桃上SSR引物的来源有两种,一种是已经开发得来的近缘种黑核桃的SSR引物,研究显示黑核桃微卫星可用于核桃属植物进化和分类学方面的研究[24],在本实验中引物名称前代号为WGA的都是来自黑核桃的引物;一种是利用生物信息学方法对NCBI网上公开的5 213条胡桃ESTs序列进行EST-SSR特征分析,利用利用Primer3.0软件对筛选出的EST序列设计引物[25]。
传统分类是以主要形态特征为依据,采用分子标记技术鉴定植物品种具有快速、准确的特点,具有广泛的应用价值,但对植物品种的分类常常与传统的分类方法不一致。作为传统分类的补充,SSR 标记可减少由形态描述和环境条件产生的误差,从分子水平鉴定个体和群体间的差异,分子标记方法是通过多个不同引物给出覆盖整个基因组的多态性信息,由于目前常用的分子标记方法如RAPD、ISSR、SSR等,标记的数量有限,不能构建饱和的SSR指纹图谱,不能标记所有的功能基因,因此两种分类系统在某些情况下不可能完全吻合。本试验中西洛3号晚实品种与早实品种香玲、吐莱尔等早实品种列为一类,这与王红霞等[26]在种群聚类中,把早实与晚实品种聚在一起,说明通过聚类分析难以将早实核桃和晚实核桃截然分开相一致。庞晓明等[27]对枳属种质的 AFLP分子标记分析也得出相似的结论,罗正荣等[28]对日本甜柿、中国原产涩柿和甜柿的 RAPD 分子标记结果的聚类分析中,涩柿和甜柿同样未被区分开。
基于分子标记的遗传分析(亲缘关系分析)为核桃育种提供参考根据杂交理论,杂交亲本的亲缘关系越远,获得杂种优势的可能性越大,但是遗传距离越远杂交成功率就越低。对这些丰富的核桃种质资源进行系统的评价、研究,选择亲本进行杂交育种及种质创新时利用分子标记辅助是当前新品种培育的一个发展方向。
[1] 郗荣庭,张毅萍.中国果树志·核桃卷[M].北京:中国林业出版社,1996.
[2] 高焕章,张 义,李秋杰,等.世界核桃产销概况与湖北名优产品开发对策[J].湖北农学院学报,2000,20(2):141-143.
[3] 郗荣庭, 张毅萍.中国核桃.北京:中国林业出版社,1992.
[4] 高 翔,庞红喜,裴阿卫.分子标记技术在植物遗传多样性研究中的应用[J] 河南农业大学学报,2002,36(4):356-359
[5] 奚声珂.我国胡桃属(Juglans L.)种质资源与核桃(Juglans regia L.)育种[J].林业科学,1987,23(3): 342-350.
[6] 穆英林,郗荣庭,吕增仁.核桃属部分种的小孢子发生及核型研究[J].武汉植物学研究.1990,8(4):301-310.
[7] 杨自湘,奚声珂.胡桃属十种植物的过氧化物同工酶分析[J].植物分类学报,1989,27(1):53-57.
[8] 陈 新,张士刚,魏海蓉,等.陕西核桃实生居群遗传多样性ISSR 分析[J].山东农业科学,2012,44(5):1-4.
[9] 汤正辉,祝亚军,谭晓风,等. 河南连翘种群遗传多样性的ISSR 分析[J]. 中南林业科技大学学报,2013,33(8):32-37.
[10] 朱炳耀,杨志敏, 庄志鸿,等. 不同区域小油桐种质差异与ISSR 分子标记研究[J]. 中南林业科技大学学报,2013,33(4):13-16.
[11] 王 滑,郝俊民,王宝庆,等.中国核桃8个天然居群遗传多样性分析[J].林业科学,2007,43(7):121-126.
[12] 陈少瑜,杨 恩,张 雨,等.云南核桃品种遗传多样性的PAPD和ISSR标记研究[J].河北林果研究,2007,22(1):56-58.
[13] DANIEL P, GAO F Y, GIOVANNAA. Inter-simple sequence repeat markers for fingerprinting and determining genetic relationships of walnut (Juglans regia) cultivars[J].Amer Soc Hort Sci, 2002,127(1):75-81.
[14] 陈少瑜,张 雨,陈 霞,等.27份核桃种质资源亲缘关系的ISSR分析[J].西北林学院学报,2012,27(4):108-112
[15] 吴燕民,裴 东,奚声珂.运用RAPD对核桃属种间亲缘关系的研究[J].园艺学报,2000,27(1):17-22.
[16] 王 滑,郝俊民,王宝庆,等.中国核桃8个天然居群遗传多样性分析[J].林业科学,2007,43(7):120-124.
[17] 邹喻萍,葛 颂,王晓东.系统与进化植物学中的分子标记[M].北京:科学出版社,2001, 68-107.
[18] Dang G S, Woeste K,Aradhya M K, et al. Characterization of 14 microsatellite markers for genetic analysis and cultivar –Identification of walnut[J]. AMER SOC HORT SCI, 2005,130(3): 348-354.
[19] 陈 静, 王文江.适于 AFLP 分析的核桃幼叶 DNA 提取方法.河北农业大学学报,2004, 27(6):44-47.
[20] 黄少勇,张智俊,罗淑萍,等.山核桃EST-SSR 引物的筛选及通用性分析,经济林研究[J],2013,31(3):10-15.
[21] RohlF FJ. NTSYS-pc numerical taxonomy and multivariate analysis system[M] .version 2.1.Exeter Pub New York ,2000.
[22] 况少青,张宇舟,陈 竺.基因组扫描-遗传病相关基因定位的有力工具[J].中华医学遗传杂志,1997,14(2):99-103.
[23] Nei M, LIW H. Mathematical model for studying genetic variation in terms of restriction endonucleases[J]. Proc Natl A cad Sci, 1979, 76(10):5269-5273.
[24] 郝艳宾,肖永强,齐建勋,等,微卫星DNA在核桃属近缘种同源性分析上的应用[J],北京农学院学报,2006,21(3):1-4.
[25] 秦 玥,刘梦培,傅大立,等 华仁杏SSR 标记的筛选与评价[J].经济林研究,2013,31(3):72-76.
[26] 王红霞,赵书岗,高 仪,等.普通核桃遗传多样性的 AFLP分析[J],中国农业科学, 2011,44(7):1434-1442.
[27] 庞晓明,邓秀新,胡春根.枳属 36 份特异种质的 AFLP 指纹图谱构建与分析[J].园艺学报,2003,30(4):394-398.
[28] 罗正荣,李发芳,蔡礼鸿.部分中国原产甜柿种质的分子系统学研究[J].园艺学报,1999, 26(5): 297-301.
Application of microsatellite DNA on analyzing genetic diversity of Juglans regia
XIAO Zhi-juan, ZHAI Mei-zhi, WANG Zhen-yuan, XU Jing, LI Li, YANG Hui
(College of Forestry, North West Agriculture and Forestry University, Yangling 712100, Shanxi, China)
In order to study genetic diversity of different walnut varieties and to provide theoretical basis for breeding new varieties and obtaining new germplasm resources, the genetic diversities of the 18 Juglans regia species (including three strong and good seedling varieties) in nursery garden of North West Agriculture and Forestry University were studied by using SSR molecular marker technology.The PCR optimum system was set up; 12 primers with good repeatability and strong polymorphism were screened out from 27 primers;174 bands were amplif i ed out totally, in which 118 were pollymorphism bands, accounting for 67.82% of the total, the averaged number of the polymorphic loci of each primer was 9.8. The similarity coeff i cient between Xinjiang 2 and Liaoning 4 was the maximum (0.803 6), that between Qinglin and Xilin 2 was minimum (0.159 4),the averaged value of the similarity coeff i cient was 0.815 0. Polymorphic information contents (PIC) ranged from 0.742 2 to 0.896 2, and all values were greater than 0.500 0. The cluster analyses with UPGMA method show that the 27 germplasm could be divided into 4 groups. It was indicated that 15 primers sites showed a high degree of polymorphism, also showed that the genetic resources of these samples were very rich.
Juglans regia; walnuts; SSR molecular markers; system optimization; genetic diversity
S722.3
A
1673-923X(2014)02-0055-07
2013-04-26
国家林业公益性行业科研专项(201004027)
肖志娟(1987-),女,河南渑池人,硕士研究生,主要从事林木遗传改良方面的研究;E-mail:xzj525@126.com
翟梅枝(1963-),女,河南西平人,教授, 硕士生导师,主要从事经济林及资源利用的教学和科研工作;
E-mail:plum-zhai@163.com
[本文编校:文凤鸣]
