苦参组织培养及快繁体系研究初探
2014-12-25李秀丽
赵 晖,纪 瑛,李秀丽
(甘肃农业职业技术学院,甘肃 兰州 730020)
苦参(Sorphoa flavescens var.flavescens)为豆科苦参属的变种,从其根、茎、叶和种子中提取的苦参碱、苦参素被大量应用到医药、保健等方面,提取苦参碱、苦参素后的残渣也是生产有机肥的好原料[1~3]。苦参中的苦参碱作为植物杀虫剂杀虫效果好,对人、畜无毒害,且不产生抗药性,具有广阔的发展前景。长期以来,苦参生药资源大多以采挖野生植物为主,超限量采挖造成野生资源日益枯竭。近年来,一些地区相继开展了人工苦参栽培,但大部分以采集野生种子繁殖为主,且能采集的苦参种子量非常有限,难以满足大规模生产的需要,加之苦参种子硬实率高达90%以上,种皮硬,发芽率低,种苗严重不足已成为制约苦参规范化、规模化栽培的瓶颈[4~6]。目前国内外对苦参组织培养技术的报道较少,若将组织培养技术应用到苦参种苗繁殖和生产中,不仅可保持优良母株性状,而且繁殖速度快,对实现苦参规模化栽培,提高产量和品质十分有利[7~8]。我们进行苦参组培快繁体系中外植体选择、适宜培养基筛选、驯化移栽等关键性技术研究,以期为苦参组培工厂化育苗提供技术支撑,也为药用植物资源的种质离体保存提供一条新途径。
1 材料与方法
1.1 材料
初代培养的外植体选用当年收获的苦参种子增殖培养的外植体选用初代培养获得的生长健壮的无菌苗茎尖或茎段,生根培养的外植体选用继代培养获得的生长健壮的无菌苗茎尖或茎段,驯化移栽苗选用生根培养时获得的生长健壮的无菌苗。NAA、6-BA均为分析纯,由上海惠世生化试剂有限公司生产。
1.2 方法
1.2.1 初代培养 选择粒大、饱满的苦参种子,先用98%浓硫酸浸泡40 min后,再用自来水冲洗3次进行预处理,然后在无菌条件下采用乙醇与升汞联合的3种处理方法进行消毒,处理1为75%乙醇 3 s+0.1%升汞 5 min,处理 2为 75%乙醇8 s+0.1%升汞8 min,处理3为75%乙醇10 s+0.1%升汞10 min。消毒后的种子接种在MS培养基(基础MS+30 g/L蔗糖+7 g/L琼脂,pH 5.8)上,每处理接种60瓶,每瓶3~4粒。置于(25±2)℃、1 500~2 000 Lx(10 h/d)条件下培养,7 d后统计污染率,21 d后统计成苗率。
1.2.2 增殖培养 在无菌条件下,将无菌苗(株高约10 cm)切割为带单芽的茎段,接种于增殖培养基上诱导腋芽与丛生芽。增殖培养基共设9个处理,处理①为MS+0.1 mg/L NAA+1.0 mg/L 6-BA,处理②为MS+0.3 mg/L NAA+1.0 mg/L 6-BA,处理③为MS+0.5 mg/L NAA+1.0 mg/L 6-BA,处理④为MS+0.1 mg/L NAA+2.0 mg/L 6-BA,处理⑤为MS+0.3 mg/L NAA+2.0 mg/L 6-BA,处理⑥为MS+0.5 mg/L NAA+2.0 mg/L 6-BA,处理⑦为MS+0.1 mg/L NAA+3.0 mg/L 6-BA,处理⑧为MS+0.3 mg/L NAA+3.0 mg/L 6-BA,处理⑨为MS+0.5 mg/L NAA+3.0 mg/L 6-BA。每处理接种30瓶,每瓶接种2~3个单芽茎段,培养条件同初代培养,7、21 d后统计总芽数及增殖率。
1.2.3 生根培养 在无菌条件下,将无菌苗切割为带2个芽的茎段,接入生根培养基中进行生根培养。生根培养基6个,编号分别为Ⅰ、Ⅱ、Ⅲ、Ⅳ、Ⅴ、Ⅵ,Ⅰ为MS+0.1 mg/L NAA,Ⅱ为MS+0.3 mg/L NAA,Ⅲ为MS+0.5 mg/L NAA,Ⅳ为1/2 MS+0.1 mg/LNAA,Ⅴ为1/2 MS+0.3 mg/LNAA,Ⅵ为1/2MS+0.5 mg/L NAA。每处理接种30瓶,每瓶接3~4个茎段,培养条件同初代培养。接种后30 d统计生根率,生根数及根长。
1.2.4 驯化与移栽 选择根长1~2 cm的无菌苗,在自然光照下驯化5 d后从培养瓶中取出,轻轻洗去根部的琼脂,分别栽入蛭石与田园土按1∶1配制的混合基质和纯蛭石两种基质中,移栽前先将基质灭菌后装入营养钵中铺平压实,浇透水,移栽时用竹签在基质表面打孔,将组培苗栽入并压实。每钵栽1株,每处理30钵。初期保持环境温度20~25℃,间隔4 h喷水1次,保持空气相对湿度80%以上,5 d后逐渐降低温度与湿度,转入自然光下培养,并于移栽后5、10、15 d统计组培苗成活率。
2 结果与分析
2.1 消毒处理对苦参种子初代培养成苗的影响
由表1可见,利用不同的消毒方法处理苦参种子后,初代培养时污染率均未超过10%,成苗率为30.0%~68.2%。其中以处理2的污染率相对较低,为6.6%,成苗率最高,为68.2%,污染率较处理3高1.6百分点,较处理1低3.4百分点;成苗率较处理3高38.2百分点,较处理1高32.1百分点。且处理2成苗率与处理1差异显著,与处理3差异极显著。
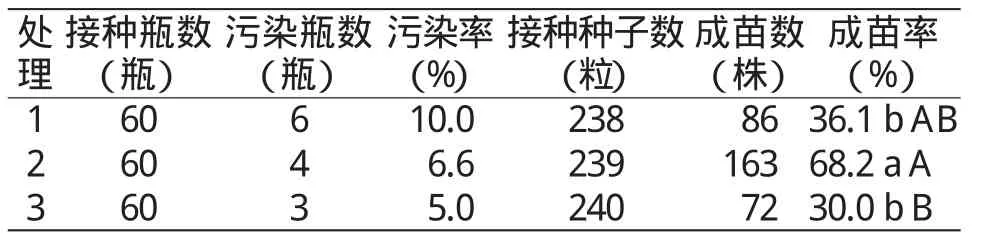
表1 不同消毒处理苦参种子初代培养的污染率与成苗率
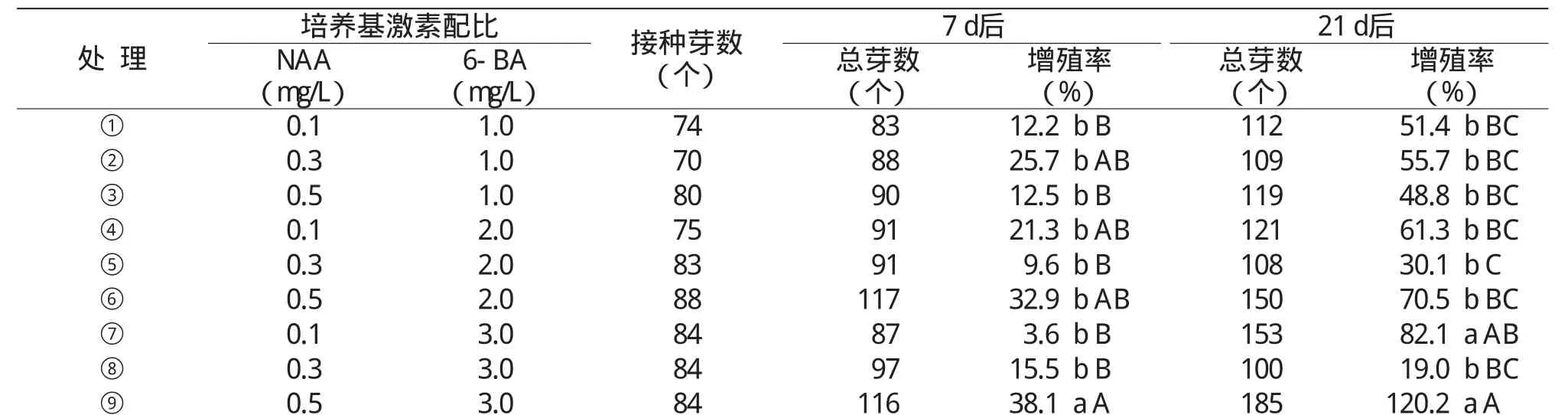
表2 不同激素配比的苦参诱导芽的增殖率
2.2 激素配比对苦参诱导芽增殖的影响
由表2可见,在添加不同浓度的NAA和6-BA的MS培养基中,苦参无菌苗诱导芽增殖率各不相同。其中,处理9(MS+0.5 mg/L NAA+3.0 mg/L 6-BA)的培养基在接种7 d后和21 d后的芽增殖率均为最高,分别为38.1%和120.2%,分别较其它处理高5.2~34.5百分点和38.1~101.2百分点;其次是处理7(MS+0.1 mg/L NAA+3.0 mg/L 6-BA),虽然在接种7 d后增殖率最低,但在接种21 d后的增殖率较高,达82.1%。且接种7 d后,处理9与处理6、处理2、处理4差异显著,与其它处理差异极显著;接种21 d后,处理9与处理7差异不显著,与其它处理差异极显著。综合考虑可见,MS培养基中分别添加0.1、3.0 mg/L 6-BA和0.5 mg/L NAA、3.0 mg/L 6-BA的芽增殖效果较好。
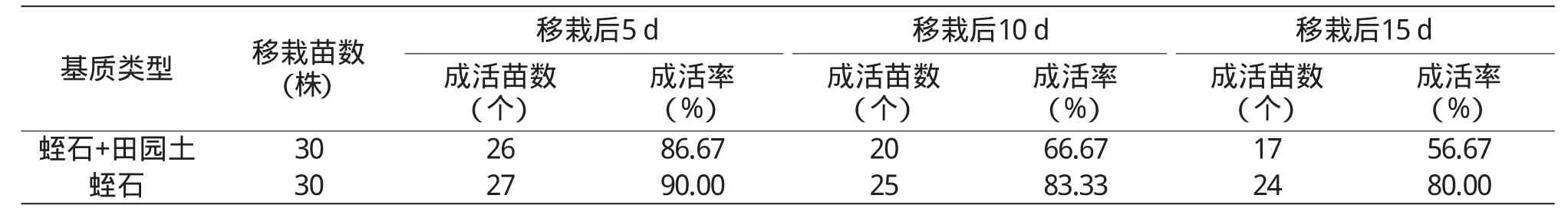
表3 不同移栽基质中苦参组培苗的移栽成活率
2.3 培养基对苦参组培苗生根的影响
由图1、2、3可见,在MS培养基中分别添加0.1、0.3、0.5 mg/L NAA培养30 d后,苦参组培苗的生根率和生根数均随NAA浓度的升高而增加,在添加0.1 mg/LNAA的培养基中,根系生长更快,平均根长最长。在1/2 MS培养基中,分别添加0.1、0.3、0.5 mg/L NAA培养30 d后,苦参组培苗的生根率、生根数及根长均以添加0.1 mg/L NAA时最高。表明含低浓度无机盐与生长素NAA的培养基更有利于苦参组培苗生根。
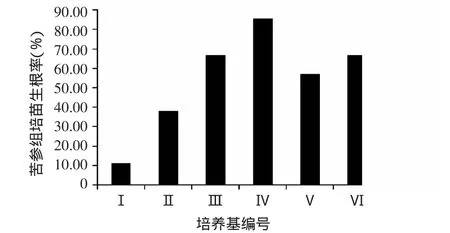
图1 不同培养基对苦参组培苗生根率的影响
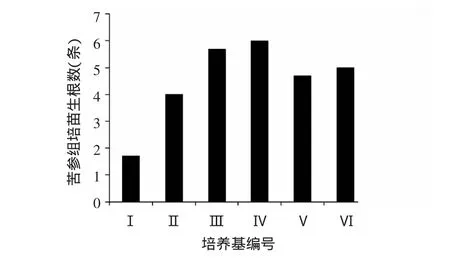
图2 不同培养基对苦参组培苗生根数的影响
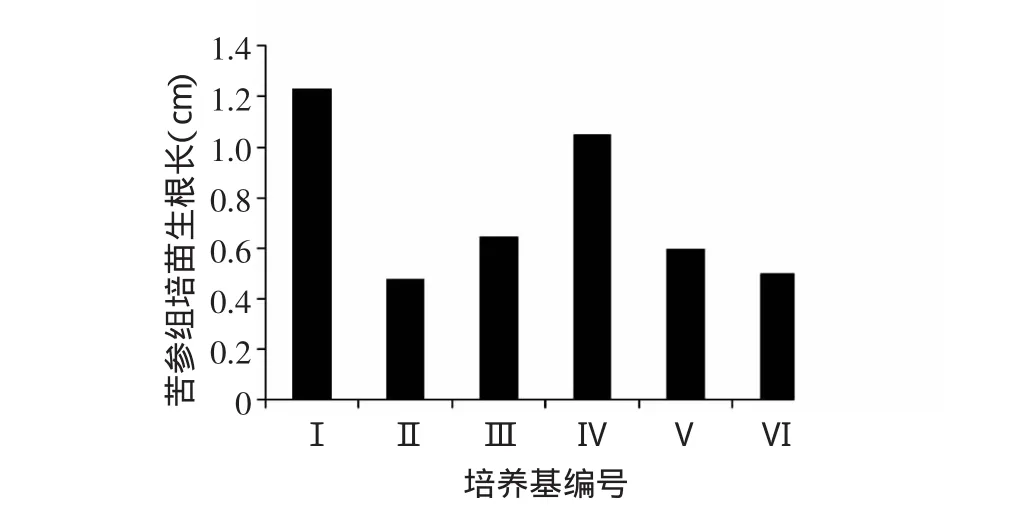
图3 不同培养基对苦参组培苗平均根长的影响
2.4 基质对苦参组培苗移栽成活率的影响
由表3可见,移栽后5、10、15 d,均以纯蛭石为基质的组培苗成活率最高,达80%以上。移栽后15 d,蛭石与田园土混合基质中的组培苗成活率仅为56.67%。在营养钵中培养20 d后,苦参苗平均株高8.39 cm,叶片数5片,平均根长4.23 cm,带土移栽至大田后成活率可达90%以上。
3 小结
试验结果表明,以苦参种子作为外植体,采用75%乙醇8 s+0.1%升汞8 min消毒后,污染率低,易获得无菌材料。MS培养基中分别添加0.1、3.0 mg/L 6-BA和0.5 mg/L NAA、3.0 mg/L 6-BA的增殖效果较好,增殖率最高达120.2%。在1/2 MS培养基中添加0.1 mg/L的NAA,更利于苦参组培苗生根。根长1.00~2.00 cm的无菌苗,在自然光下驯化培养5 d后移栽至蛭石基质中,成活率较高,移栽后5~15 d的成活率达80%以上。
[1] 程广有,唐晓杰.苦参组培快繁技术体系的初步研究[J].西北植物学报,2007,27(5):1 026-1 029.
[2] 李如升,杨树春,郭宝英,等.苦参的开发利用与栽培[J]. 特种经济动植物,2002(8):27.
[3] 郑永权,姚建仁,邵向东.苦参化学成分及农业应用研究概况[J]. 农药科学与管理,2000,21(1):24-26;30.
[4] 张庆霞,纪 瑛,杜彦斌,等.日光温室苦参播种育苗技术[J]. 甘肃农业科技,2010(1):56-57.
[5] 谢琴淑,安永明,魏 兵.四个苦参品种在甘谷县的引种初报[J]. 甘肃农业科技,2012(9):19-22.
[6] 郭增祥.苦参人工栽培驯化技术[J].甘肃农业科技,2007(7):56-57.
[7] 杨春梅,孟金贵,吴丽芳,等.苦参组培快繁技术研究[J]. 云南农业科技,2009(1):11-12.
[8] 许继宏,马玉芳,陈锐平,等.苦参药用植物组织培养技术[M].北京:中国农业科学技术出版社,2003:104-105.
