食品中2,3-丁二酮形成机制和检测方法的研究进展*
2014-12-25相启森马云芳董吉林申瑞玲
相启森,马云芳,董吉林,申瑞玲
(郑州轻工业学院 食品与生物工程学院,河南 郑州,450002)
2,3-丁二酮又名双乙酰、丁二酮,是一种黄色至浅绿色且具有强烈奶油香味的重要香料。2,3-丁二酮天然存在于发酵乳制品和啤酒等发酵饮料中,1983年被美国食品药品监督管理局(FDA)规定为GRAS级(generally recognized as safe),广泛用作焙烤食品、非酒精饮料、糖果、乳制品替代品、奶油等食品的风味物质[1-4]。最近的研究表明,2,3-丁二酮具有导致闭塞性细支气管炎、诱导氧化应激等毒性作用,食品中2,3-丁二酮的安全性问题引起了国内外的广泛关注[5-6]。本文综述了食品中2,3-丁二酮形成机制和检测方法方面的研究进展。
1 食品中2,3-丁二酮形成机制
在食品加工过程中,2,3-丁二酮的形成途径主要包括脂质氧化、糖类分解、美拉德反应、微生物发酵和核黄素光敏氧化等。
1.1 脂质氧化
富含脂肪酸的食品在烹调和热加工过程中能够产生2,3-丁二酮等羰基化合物,其可能反应途径见图1[4]。不饱和脂肪酸在超氧阴离子(O-2·)、单线态氧(1O2)、羟自由基(·OH)等活性氧作用下发生过氧化反应,形成氢过氧化物、环氧化合物等中间产物,中间产物能够继续反应并生成2,3-丁二酮等活性羰基化合物[3,7]。例如,生牛乳中 2,3-丁二酮含量为 5 μg/kg,依次经 82℃ 加热 30 min、146℃ 加热 4 s后,2,3-丁二酮含量升高到 38 μg/kg[8]。Jiang 等的研究表明,奶油和人造黄油中2,3-丁二酮的生成量随加热温度升高而显著升高;经100℃和200℃加热1 h后,人造黄油中2,3-丁二酮含量分别为(264.3±38.8)ng/g 和(2 274.5 ±442.6)ng/g[9]。
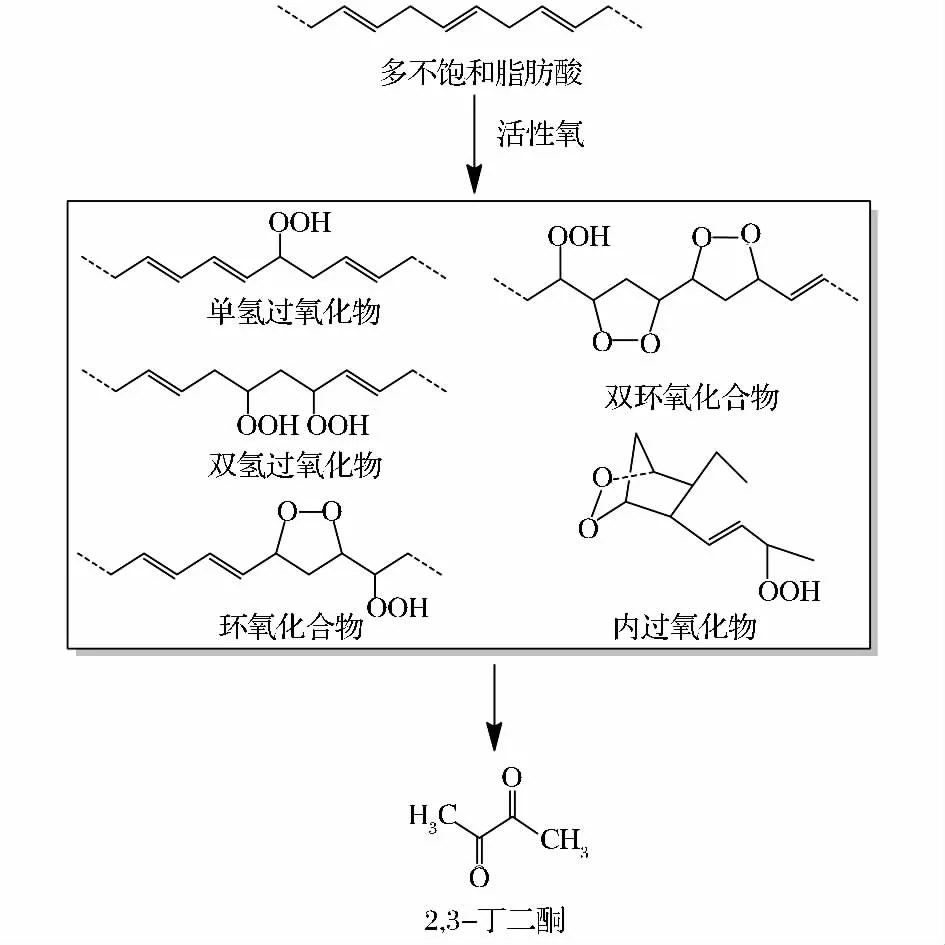
图1 脂质氧化形成2,3-丁二酮的可能途径Fig.1 Proposed formation pathway of 2,3-butanedione from lipids oxidation
1.2 糖类分解
糖类化合物在加工过程中的热分解是食品中2,3-丁二酮形成的另一种重要途径。如图2所示,加工过程中单糖分子发生异构化(主要存在于果糖和葡萄糖之间),异构化产物果糖通过一系列反应形成酮-烯醇式互变异构;在碱性或酸性条件下,酮-烯醇式互变异构中C4—C5键发生断裂而形成2,3-丁二酮和乙二醛[4]。加热温度、时间和 pH是影响2,3-丁二酮生成的主要因素。2,3-丁二酮生成量随加热温度升高、加热时间延长而升高;蔗糖加热过程中2,3-丁二酮形成的最适 pH值范围为6~8[10]。对于葡萄糖,其断键位置可能在C2和C3之间[11]。
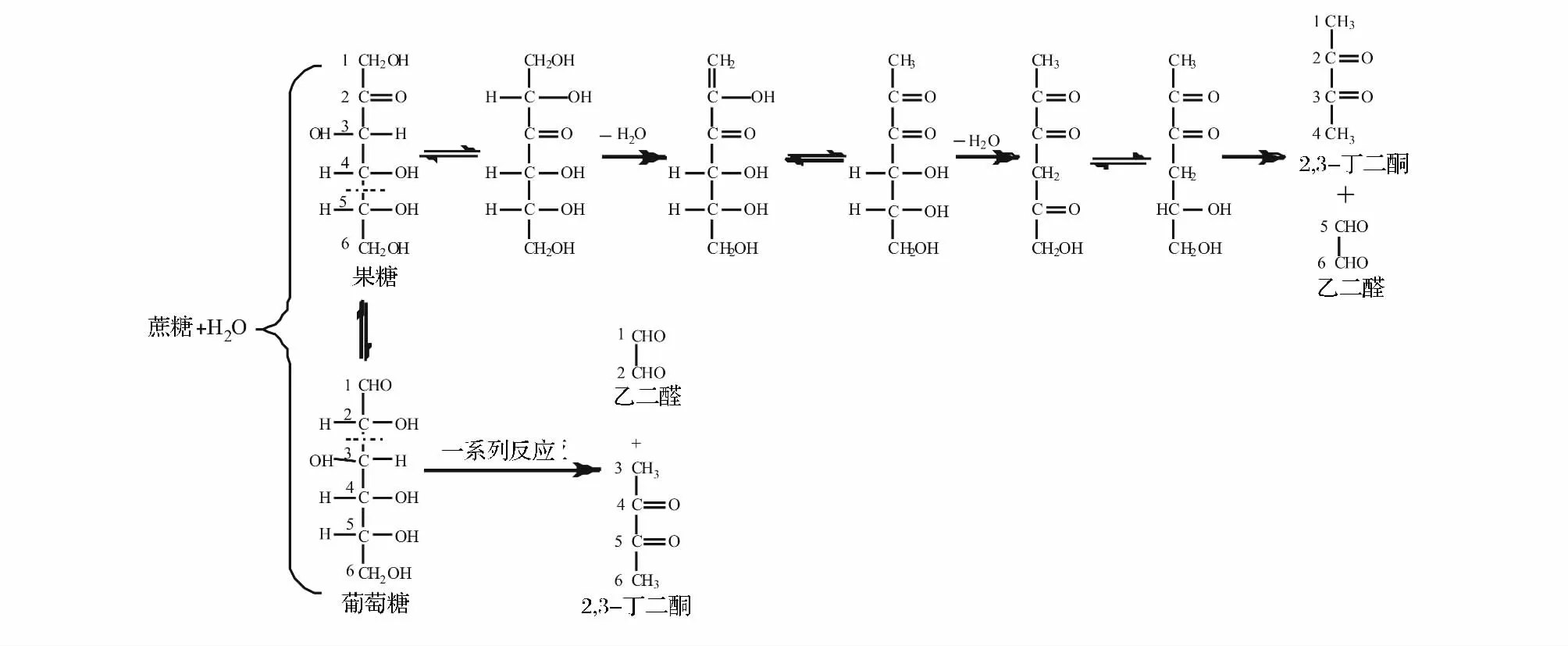
图2 糖类形成2,3-丁二酮的可能途径Fig.2 Proposed formation pathways of 2,3-butanedione from carbonydrate
除图1和图2所示的2,3-丁二酮形成途径以外,脂质和糖类通过氧化或分解产生的一系列低分子量羰基自由基在吸收能量后也能够生成包括2,3-丁二酮在内的α-二羰基化合物[4,10]。
1.3 美拉德反应(Maillard reaction)
美拉德反应是发生于氨基化合物(蛋白质、肽、胺、氨和氨基酸等)和羰基化合物(还原糖、脂质以及由此而来的醛、酮等)之间的一系列形成食品中香味和色素类物质的复杂反应[12]。2,3-丁二酮是一种重要的美拉德反应产物,是构成咖啡香味的主要物质[10]。在D-葡萄糖、氨水和亚硫酸盐组成的美拉德反应模拟体系中,2,3-丁二酮的生成量随葡萄糖和氨水浓度的升高而升高,而美拉德反应抑制剂Na2SO3能显著抑制2,3-丁二酮的生成[10]。
此外,国外对美拉德反应过程中2,3-丁二酮的形成机制进行了大量研究。在[13C-2]甘氨酸/葡萄糖模拟反应体系中,70%的2,3-丁二酮分子结构中含有1个13C原子,表明氨基酸参与了美拉德模拟反应体系中丙酮醛到2,3-丁二酮的转化[11]。在[13C-2]甘氨酸/乙二醛模拟反应体系中,2,3-丁二酮全部被13C标记;而在[13C-2]甘氨酸/丙酮醛模拟反应体系中,2,3-丁二酮全部含有1个13C原子[11]。以上结果表明,2,3-丁二酮的形成涉及氨基酸中C原子与二羰基化合物之间的反应[11]。综上所述,美拉德反应中除糖类化合物的热分解反应形成2,3-丁二酮以外,氨基酸与糖类化合物降解产物(活性醛类化合物)之间的反应也是形成2,3-丁二酮的重要途径。
1.4 微生物发酵
在啤酒、威士忌、法国白兰地等发酵型酒精饮料及发酵乳制品中,2,3-丁二酮主要由微生物代谢产生[13-14]。影响微生物合成2,3-丁二酮的因素主要包括微生物种类、发酵底物和发酵时间等。能够代谢产生2,3-丁二酮的微生物主要包括乳酸菌属[14]、芽孢杆菌属[14-15]、肠杆菌属[16-17]、明串珠菌[18]以及某些酵母[13,19-20],其底物主要包括葡萄糖、柠檬酸以及牛乳等。李妍等的研究表明,2,3-丁二酮合成能力由高到低依次为瑞士乳杆菌、干酪乳杆菌和保加利亚乳杆菌[21]。同时,微生物种类也影响了2,3-丁二酮的生成动力学。大部分乳杆菌的2,3-丁二酮产量随发酵时间的延长而升高,而在菌株 Lb.casei subsp.casei 154发酵姜汁过程中,2,3-丁二酮产量在18 h即达到最大值并随发酵时间的延长而降低[22]。
国内外对乳发酵过程中2,3-丁二酮的生成途径、生成条件及代谢调控方式等进行了大量研究,发现乳酸菌主要通过柠檬酸途径和葡萄糖途径合成2,3-丁二酮[17-19]。在乳酸菌等微生物的柠檬酸代谢途径中(图3),柠檬酸在柠檬酸裂解酶的作用下裂解为乙酸和草酰乙酸,草酰乙酸经脱羧形成的丙酮酸则进一步形成乙醛-焦磷酸硫胺素(乙醛-TPP),乙醛-TPP经α-乙酰乳酸合成酶催化生成的α-乙酰乳酸在O2存在条件下不稳定,经过非酶氧化脱羧反应形成2,3-丁二酮[23-24]。在乳酸菌等微生物的柠檬酸代谢途径中(图3),乳糖、半乳糖和葡萄糖等经一系列生化反应生成丙酮酸,丙酮酸经一系列酶促反应和非酶氧化脱羧反应形成 2,3-丁二酮[23,25]。生成的 2,3-丁二酮不稳定,可继续反应生成乙偶姻和2,3-丁二醇[23]。

图3 乳酸菌中2,3-丁二酮的代谢途径Fig.3 Pathways for 2,3-butanedione metabolism in lactic acid bacteria
1.5 核黄素光敏氧化
Jung等证实,食品中核黄素(即VB2)经光敏氧化也能够形成2,3-丁二酮,其可能途径见图4[26]。核黄素是一种水溶性维生素,广泛存在于牛乳、鸡蛋、肉类、蔬菜等食物中。游离核黄素对光很敏感,与单线态氧的反应速率为1.01×1010(M·s)-1。光照尤其是紫外线照射下,核黄素极易发生不可逆分解,造成食品中核黄素含量的快速降低[27]。核黄素(溶解于0.1 mol/L、pH 6.5的磷酸缓冲液)经3 000 lx的强光照射3 h即可生成2,3-丁二酮,且2,3-丁二酮生成量随光照时间延长而升高[26]。叠氮化钠是单线态氧的淬灭剂,可有效抑制光照诱导的2,3-丁二酮生成[26]。
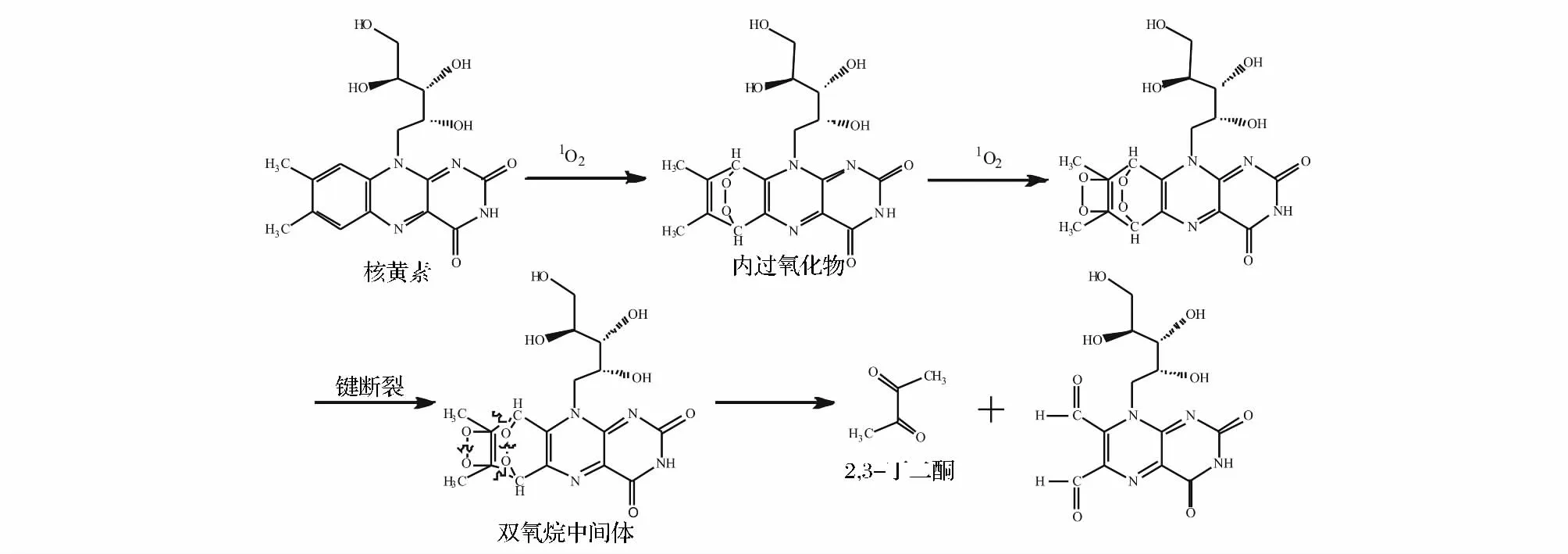
图4 核黄素与单线态氧反应生成2,3-丁二酮的可能反应途径Fig.4 Proposed mechanism for the formation of 2,3-butanedione from riboflavin and singlet oxygen
2 食品中2,3-丁二酮检测方法
鉴于2,3-丁二酮的潜在安全性问题,食品中2,3-丁二酮检测方法的建立是其安全性评价的基础[28-29]。目前,食品中2,3-丁二酮的检测方法主要包括紫外分光光度法、荧光分析法、气相色谱法(GC)、高效液相色谱法(HPLC)、生物传感器法、极谱法以及化学发光法等。
2.1 紫外分光光度法
由于2,3-丁二酮结构中不含发色团,紫外分光光度法检测时一般需先进行显色反应,常用的显色剂主要包括肌氨酸和邻苯二胺。肌氨酸比色法的原理是:在β-萘酚存在的碱性条件下,2,3-丁二酮与肌氨酸的胍基基团发生反应并形成粉色产物,可通过显色40 min 后测定 525 nm 吸光度进行定量分析[22,30]。采用该方法测定2,3-丁二酮时需注意排除乙偶姻干扰,这是因为在分析测定过程中乙酰乳酸能够通过氧化脱羧反应生成2,3-丁二酮,并且2,3-丁二酮与其代谢产物乙偶姻在522 nm处的吸光度类似[30]。一些学者通过2,3-丁二酮与乙偶姻形成粉色产物的速率不同而分别于显色1 min和60 min测定2,3-丁二酮和乙偶姻的浓度。但1 min后,乙偶姻仍能部分参与粉色产物的形成,导致2,3-丁二酮的测定结果偏高[23]。
《GB/T 4928-2008啤酒分析方法》采用测邻苯二胺比色法(EBC法)测定啤酒中2,3-丁二酮含量,其原理为2,3-丁二酮等α-二羰基化合物能够与邻苯二胺反应生成2,3-二羟基喹喔啉等喹喔啉类衍生物,该类物质在335 nm下有最大紫外吸收峰,可以用比色分析法进行测定(图5)。与肌氨酸比色法类似,由于其他联二酮化合物具有相同的反应活性且在蒸馏过程中形成新的联二酮化合物,该方法的灵敏性较低,测定结果为样品中总联二酮含量[31]。

图5 2,3-丁二酮与邻苯二胺反应生成喹喔啉类物质的途径Fig.5 Formation pathwy of quinoxaline derivative from reaction between 2,3-butanedione and 2,3-phenylenediamine
2.2 荧光分光光度法
荧光比色法也常用于2,3-丁二酮的测定[32-34]。基于邻苯二胺与2,3-丁二酮形成的化合物具有荧光特性,陈淑珠等建立了测定酒类中2,3-丁二酮的荧光检测方法,该方法的检测范围为5~360 μg/L,检测限为3.2 μg/L[34]。荧光比色法灵敏度接近气相色谱(GC),但其检测结果与火焰离子化检测气相色谱法(GC-FID)测定结果存在一定偏差[33]。
2.3 液相色谱法和气相色谱法
高效液相色谱法(HPLC)和气相色谱法(GC)具有高效、快速、准确性好、灵敏度高、重现性好、检测限低、定量准确等特点,广泛应用于食品中2,3-丁二酮的检测分析。由于2,3-丁二酮分子量较小且无发色团,色谱检测时一般需进行化学衍生。HPLC检测2,3-丁二酮常用的衍生剂包括邻苯二胺[35]和4-硝基邻苯二胺[36],一般采用紫外检测器[35-36]、二极管阵列检测器[37]和质谱检测器[38]。Li等采用 4-硝基邻苯二胺柱前衍生和Kromasil反相C18色谱柱(250 mm×4.6 mm,5μm)检测啤酒中的2,3-丁二酮,紫外检测波长为257 nm。该方法的检测范围和检测限分别为0.005 0 ~ 10.0 mg/L 和 0.000 8 mg/L[36]。2,3-丁二酮的气相色谱检测方法主要包括火焰离子化检测气相色谱法(GC-FID)[39]、顶空气相色谱法(HSGC)[40]和固相微萃取-气相色谱/质谱法(SPME-GCMS)[41]等。Chen等建立了基于 SPME-GC-MS的奶油样品中2,3-丁二酮的检测方法。样品经聚二甲基硅氧烷/二乙烯基苯(PDMS-DVB)固相微萃取纤维头于37℃萃取5 min后,采用SPB-1 SULFUR色谱柱(60 m ×0.25 mm I.D,3.0 μm)进行分离,电子轰击电离源(EI)MS检测。该方法的检测范围为0.024~11.2 mg/kg,检测限为 0.007 8 mg/kg[41]。
2.4 生物传感器法
张介驰等利用双乙酰还原酶(diacetyl reductase,DR)和还原型辅酶I(NADH)共固定作为工作酶膜,用Fe2+/Fe和 2,3-丁二酮还原过程中产生的NAD+/NADH构建2,3-丁二酮检测生物传感器[42]。该方法的原理为:在2,3-丁二酮被DR还原的同时,NADH被氧化成NAD+。在双乙酰还原酶量足够大的情况下,NAD+生成速度和生成量与底物2,3-丁二酮浓度成正比,通过电流信号而检测2,3-丁二酮浓度。该方法可准确检测0.1~0.5 mg/L内的2,3-丁二酮含量[42]。
2.5 极谱法
极谱法检测2,3-丁二酮是基于α-二羰基化合物与邻苯二胺反应并生成的喹喔啉类化合物。喹喔啉是极谱分析中的显色化合物,适用于极谱分析法[43-44]。Esteve等建立了 2,3-丁二酮的极谱检测方法,该方法的线性范围为0~960 mg/L,对果汁、奶油和酸奶样品的检测线为 0.2 ~0.4 μg/L[45]。该方法同时结合了邻苯二胺衍生反应的选择性和极谱技术的专一性,且不需要对样品进行复杂的前处理。
2.6 化学发光法
Kele等建立了基于2种水溶性钌复合物(RuPD和RuPP)的2,3-丁二酮化学发光法检测法。该方法的原理是2,3-丁二酮能够与钌复合物的二胺结构发生反应并导致几乎没有发光特性的钌复合物的发光强度增强31倍[46]。该方法的检测限能够达到微摩尔级,并可用于细胞培养基中2,3-丁二酮的检测。
3 展望
除作为香味物质广泛应用于食品加工,2,3-丁二酮还广泛应用于医药、农药和精细化学品合成等领域。食品中2,3-丁二酮除来自人为添加以外,在加工过程中,脂质、糖类、维生素等食品组分能够通过过氧化、氧化分解、美拉德反应、光敏氧化等多种途径形成2,3-丁二酮。虽然2,3-丁二酮被美国FDA列为GRAS级,但其安全性引起了各方面的广泛关注。目前,国内涉及2,3-丁二酮安全性的研究报道比较少,相关研究有待加强。在今后的研究中,首先要开展不同食品中2,3-丁二酮含量数据的收集工作,同时结合我国居民各类食物消费量,对食品来源的2,3-丁二酮摄入状况进行风险评估。其次,应进行食品中氨基酸、脂肪和糖类等成分的组成和含量影响2,3-丁二酮生成方面的相关研究,并深入揭示不同食品组分形成2,3-丁二酮的化学反应途径。此外,还应研究不同加工方式和工艺参数条件对食品加工过程中2,3-丁二酮生成的影响,并通过改善加工工艺等方式降低2,3-丁二酮的生成,以期保护消费者健康。
[1] Krogerus K,Gibson B R.125th Anniversary review:diacetyl and its control during brewery fermentation [J].Journal of the Institute of Brewing,2013,119(3):86-97.
[2] 练敏,纪晓俊,黄和,等.香料2,3-丁二酮的合成现状及展望[J].现代化工,2008,28(8):29-34.
[3] Food and Drug Administration.CFR-Code of Federal Regulations Title 21[EB/OL].http://www.accessdata.fda.gov/scripts/cdrh/cfdocs/cfcfr/CFRSearch.cfm?fr=184.1101,2013-04-01/2014-06-10.
[4] Shibamoto T.Diacetyl:occurrence,analysis,and toxicity[J].Journal of Agricultural and Food Chemistry,2014,62(18):4 048-4 053.
[5] Kanwal R,Kullman G,Fedan K B,et al.Occupational lung disease risk and exposure to butter-flavoring chemicals after implementation of controls at amicrowave popcorn plant[J].Public Health Reports,2011,126(4):480-494.
[6] White K L,Heikkila K,Williams R,et al.Diacetyl exposures at four microwave popcorn plants[J].Journal of Occupational and Environmental Hygiene,2010,7(4):185-193.
[7] Shibamoto T.Analytical methods for trace levels of reactive carbonyl compounds formed in lipid peroxidation systems[J].Journal of Pharmaceutical and Biomedical Analysis,2006,41(1):12-25.
[8] Scanlan R A,Lindsay R C,Libbey L M,et al.Heat induced volatile compounds in milk[J].Journal of Dairy Science,1968,51(7):1 001-1 007.
[9] JIANG Y,Hengel M,PAN C,et al.Determination of toxic α-dicarbonyl compounds,glyoxal,methylglyoxal,and diacetyl,released to the headspace of lipid commodities upon heat treatment[J].Journal of Agricultural and Food Chemistry,2013,61(5):1 067-1 071.
[10] JANG H W,JIANG Y,Hengel M,Shibamoto T.Formation of 4(5)-methylimidazole and its precursors,α-dicarbonyl compounds,in Maillard model systems [J].Journal of Agricultural and Food Chemistry,2013,61(28):6 865-6 872.
[11] Yaylayan V A,Keyhani A.Origin of 2,3-pentanedione and 2,3-butanedione in D-glucose/L-alanine Maillard model systems[J].Journal of Agricultural and Food Chemistry,1999,47(8):3 280-3 284.
[12] Martin S I F S,Jongen W M F,Boekel M A J S.A review of Maillard reaction in food and implications to kinetic modeling[J].Trends in Food Science & Technology,2000,11(9/10):364-373.
[13] Suomaleinen H,Ronkainen P.Mechanism of diacetyl formation in yeast fermentation[J].Nature,1968,220(5 169):792-793.
[14] Bartowsky E J,Henschke P A.The‘buttery'attribute of wine-diacetyl-desirability,spoilage and beyond[J].International Journal of Food Microbiology,2004,96(3):235-252.
[15] Arora A,Singh S.Diacetyl production by Bacillus pumilus as compared to Lactococcus lactis DRC1 and Enterobacter cloacae [J].Indian Journal of Microbiology,2001,41(3):229-230.
[16] Gupta K G,Yadav N K,Dhawan S.Laboratory-scale production of acetoin plus diacetyl by Enterobacter cloacae ATCC 27613 [J].Biotechnology and Bioengineering,1978,20(12):1 895-1 901.
[17] ZHAO L,BAO Y M,WANG J Y,et al.Optimization and mechanism of diacetyl accumulation by Enterobacter aerogenes mutant UV-3 [J].World Journal of Microbiology and Biotechnology,2009,25(1):57-64.
[18] Levata-Jovanovic M,Sandine W E.Citrate utilization and diacetyl production by various strains of Leuconostoc mesenteroides ssp.cremoris[J].Journal of Dairy Science,1996,79(11):1 928-1 935.
[19] Krogerus K,Gibson BR.Influence of valine and other amino acids on total diacetyl and 2,3-pentanedione levels during fermentation of brewer's wort[J].Applied Microbiology and Biotechnology,2013,97(15):6 919-6 930.
[20] 高翔,徐楠,李树波,等.光滑球拟酵母生产2,3-丁二酮的系统代谢工程策略[J].微生物学报,2014,54(4):398-407.
[21] 李妍,邢慧敏,邵亚东,等.发酵乳中丁二酮和乙醛含量检测方法探讨[J].食品与发酵工业,2008,34(3):157-159.
[22] Zalán Z,Hudácek J,Tóth-Markus M,et al.Sensorically and antimicrobially active metabolite production of Lactobacillus strains on Jerusalem artichoke juice[J].Journal of the Science of Food and Agriculture,2011,91(4):672-679.
[23] Bartowsky E J,Henschke P A.The‘buttery'attribute of wine-diacetyl-desirability,spoilage and beyond [J].International Journal of Food Microbiology,2004,96(3):235-252.
[24] 郑应福,阚振荣,赵春海.高产双乙酰乳球菌的研究进展[J].中国生物工程杂志,2005,(S):186-189.
[25] Gasson M J,Benson K,Swindell S,et al.Metabolic engineering of the Lactococcus lactis diacetyl pathway[J].Lait,1996,76(1/2):33-40.
[26] Jung M Y,Oh Y S,Kim D K,et al.Photoinduced generation of 2,3-butanedione from riboflavin[J].Journal of Agricultural and Food Chemistry,2007,55(1):170-174.
[27] Huang R,Choe E,Min D B.Kinetics for singlet oxygen formation by riboflavin photosensitization and the reaction between riboflavin and singlet oxygen [J].Journal of Food Science,2004,69(9):C726-C732.
[28] Otsuka M,Ohmori S.Simple and sensitive determination of diacetyl and acetoin in biological samples and alcoholic drinks by gas chromatography with electron-capture detection[J].Journal of Chromatography B:Biomedical Sciences and Applications,1992,577(2):215-220.
[29] Fujioka K,Shibamoto T.Determination of toxic carbonyl compounds in cigarette smoke[J].Environmental Toxicology,2006,21(1):47-54.
[30] Dulieu C,Poncelet D.Spectrophotometric assay of α-acetolactate decarboxylase[J].Enzyme and Microbial Technology,1999,25(6):537-542.
[31] GB/T 4928-2008.啤酒分析方法[S].
[32] Voulgaropoulos A,Soilis T,Andricopoulos N.Fluorimetric determination of diacetyl in wines after condensation with 3,4-diaminoanisole[J].American Journal of Enology and Viticulture,1991,42:73-75.
[33] GuerraHernández EJ,Estepa RG,Rivas IR.Analysis of diacetyl in yogurt by two new spectrophotometric and fluorometric methods[J].Food Chemistry,1995,53(3):315-319.
[34] 陈淑珠,李世江.荧光法测定酒类中的双乙酰[J].青岛海洋大学学报,2002,32(1):89-93.
[35] Ramos R M,Pacheco J G,Goncalves L M,et al.Determination of free and total diacetyl in wine by HPLC-UV using gas-diffusion microextraction and pre-column derivatization [J].Food Control,2012,24(1/2):220-224.
[36] LI P L,ZHU Y C,HE S,et al.Development and validation of a high-performance liquid chromatography method for the determination of diacetyl in beer using 4-nitro-ophenylenediamine as the derivatization reagent[J].Journal of Agricultural and Food Chemistry,2012,60(12):3 013-3019.
[37] Daglia M,Papetti A,Aceti C,et al.Isolation and determination of α-dicarbonyl compounds by RP-HPLC-DAD in green and roasted coffee[J].Journal of Agricultural and Food Chemistry,2007,55(22):8 877-8 882.
[38] Blanco-Vega D,Lopez-Bellido FJ,Alia-Robledo JM,et al.HPLC-DAD-ESI-MS/MS characterization of pyranoanthocyanins pigments formed in model wine[J].Journal of Agricultural and Food Chemistry,2011,59(17):9 523-9 531.
[39] Macciola V,Candela G,De Leonardis A.Rapid gaschromatographic method for the determination of diacetyl in milk,fermented milk and butter[J].Food Control,2008,19(9):873-878.
[40] Tian J Y.Determination of several flavours in beer with headspace sampling-gaschromatography [J].Food Chemistry,2010,123(4):1 318-1 321.
[41] Chen Y,Shirey R E,Sidisky L M.Determination of diacetyl in butter and air samples by SPME coupled with GC-MS[J].Chromatographia,2010,72(9-10):999-1004.
[42] 张介驰,于德水,沙长青,等.双乙酰生物传感器的研究[J].生物工程学报,1999,15(3):327-331.
[43] Rodrigues J A,Barros A A,Cruz J M M,et al.Determination of diacetyl in beer using differential-pulse polarography[J].Journal of the Institute of Brewing,1997,103(5):311-314.
[44] Rodrigues J A,Barros A A,Rodrigues P G.Differential pulse polarographic determination of α-dicarbonyl compounds in foodstuffs after derivatization with o-phenylenediamine[J].Journal of Agricultural and Food Chemistry,1999,47(8):3 219-3 222.
[45] Esteve M J,Frígola A,Rodrigo M C,et al.Use of polarography as a quality-control method for determining diacetyl in citrus and vegetable juices,yoghurt and butter[J].Food Additives and Contaminants,2002,19(6):519-523.
[46] Kele P,LI X H,Duerkop A.New luminescent ruthenium probes for detection of diacetyl[J].Microchemical Journal,2013,108:156-160.
