D-阿洛酮糖3-差向异构酶基因在枯草芽孢杆菌中的表达
2014-12-25沐万孟
贾 敏, 沐万孟, 张 涛, 江 波*
(1.食品科学与技术国家重点实验室,江南大学,江苏 无锡 214122;2.江南大学 食品学院,江苏 无锡 214122)
D-阿洛酮糖是稀有糖的一种,是D-果糖C-3位的差向异构体。D-阿洛酮糖不仅是一种无热量的甜味剂[1],而且可作为其他稀有糖生产的重要原料[2]。D-阿洛酮糖具有多种独特的营养学和生理学功能,受到越来越多研究者的注意。D-阿洛酮糖零能量,可预防肥胖[3];能降低血糖[4],可作为II型糖尿病人的辅助治疗剂、膳食补充剂和甜味剂;可降低血脂,减少脂肪合成酶活性,抑制腹腔内脂肪堆积[5];有抗氧化活性,具有较强的活性氧(ROS)清除功能[6];具有神经保护作用[7]。鉴于D-阿洛酮糖良好的理化性质,美国食品及药品管理局于2011年对D-阿洛酮糖的安全性进行确认,并正式批准其为GRAS(一般认为安全,Generally Recognized as Safe)食品,允许应用于食品,膳食补充剂和医药制剂中,具有巨大的市场前景[8]。
D-阿洛酮糖在自然界中存在极少,利用化学方法合成D-阿洛酮糖杂质多且不易分离。利用D-阿洛酮糖 3-差向异构酶 (D-psicose 3-epimerase,DPE,EC 5.3.1.-),通过催化D-果糖C3位的差向异构化获得D-阿洛酮糖。作者所在实验室已成功构建大肠杆菌工程菌株BL21(DE3)/pET22b-cbdte表达DPE酶[9]。但由于大肠杆菌宿主安全性的问题,使其所表达的DPE重组蛋白不适宜应用于D-阿洛酮糖的工业化生产中。而枯草芽孢杆菌是食品级微生物,属于GRAS级微生物,不存在内毒素等食品安全问题,被广泛应用于各种工业酶制剂中[10-11]。
本研究旨在利用食品级微生物枯草芽孢杆菌作为宿主菌,构建DPE酶枯草芽孢杆基因工程菌,实现DPE酶在枯草芽孢杆菌中的表达,为D-阿洛酮糖的工业化生物酶法生产奠定理论基础。
1 材料与方法
1.1 实验仪器与试剂
Authorized Thermal Cycler PCR仪:购自德国Eppendorf;垂直板蛋白电泳系统:购自PowerPac Universal;凝胶成像系统Gel DocXR:购自美国Bio-Rad公司;高效液相色谱仪Agilent 1260:购自美国Agilent公司;紫外可见分光光度计UV2102PC:购自上海尤尼柯仪器有限公司;全自动高压灭菌锅CL-40M:购自日本ALP公司;超净工作台SW-CJIFD:购自苏净安泰空气技术有限公司;高速冷冻离心机Centrifuge 5804R:购自德国Eppendorf公司。
Premix TaqDNA聚合酶、限制性内切酶、T4 DNA连接酶:购自TaKaRa公司;质粒DNA提取试剂盒及DNA胶回收试剂盒:购自上海生工生物工程有限公司;D-阿洛酮糖标准品:购自Sigma公司;其他常规试剂:进口分装或国产分析纯;引物合成及DNA测序:由上海生工生物工程有限公司完成。质 粒 pET22b-cbdpe, 质 粒 pMA5, 宿 主 菌Escherichia coli DH5α和宿主菌 Bacillus subtilis WB800:由作者所在实验室保藏。
1.2 培养基制备
种子(LB)培养基(组分 g/L):胰蛋白胨 10.0,酵母提取物 5.0,NaCl 10.0;pH 7.0。
发酵培养基(组分g/L):酵母抽提物 15.0,葡萄糖 5.0,NaCl 8.0,MgSO4·7H2O 1.0,Na2HPO4·12H2O 1.0;自然pH。灭菌后加入抗生素。
1.3 DPE基因的克隆
以大肠杆菌质粒pET22b-cbdpe为模板,通过PCR的方法进行DPE基因扩增。为便于分离纯化,设计引物时将pET22b质粒上带有的His-tag标签引入目的基因中,并在该基因的两端分别引入两个酶切位点,Nde I和BamH I,设计一对引物如下:
PMA1:5'-CGCCATATGAAATATGGTATTTATT TTGCT-3'
PMA2:5'-CGCGGATCCTTGTTAGCCGGATCTC-3'
PCR反应程序如下:94℃预变性10 min,94℃变性 1 min,56℃退火 1 min,72℃延伸 1 min,35个循环,72℃延伸10 min,4℃保存。PCR产物经1.0 g/dL琼脂糖凝胶回收预期大小的片段。与pMD-T-19载体连接,转化大肠杆菌DH5α感受态细胞,涂布在含有氨苄青霉素(100 μg/mL)的LB平板上,挑取阳性克隆,提取质粒进行测序,得到pMD19-T-cbdpe。
1.4 枯草芽孢杆菌重组表达质粒的构建
将获得的pMD19-T-cbdpe和pMA5质粒,用Nde I和BamH I进行双酶切,回收基因片段,经T4连接酶连接过夜后转化入大肠杆菌DH5α感受态细胞,涂布含有氨苄霉素(100 μg/mL)的LB平板,37℃过夜培养。挑取阳性克隆,提取质粒,进行测序验证。并利用Nde I和BamH I进行双酶切验证。
1.5 枯草芽孢杆菌重组菌的构建及筛选
制作Bacillus subtilis WB800感受态细胞[12]转化重组质粒pMA5-cbdpe,将转化子涂布卡那霉素(50 μg/mL)的LB平板,37℃培养 24 h,挑取单菌落至液体培养基,进行发酵培养,测定菌体酶活,并进行SDS-PAGE分析。
1.6 DPE酶活力测定
将获得的枯草芽孢杆菌重组菌接入发酵培养基进行摇瓶发酵培养,测定生长曲线和酶活曲线。酶活力测定方法参照文献[13]。酶活力单位定义为:1 mL发酵液在55℃和pH 7.0条件下,单位时间(1 min)内产生1 μmol的D-阿洛酮糖为一个酶活力单位,以U/mL表示。D-阿洛酮糖采用HPLC检测,液相柱:Sugar-Pak I钙型离子交换柱;柱温:85℃;流动相:0.1mmol/L EDTA-Ca水溶液 (0.22 μm 膜过滤);洗脱流速:0.4 mL/min;进样量:10 μL;检测器:Shodex示差折光检测器。
1.7 DPE酶的分离纯化
收集对数中后期的发酵液,10 000 r/min离心5 min,弃上清液,取菌体用50 mmol/L磷酸缓冲液(pH 7.0)溶解,重悬菌体,进行超声破碎。工作条件为:工作时间1 s,停止时间2 s,共计12 min。将破碎菌体进行低温高速离心 (4℃、12 000 r/min离心15 min)。收集上清液即为粗酶液。用微孔滤膜(0.22 μm)过滤,备用。
先用上样缓冲液(50 mmol/L Na2HPO4,50 mmol/L NaH2PO4,500 mmol/L NaCl,pH 7.4) 平 衡Ni2+-Chelating Sepharose Fast Flow亲和层析柱。将5 mL的粗酶液加到层析柱上,用低咪唑洗脱液(50 mmol/L Na2HPO4,50 mmol/L NaH2PO4,500 mmol/L NaCl,50 mmol/L 咪唑,pH 7.4)洗脱杂蛋白质,后利用高咪唑洗脱液 (50 mmol/L Na2HPO4,50 mmol/L NaH2PO4,500 mmol/L NaCl,500 mmol/L 咪 唑 ,pH 7.4)洗脱目的蛋白质。收集目的蛋白质放入透析袋中,利用平衡液透析过夜。
1.8 DPE酶蛋白浓度测定
采用Lowry法[14]测定蛋白质含量,以牛血清蛋白(BSA)为标准蛋白质,做标准曲线。将样品稀释至一定浓度,根据标准曲线算出蛋白质浓度。
2 结果与分析
2.1 DPE基因克隆
以大肠杆菌重组质粒pET22b-cbdpe为模板,PCR扩增得到约900 bp的DPE基因,见图1。获得的pMD19-T-cbdpe经测序验证,Clostridium bolteae ATCC BAA-613 DPE基因进行比对发现,目的基因得到正确扩增。

图1 PCR产物凝胶电泳Fig.1 Agarose gel electrophoresis of PCR product
2.2 重组表达载体的构建与鉴定
将pMD19-T-cbdpe和pMA5质粒,用Nde I和BamH I进行双酶切,用T4连接酶进行连接,构建重组质粒pMA5-cbdpe,其构建过程见图2。

图2 pMA5-cbdpe重组质粒构建过程Fig.2 Restructuring process of pMA5-cbdpe plasmid
对重组质粒进行Nde I和BamH I双酶切验证,琼脂糖凝胶电泳在约900 bp及7 000 bp处出现条带,与目的基因及pMA5的片段大小一致,初步确定获得pMA5-cbdpe的阳性克隆,见图3。

图3 重组质粒pMA5-cbdpe的双酶切验证Fig. 3 Restriction enzyme digestion analysis of recombinant plasmid pMA5-cbdpe
经基因组测序,并与NCBI中Clostridium bolteae ATCC BAA-613 DPE基因序列进行比对,结果表明成功构建了重组载体pMA5-cbdpe。将重组载体转化入B.subtilis WB800,经卡那霉素(50 μg/mL)LB平板筛选后,挑取阳性克隆子,发酵培养,进行菌液PCR鉴定,获得一株包含DPE基因的枯草芽孢杆菌重组菌,见图4。
图4 重组枯草芽孢杆菌PCR鉴定Fig.4 PCR identification of recombinant B.subtilis
2.3 枯草芽孢杆菌重组菌的表达及活性鉴定
枯草芽孢杆菌重组菌经发酵培养,取菌体进行SDS-PAGE电泳验证显示,在34 000左右出现明显表达蛋白质,见图5。这与大肠杆菌表达DPE相对分子质量一致,表明该枯草芽孢杆菌可实现DPE的表达,经离心沉淀后即可获得菌体。干燥后即可制得粗酶粉,用于D-阿洛酮糖的生产,避免理化操作可能对酶性质产生的影响。
利用枯草芽孢杆菌模式菌株B.subtilis 168,进行DPE酶表达时,PCR鉴定重组菌中包含DPE基因后,发酵培养发现重组菌没有酶活 (结果未显示);而利用敲除八种蛋白酶的宿主菌B.subtilis WB800作为宿主菌[15],则可在菌体中检测到酶活。可能是由于宿主菌的蛋白酶可降解所表达的DPE重组蛋白,导致利用B.subtilis 168表达DPE酶不能检测到酶活。

图5 SDS-PAGE图Fig.5 SDS-PAGE profiles
为检测重组菌产DPE酶的酶活情况,将不同发酵时间的发酵液与D-果糖溶液在合适条件下进行反应,测定不同时间发酵液DPE酶活及菌体生长状况,见图6。在对数中后期,发酵16~24 h时,酶活达到最高,为6.8 U/mL,高于大肠杆菌IPTG诱导表达的酶活(约3.5 U/mL)[16]。表明该菌株可表达相对较高活性的DPE酶。
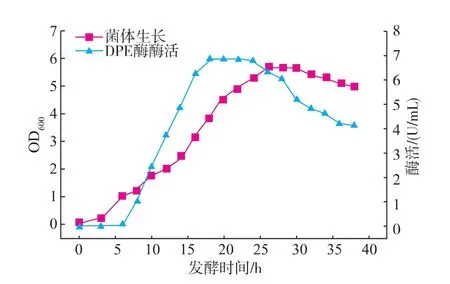
图6 重组枯草芽孢杆菌发酵曲线Fig.6 Curve of enzyme activity of recombinant B.subtilis
对于DPE酶的工业化生产,大肠杆菌表达的DPE酶在工业化发酵中,需要额外添加诱导剂,并且需保持较低的诱导温度以减少包涵体的大量产生;而枯草芽孢杆菌表达DPE酶发酵过程简单,无需降温,减少能耗,并且无包涵体产生,单位发酵液酶活较高。真核表达系统如毕赤酵母等,一般需要较长发酵时间才能达到较高酶活;而枯草芽孢杆菌16~24 h即可达到较高酶活水平,发酵时间短,节约能耗。
2.4 重组DPE酶的分离纯化
Clostridium bolteae DPE酶菌体经超声破碎,离心后得到粗酶液,由于引入6个组氨酸标签,通过Ni2+柱亲和层析,将目的蛋白质与杂蛋白质分离,经SDS-PAGE电泳检测,见图7。在34 000处得到目的蛋白,其相对分子质量大小与预测符合,进一步证明DPE基因在枯草芽孢杆菌宿主中得到正确表达。

图7 分离纯化后的重组蛋白SDS-PAGE电泳图Fig.7 SDS-PAGE profile of the purified recombinant protein
2.5 重组DPE酶的酶学性质
2.5.1 pH对DPE酶活力的影响 在55℃、pH 5.0~9.0的缓冲溶液中分别测定DPE酶活力,重复3次,取平均酶活力,见图8。该DPE酶的最适pH为7.0,与大肠杆菌表达的DPE酶一致[17]。其酶活力>90%的pH范围有所扩大,为6.0~7.5。
2.5.2 pH对DPE酶稳定性的影响 将纯化后的DPE酶在pH 5.0~9.0的缓冲液反应体系中,4℃保存2 h,然后测定残余酶活,以原始酶活为最高酶活100%,见图9。在pH 5.0~8.5的范围内,DPE酶相对稳定,残余酶活均在80%以上。
2.5.3 温度对DPE酶活力的影响 在pH 7.0条件下,测定40~80℃下的酶活力,结果见图10。重组DPE酶在55℃下酶活力达到最高。在45~65℃其相对酶活仍可维持在80%以上。

图8 pH值对酶活力的影响Fig.8 Effects of pH on DPE enzyme activity

图9 pH值对酶稳定性的影响Fig.9 Effects of pH on DPE stability

图10 温度对酶活力的影响Fig.10 Effects of temperature on DPE enzyme activity
2.5.4 温度对DPE酶稳定性的影响 将酶液在不同温度下保温不同的时间,测定DPE酶的残余酶活,结果见图11。枯草芽孢杆菌表达的DPE酶的热稳定性比大肠杆菌表达的DPE酶的热稳定性略有提高。其55℃的半衰期由42 min增加到45 min[17]。

图11 温度对DPE酶稳定性的影响Fig.11 Effects of temperature on DPE stability
2.5.5 金属离子对DPE酶活力的影响 不同金属离子对酶的催化效果有不同的影响,见图12。在酶反应体系中加入不同的金属离子,DPE酶的稳定性及催化活力会有所不同。DPE酶是一种金属蛋白酶,在金属螯合剂EDTA的存在下,DPE酶彻底失活。Co2+和Mn2+离子可提高DPE酶的活性,尤其是Co2+离子。 Zn2+、Mg2+、Cu2+、Ca2+对其酶活有明显抑制作用,这与大肠杆菌表达的重组DPE酶酶学性质一致[17]。
3 结语
D-阿洛酮糖3-差向异构酶可在食品级微生物枯草芽孢杆菌中的表达,利用PCR扩增D-阿洛酮糖3-差向异构酶基因与枯草芽孢杆菌载体pMA5连接,构建重组质粒pMA5-cbdpe。重组质粒转入枯草芽孢杆菌Bacillus subtilis WB800感受态细胞,利用卡那霉素筛选和PCR鉴定,获得一株D-阿洛酮糖3-差向异构酶重组枯草芽孢杆菌菌株。该重组菌株无需诱导即可产生D-阿洛酮糖3-差向异构酶,18 h时酶活即可达到6.8 U/mL。同时,对枯草芽孢杆菌表达的重组DPE酶的酶学性质进行测定,发现其酶学性质与大肠杆菌来源的DPE酶相似。

图12 不同金属离子对重组DPE酶活影响Fig.12 Effect of different metallic ions on the DPE activity
利用枯草芽孢杆菌作为宿主菌进行D-阿洛酮糖 3-差向异构酶生产,无内毒素产生,无需添加诱导剂,发酵简单,发酵时间短,能耗低,适用于D-阿洛酮糖的工业化生产。此外,本研究也可为提高我国酶制剂行业在食品及其他相关领域发展的研究提供参考,具有重要的现实意义。
[1]Matsuo T,Suzuki H,Hashiguchi M,et al.D-psicose is a rare sugar that provides no energy to growing rats[J].Journal of Nutrition Science Vitaminol,2002,48:77-80.
[2]Izumori K.Izumoring:a strategy for bioproduction of all hexoses[J].Journal of Biotechnology,2006,124(4):717-722.
[3]Iida T,Hayashi N,Yamada T,et al.Failure of d-psicose absorbed in the small intestine to metabolize into energy and its low large intestinal fermentability in humans[J].Metabolism,2010,59(2):206-214.
[4]N Hayashi,T Iida,T Yamada,et al.Study on the postprandial blood glucose suppression effect of D-psicose in borderline diabetes and the safety of long-term ingestion by normal human subjects[J].Bioscience,Biotechnology,Biochemistry,2010,74:510-519.
[5]Matsuo T,Izumori K.D-Psicose inhibits intestinal α -glucosidase and suppresses the glycemic response after ingestion of carbohydrates in rats[J].Journal of Clinical Biochemistry and Nutrition,2009,45(2):202-206.
[6]Murata A,Sekiya K,Watanabe Y,et al.A novel inhibitory effect of D-allose on production of reactive oxygen species from neutrophils[J].J Bioscience Bioengineering,2003,96:89-91.
[7]Takata M,Yamaguchi F,Nakanose K,et al.Neuroprotective effect of D-psicose on 6-hydroxydopamine-induced apoptosis in rat pheochromocytoma(PC12) cells[J].Journal of Bioscience Bioengineering,2005,100:511-516.
[8]Mu W,Zhang W,Feng Y,et al.Recent advances on applications and biotechnological production of D-psicose[J].Applied Microbiology and Biotechnology,2012,94(6):1461-1467.
[9]储菲菲,沐万孟,邢庆超,等.Clostridium bolteae ATCC BAA-613 D-塔格糖3-差向异构酶的诱导表达、纯化及活性研究[J].食品工业科技,2012,33(7):198-201.CHU Feifei,MU Wanmeng,XING qingchao,et al.Study on expression,purification and enzyme activity of Clostridium bolteae ATCC BAA-613 D-tagatose 3-epimerase[J].Science and Technology of Food Industry,2012,33(7):198-201.(in Chinese)
[10]Yang H,Liu L,Li J,et al.Heterologous expression,biochemical characterization,and overproduction of alkaline a-amylase from Bacillus alcalophilus in Bacillus subtilis[J].Microb Cell Fact,2011,10:77.
[11]李静静,徐美娟,张显,等.一种耐低温α-乙酰乳酸脱羧酶在枯草芽孢杆菌中的高效表达[J].食品与生物技术学报,2013,32(5):516-523.LI Jingjing,XU Meijuan,Zhang Xian,et al.High-level expression of cold-adapted α-acetolactate decarboxylase in Bacillus subtilis[J].Food Science and Biotechnology,2013,32(5):516-523.(in Chinese)
[12]Kunst F,Rapoport G.Salt stress is an environmental signal affecting degradative enzyme synthesis in Bacillus subtilis[J].Journal of Bacteriology,1995,177(9):2403-2407.
[13]Wanmeng Mu,Feifei Chu,Qiangchao Xing,et al.Cloning,expression,and characterization of a D-psicose 3-epimerase from Clostridium cellulolyticum H10[J].Journal of Agriculture and Food Chemistry,2011,59:7785-7792.
[14]Lowry O H,Rosenbrough N J,Farr A L,et al.Protein measurement with the folin phenol reagent[J].Journal of Biological Chemistry,1951,193:265-275.
[15]Wu S C,Yeung J C,Duan Y,et al.Functional production and characterization of a fibrin-specific single-chain antibody fragment from Bacillus subtilis:effects of molecular chaperones and a wall-bound protease on antibody fragment production[J].Applied and Environmental Microbiology,2002,68(7):3261-3269.
[16]贾敏,江波,张晓鸣,等.乳糖诱导D塔格糖3差向异构酶基因在大肠杆菌中的表达[J].食品工业科技,2013,34(13):143-146.JIA Min,JIANG Bo,ZHANG Xiaoming,et al.Expression of recombinant D-tagatose 3-epimerase in E.coli BL21/(DE3)induced by lactose[J].Science and Technology of Food Industry,2013,34(13):143-146.(in Chinese)
[17]Jia M,Mu W,Chu F,et al.A d-psicose 3-epimerase with neutral pH optimum from clostridium bolteae for d-psicose production:cloning,expression,purification,and characterization[J].Applied Microbiology and Biotechnology,2014,98(2):717-725.
