仿刺参新型免疫增强剂的应用
2014-12-24于晓清李天保王淑娴王勇强
樊 英,李 乐,于晓清,李天保,王淑娴,刁 菁,王勇强
(山东省海洋生物研究院病害与渔药研究中心,山东青岛266002)
近年来,随着我国北方仿刺参养殖业的大力发展以及南方海参越冬的开发,海参已成为最大的养殖品种之一[1].然而,随着海参养殖的规模化、集约化发展,海参病害的发生频率及程度越来越高,这些已受到研究者和养殖者的重视.自海参“腐皮综合症”发生以来,寻求绿色环保、无公害的免疫增强剂便成为预防海参疾病发生的研究热点.仿刺参属棘皮动物,非特异性免疫是抵御外来侵害的重要途径.免疫增强剂可通过提高机体的非特异性免疫来增强对外界病害的抵抗力,对机体本身是安全的.目前,在水产养殖中常用的免疫增强剂主要有细菌提取物、动植物提取物、化学合成物质和维生素等[2-5].黄芪多糖和枸杞多糖是多糖类免疫增强剂中研究较多且较深入的植物源免疫多糖,它们通过作用于机体的多靶点而促进非特异性免疫力的提高,同时能够增强肠道内菌群的变化而提高自身的免疫功能[6];黄柏等作为常用的抗菌中草药已被认可,具有抗病毒、抑制有害免疫反应的作用[7];菊粉和天蚕素等天然物质的免疫作用已被重视,研究表明,它们不但能从营养学方面增强机体的免疫功能,而且能够从免疫学方面提高抗病力[8-9].这些免疫增强剂对仿刺参的免疫作用尚未见报道.本试验采用植物提取物作为免疫增强剂,研究其对仿刺参免疫功能的影响,旨在为仿刺参免疫增强剂及配合饲料添加剂的研发提供参考.
1 材料与方法
1.1 材料
仿刺参购于山东青岛王哥庄某养殖场,初始体重为(30±2)g.PMSF、NBT和EGTA购于Sigma公司.
1.2 动物饲养与管理
正式试验前,仿刺参于实验室暂养7 d.饲喂量按仿刺参的摄食情况进行适当调整以达到饱食投喂,每天于9:00和15:00投喂,投喂前吸除残饵和粪便,同时补充新鲜海水.试验期间连续充气,水温控制在(14±0.5) ℃,盐度 32‰,pH 7.8-8.2,溶解氧含量 >5 mg·L-1.
1.3 试验设计与样品采集
暂养结束,仿刺参饥饿24 h后分苗称重.挑选个体均匀的健康仿刺参放到不同的试验桶中,随机分为7组,每组3个重复,每个重复6只仿刺参,试验期7 d.各免疫试验组仿刺参体腔分别注射500 μL 1.0 mg·mL-1黄柏提取物、苦参提取物、枸杞多糖提取物、黄芪多糖提取物、菊粉和天蚕素等6种免疫增强剂;对照组注射相同体积的无菌生理盐水.注射后第1、3和5天在每个桶中随机挑取3只仿刺参分别从其肛门处抽取体腔液进行免疫指标的测定.
1.4 指标测定
1.4.1 体腔细胞总数量(total coelomocytes counts,TCC)的测定 体腔液与抗凝剂(含0.02 mol·L-1EGTA、0.48 mol·L-1NaCl、0.019 mol·L-1KCl和 0.068 mol·L-1Tris-HCl,pH 7.6)按 1∶1 的体积比充分混合,电子显微镜下通过血球计数板进行体腔细胞计数.于5000 r·min-1、4℃离心8 min,弃上清液,沉淀物迅速用 4 ℃冰冻的等渗缓冲液(含 0.001 mol·L-1EGTA、0.53 mol·L-1NaCl和 0.01 mol·L-1Tris-HCl,pH 7.6)调整TCC达到2×106个·mL-1.取600 μL体腔细胞悬液用于体腔细胞产量的测定,其余样品用于酶活性的测定.
1.4.2 体腔细胞破碎物上清液(coelomic supernatant,CLS)的制备 体腔细胞样品于4℃加入0.1 mmol·L-1PMSF,用超声波(输出22 kHz、0 ℃)匀浆6 s,于10000 r·min-1、4 ℃离心8 min,所得CLS 用于免疫指标的测定.
1.4.3 呼吸爆发活性的测定 准确吸取200 μL体腔细胞悬液,加入等体积的2 mg·mL-1NBT(溶解在含 2%NaCl的 Tris-HCl中,pH 7.6),室温下避光反应1 h,于500 r·min-1离心5 min,弃上清液.用等渗缓冲液洗涤后加入200 μL甲醇,室温固定10 min,于800 r·min-1离心8 min,弃上清液.用50%甲醇洗涤3次,弃上清液于室温下晾干.干燥后加入240 μL 2 mol·L-1KOH和280 μL DMSO,充分溶解后测定630 nm波长处的光密度(D).
1.4.4 吞噬活性的测定 取100 μL抗凝体腔液放入96孔板中,贴壁30 min后弃上清液.加入100 μL 0.001 mol·L-1中性红溶液,室温下吞噬30 min,用生理盐水洗掉未被吞噬的中性红,加入100 μL细胞裂解液(冰醋酸与无水乙醇按1∶1的体积比配制),裂解20 min,测定540 nm波长处的D.以试验条件下每106个体腔细胞对应的D来表示吞噬活性.
1.4.5 酚氧化酶(phenol oxidase,PO)活性的测定 取 50 μL 制备的 CLS 样品和 50 μL 0.1 mg·mL-1胰蛋白酶放入96孔板中,充分混匀,室温下温育10 min,加入50 μL 3 mg·mL-1左旋多巴(L-DOPA),室温下温育10 min,测定495 nm波长处的D.以试验条件下每毫升样品每分钟D每增加0.001定义为一个PO活性单位,单位:U·mL-1.
1.4.6 超氧化物歧化酶(superoxide dismutase,SOD)和酸性磷酸酶(acid phosphatase,ACP)活性的测定CLS样品中的SOD和ACP活性采用试剂盒(南京建成公司)测定.每毫升样品在1 mL反应液中SOD抑制率达到50%时所对应的SOD活性为1个SOD活性单位,单位:U·mL-1;每毫升样品在30 min产生1 mg游离酚为1个CLS活性单位,单位:U·mL-1.
1.5 数据处理
采用SPSS 17.0软件对数据进行单因素方差分析,若差异显著,则用Duncan检验法进行多重比较,显著性水平为P<0.05.
2 结果与分析
从图1可以看出:注射后第1天,免疫试验组与对照组相比,枸杞多糖提取物对仿刺参的TCC无显著影响,其他免疫试验组的TCC均显著高于对照组(P<0.05);注射后第3天,黄柏提取物和菊粉组的TCC分别达到15×106和14×106个·mL-1,与对照组的差异显著(P<0.05);注射后第5天,各免疫试验组的TCC均出现不同程度的下降,且与对照组的差异不显著,以黄柏提取物和菊粉组的TCC最高.

图1 免疫增强剂对仿刺参TCC、呼吸爆发活性和吞噬活性的影响Fig.1 TCC,respiratory burst and phagocytosis activity of A.japonicus injected different diets
从图1可以看出:注射后第1天,只有苦参提取物对仿刺参的呼吸爆发活性产生显著影响(P<0.05),其他免疫试验组与对照组的差异不显著;注射后第3天,菊粉组的呼吸爆发活性与对照组的差异最显著(P<0.05),其次是黄柏提取物组(P<0.05);注射后第5天,各免疫试验组的呼吸爆发活性相当,但均与对照组的差异显著(P<0.05),呼吸爆发活性与时间不呈正比.
从图1可以看出:注射后第1天,只有苦参提取物对仿刺参的吞噬活性产生显著影响(P<0.05);注射后第3天,各免疫增强剂对吞噬活性产生的效果不同,菊粉和苦参提取物组与对照组的差异最显著(P<0.05),D540nm达0.4,其次是黄芪多糖提取物组;注射后第5天,黄芪多糖提取物和苦参提取物组吞噬活性的下降趋势缓慢,其他免疫试验组下降趋势明显.
从图2可以看出:枸杞多糖提取物和天蚕素组仿刺参的PO活性在注射后的第1天产生最大变化;黄柏提取物和菊粉组的PO活性则在注射后的第3天产生最大变化,且效果最显著(P<0.05);黄芪多糖提取物和苦参提取物组的PO活性在注射后的第5天产生最大变化,而其他免疫试验组的PO活性随着时间的延长发生下降趋势.
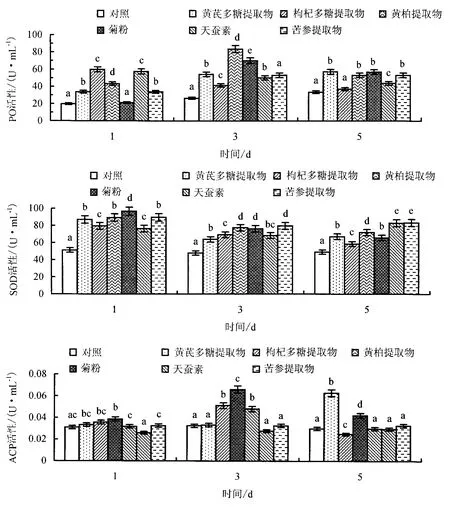
图2 免疫增强剂对仿刺参PO、SOD和ACP活性的影响Fig.2 PO,SOD and ACP activity of A.japonicus injected different diets
从图2可以看出:注射后第1天,免疫试验组仿刺参的SOD活性与对照组的差异显著(P<0.05),且达到最大值,其中以菊粉组的效果最显著,SOD活性为97 U·mL-1,而天蚕素组则在注射后的第5天达到最大值;试验期间各免疫试验组SOD活性的变化趋势平稳.
从图2可以看出:注射后第1天,各免疫试验组仿刺参的ACP活性与对照组相比无显著变化;注射后第3天,枸杞多糖提取物、黄柏提取物和菊粉组与对照组的差异显著,以黄柏提取物组的效果最显著,ACP活性达0.065 U·mL-1;注射后第5天,黄芪多糖提取物组的ACP活性骤然提高,达到0.062 U·mL-1,而其他免疫试验组的ACP活性呈下降趋势,与对照组的差异不显著(P>0.05).
3 讨论
3.1 免疫增强剂对仿刺参体腔细胞功能的影响
仿刺参的体腔细胞是抵御外来侵害的第一道防线和关键部分.体腔细胞可通过自我和非自我的识别、吞噬、包裹形成排除异物,体现吞噬功能的变化,直接参与免疫反应[10].经免疫增强剂激活后的体腔细胞可以产生很多活性氧杀菌物质,如H2O2和等,能够提高机体的抗病力[2,11-14].本试验结果表明,免疫增强剂能在不同程度上影响仿刺参的TCC,且激活体腔细胞的呼吸爆发活性和吞噬活性.黄柏提取物和菊粉显著刺激仿刺参体腔细胞繁殖分裂,TCC增加,从而提高仿刺参的免疫力;而苦参提取物对TCC未发生显著影响,其对仿刺参免疫力的改变与TCC无相关性,这与Zhao et al[15]的研究结果相似;苦参提取物显著提高仿刺参体腔细胞的吞噬活性,与对照组的差异显著,且随着时间的延长下降趋势缓慢,其次是菊粉和黄芪多糖提取物组,这可能与不同免疫增强剂的作用机制有关.
3.2 免疫增强剂对仿刺参体腔细胞免疫酶活性的影响
对缺乏特异性免疫的棘皮动物来说,PO系统在免疫防御中起着重要作用.Zhao et al[15]研究表明,2.50 g·kg-1β-葡聚糖对仿刺参体腔细胞PO活性的影响最显著,间接提高仿刺参的免疫力和抗病力;张琴等[3]研究表明,饲料中不添加VE时,刺参的PO活性随着硒酵母添加量的增加而上升,饲喂不同剂量的VE对PO活性的影响不显著.本试验结果表明,黄柏提取物和菊粉在注射后第3天对仿刺参体腔细胞PO活性的影响最显著,而苦参提取物对PO活性的影响不显著.这可能由不同免疫增强剂激活PO原系统的作用不同,或仿刺参体腔细胞对不同免疫增强剂的受体不同造成的.
SOD是衡量生物体健康状况的一个主要指标,机体内SOD活性的高低反映抗氧化能力的大小[3,13,16].张琴等[3]研究表明,饲料中添加 100 和 200 mg·kg-1甘草酸可以显著提高刺参体腔细胞的 SOD活性.本试验结果表明,不同免疫增强剂对仿刺参体腔细胞SOD活性产生不同的影响,反映机体对不同免疫增强剂的刺激产生不同的承受能力,应对外界的抗氧化能力及抵御敌害的免疫力发生不同的变化.
ACP是巨噬细胞溶酶体的标志酶,也是巨噬细胞最有代表的水解酶之一[17-18].本试验结果表明,不同免疫增强剂对仿刺参体腔细胞ACP活性产生不同的影响,且出现最大值的时间不同,这可能与不同免疫增强剂的成分及结构有关.
3.3 免疫增强剂的研究进展
目前国内外已报道多种免疫增强剂具有增强水产动物免疫功能的作用,但针对仿刺参的研究较少,且一般集中在多糖类物质(如肽聚糖、寡糖、脂多糖和免疫多糖等)、营养素类物质(如VC和VE等)和益生菌制剂上[19-23].Gu et al[24]通过体外试验研究不同免疫增强剂对仿刺参体腔细胞功能影响的结果表明:β-葡聚糖、寡甘露聚糖(MOS)和未甲基化的寡聚脱氧核苷酸 (CpG-ODN)均能显著提高仿刺参的吞噬活性、呼吸爆发活性、SOD和总一氧化氮酶(T-NOS)活性;而乳铁蛋白只能提高呼吸爆发活性和SOD活性,对吞噬活性和总一氧化氮酶活性没有显著影响;VC则提高了SOD和总一氧化氮酶活性,对吞噬活性和呼吸爆发活性未产生显著影响.
本试验选取的菊粉在自然界分布广泛,主要来源于植物,具有稳定性等特征,主要由呋喃果糖以β-2,1-D-糖苷键连接形成,能够增殖有益菌,调节肠道功能,促进矿物质元素的吸收,抑制内毒素等物质的产生,激发免疫活性,提高免疫功能等.本试验中,菊粉可提高仿刺参的免疫力,验证了上述功能.中草药黄柏具有抗菌、抗病毒和促进消化系统胰腺分泌等作用.本试验中黄柏提取物增强仿刺参的免疫功能可以从这些方面进行解析,对仿刺参产生的免疫抑制作用与其自身具有的免疫应答抑制效果相关.由于中草药的药理作用复杂,其具体的刺激作用需要更加深入的探究.中草药免疫增强剂长期服用可引起免疫疲劳[25],持续投喂时免疫指标会产生下降的趋势.改变投喂方式,将多种免疫增强剂交替使用或开发复合免疫增强剂是解决免疫疲劳的有效途径.中草药免疫增强剂在养殖业中应防重于治,其作为一种有效控制疾病的物质在水产动物尤其在仿刺参病害防治中起着重要作用,具有良好的安全性和可靠性,开发研制复合型的长效、高效和速效的新型免疫增强剂已成为发展的趋势.
[1]张春云,王印庚,荣小军.养殖刺参腐皮综合症病原菌的分离与鉴定[J].水产学报,2006,30(1):118-123.
[2]陈效儒,张文兵,麦康森,等.饲料中添加甘草酸对刺参生长、免疫及抗病力的影响[J].水生生物学报,2010,34(4):731-738.
[3]张琴,麦康森,张文兵,等.饲料中添加硒酵母和维生素E对刺参生长、免疫力及抗病力的影响[J].动物营养学报,2011,23(10):1745-1755.
[4]樊英,王淑娴,叶海斌,等.黄芪多糖对仿刺参非特异性免疫功能的影响[J].水产科学,2010,29(6):321-324.
[5]王淑娴,李天保,樊英,等.茯苓多糖对刺参体腔液中免疫因子活性的影响[J].饲料研究,2010(1):59-61.
[6]韩立丽,王建发,王凤龙,等.黄芪多糖对肠道免疫功能影响的研究进展[J].中国畜牧兽医,2009,36(8):133-135.
[7]胡俊青,胡晓.黄柏化学成分和药理作用的现代研究[J].当代医学,2009,15(7):139-141.
[8]上官明军,王芳,张红岗,等.菊粉对蛋雏鸡生长性能、免疫器官指数和血清免疫球蛋白的影响[J].动物营养学报,2009,21(1):118-122.
[9]刘莉如.天蚕素抗菌肽对蛋用仔公鸡生长、免疫及相关细胞因子mRNA表达水平影响的研究[D].乌鲁木齐:新疆农业大学,2012.
[10]KUDRIAVTSEV I,POLEVSHCHIKOV A.Comparative immunological analysis of echinodern cellular and humoral defense factors[J].Zh Obshch Biol,2004,65(3):218-231.
[11]COTEUR G,WARNAU M,JANGOUX M,et al.Reactive oxygen species(ROS)production by amoebocytes of Asterias rubens(Echinodermata) [J].Fish Shellfish Immunol,2002,12:187-200.
[12]SRITUNYALUCKSANA K,SITHISARN P,WITHAYACHUMNARNKUL B,et al.Activation of prophenoloxidase,agglutinin and antibacterial activity in haemolymph of the black tiger prawn,Penaeus monodon,by immunostimulants[J].Fish Shellfish Immunol,1999,9:21-30.
[13]SUN Y V,JIN L,WANG T T.Polysaccharides from Astragalus membranaceus promote phagocytosis and superoxide anionproduction by coelomocytes from sea cucumber Apostichopus japonicus in vitro[J].Comp Biochem Phys,Part C,2008,147(3):293-298.
[14]WANG K,LIU Z,XU Y,et al.Effect of L-ascorbic acid asimmunity enhancer for juvenile sea cucumber,Apostichopus japonicus[J].J Biotechnol,2008,136(Sup1):556-557.
[15]ZHAO Y C,MA H M,ZHANG W B,et al.Effects of dietary β-glucan on the growth,immune responses and resistance of sea cucumber,Apostichopus japonicus against Vibrio splendidus infection[J].Aquaculture,2011,315:269-274.
[16]樊英,王淑娴,李天保,等.微胶囊剂型黄芪多糖对刺参生长性能、免疫力及抗病力的影响[J].渔业科学进展,2013(1):119-125.
[17]李继业.养殖刺参免疫学特征与病害研究[D].青岛:中国海洋大学,2008.
[18]常杰.对虾和刺参敏感免疫学指标的筛选和评价[D].青岛:中国海洋大学,2010.
[19]周进,黄捷,宋晓玲.免疫增强剂在水产养殖中的应用[J].海洋水产研究,2003,24(4):70-79.
[20]张伟妮,林旋,王寿昆,等.黄芪多糖对罗非鱼非特异性免疫和胃肠内分泌功能的影响[J].动物营养学报,2010,22(2):401-409.
[21]周慧慧,马洪明,张文兵,等.仿刺参肠道潜在益生菌对稚参生长、免疫及抗病力的影响[J].水产学报,2010,34(6):955-963.
[22]ZHANG Q,MA H M,MAI K S,et al.Interaction of dietary Bacillus subtilis and fructooligosaccharide on the growth performance,non-specific immunity of sea cucumber,Apostichopus japonicus[J].Fish Shellfish Immunol,2010,29:204-211.
[23]ZHANG L,AI Q H,MAI K S,et al.Effects of dietary peptidoglycan level on the growth and non-specific immunity of Japanese seabass,Lateolabrax japonicus[J].Periodical of Ocean University of China,2008,38(4):551-556.
[24]GU M,MA H M,MAI K S,et al.Immune response of sea cucumber Apostichopus japonicus coelomocytes to severalimmunostimulants in vitro[J].Aquaculture,2010,36:49-56.
[25]CHANG C,CHEN H,SU M,et al.Immuomodulation by β-1,3-glucan in the brooders of the black tiger shrimp Penaeus monodon[J].Fish Shellfish Immunol,2000,10:505-514.
