荔枝TPEC与龙眼EC的电融合参数研究
2014-12-24赖钟雄赖呈纯顾金玲吴金寿
黄 浅,赖钟雄,赖呈纯,顾金玲,吴金寿
(1.福建农林大学园艺植物生物工程研究所,福建福州350002;2.周口市农业科学院,河南周口466001)
原生质体融合是生物技术育种的有效手段,通过原生质体融合可克服远缘杂交有性配子的不亲和性,创造出新的物种,解决生产上对新品种的不断需求.近10年来,果树原生质体技术得到了较快的发展,在原生质体融合方面,已有柑桔[1-8]、猕猴桃[9]、柿子[10]、野梨与樱桃[11]、刺葡萄[12]等多种果树获得了种内、种间、属间的体细胞杂种或胞质杂种,有的已开始实际应用.1979年,Senda[13]建立的电融合法发展迅速,是目前最先进的融合方法,至今已广泛应用于动植物及微生物细胞融合.目前通过电融合反复实验,已测出数十种植物原生质体的电融合参数,如水稻、小麦、燕麦(Avena sativa L.)、马铃薯(Solanum tuberousm)、油菜(B.ctunpestris)、胡萝卜(Daucus carota)、菜豆(Phaseolus vulgaris)、蚕豆、烟草、矮牵牛等,并成功获得部分细胞杂种[14].
荔枝、龙眼的原生质体培养和电融合技术研究工作进展缓慢,目前还处于原生质体培养和再生阶段,仅有少量基因型材料,如龙眼‘红核子’品种、荔枝‘下番枝’品种成功获得再生植株,关于荔枝、龙眼原生质体电融合的研究报道较少.因此,本研究在建立的荔枝、龙眼原生质体培养技术体系的基础上[15-19],以荔枝转基因原生质体再生的胚性愈伤组织(TPEC)细胞系和龙眼‘红核子’品种的松散型胚性愈伤组织(EC)为材料,采用PA-4000电融合仪进行原生质体电融合条件研究,摸索适宜荔枝、龙眼原生质体电融合参数,为实现龙眼、荔枝属间全部或部分的近缘种属的基因组转移,从而为培育龙眼、荔枝新品种或新型水果开辟新途径,并为进行微原生质体融合和不对称原生质体融合提供依据.
1 材料与方法
1.1 材料
研究材料为龙眼‘红核子’品种的幼胚 EC,要求其在附加1.0 mg·L-12,4-D、0.5 mg·L-1KT、5.0 mg·L-1AgNO3继代培养基培养15-17 d(图1-A);荔枝“下番枝”品种的TPEC,要求其在附加1.0 mg·L-12,4-D液体培养基中悬浮培养约5 d(图1-B).
图1 荔枝TPEC和龙眼EC原生质体分离材料Fig.1 Materials of isolated protoplast from litchi TPEC and longan EC
1.2 方法
1.2.1 龙眼、荔枝胚性愈伤组织的继代与保持 龙眼EC用附加1.0 mg·L-12,4-D与附加1 mg·L-12,4-D、0.5 mg·L-1KT、5 mg·L-1AgNO3的2种MS培养基上交替继代培养保持;荔枝胚性愈伤组织用附加1 mg·L-12,4-D 与附加1 mg·L-12,4-D、50 mg·L-1潮霉素的2种 MS培养基交替继代培养保持.
1.2.2 荔枝TPEC悬浮细胞系的建立 参照赖钟雄等[20]的方法,采用附加1 mg·L-12,4-D与附加1 mg·L-12,4-D、50 mg·L-1的液体培养基建立荔枝TPEC胚性悬浮细胞系.
1.2.3 原生质体分离 龙眼胚性愈伤组织原生质体分离参照赖钟雄[16]的方法进行.
荔枝TPEC悬浮细胞原生质体分离是将在不含潮霉素的交替继代培养基上悬浮培养6-8代5 d的悬浮细胞,用含纤维素和离析酶各1%的CPW-13M酶解液,在黑暗、25±2℃条件下,采用连续振荡(30-40 r·min-1)酶解10 h进行原生质体分离.
1.2.4 原生质体纯化 分离原生质体的纯化采用过滤—离心法[21].过滤网为孔径40 μm尼龙网,洗涤液为 CPW-13 M,pH 值5.8.
1.2.5 荔枝、龙眼原生质体电融合 (1)荔枝、龙眼原生质体电融合参数的初步筛选:根据融合仪各个参数对原生质体融合的影响,采用国产NCY-2型细胞融合仪筛选的参数进行预试验[22],设定基本参数体系,即交流电场(AC)强度50 V·cm-1,AC频率1 MHz,AC作用时间60 s;直流脉冲(DC)振幅500 V·cm-1,DC 作用持续时间5 ms,DC 2 次,DC 间隔0.5 μs;原生质体密度为5 ×105个·mL-1.
(2)荔枝、龙眼原生质体电融合参数的设计:原生质体融合参数在融合仪允许的有效参数范围内进行设计.AC 频率设计为 0.5、1.0、1.5、2.0 MHz;AC 强度设计为 20、40、50、60、70 V·cm-1;AC 作用时间设计为20、40、60、80、100 s;直流脉冲振幅设计为200、400、600、800 V;脉冲个数设计为 1、2、3、4、5 次;脉冲作用时间设计为 5、10、15、20 ms;脉冲间隔时间 0.125、0.25、0.5、1.0;融合液为融合仪专用融合液.单因素水平测定,即研究某一参数时,其他参数保持基本参数值不变,每个处理重复3次.
(3)荔枝、龙眼原生质体电融合:电融合仪为“PA-4000”(Cyto Pulse Sciences,Inc.美国细胞波公司),融合室为FP-C25/400(2.5 mm×2.0 mm)同心圆电极,将上述分离纯化过的2种原生质体以等体积混合后,吸取混合液均匀分布于环形槽中,室中央加少许融合液保湿,静置5-10 min后选择融合参数进行融合试验.原生质体融合时,先固定交流电场(AC)频率约1 MHz,逐渐升高调整AC电压,待原生质体排列呈串后,施加1-2次瞬时高压直流脉冲(DC),在60 s内逐渐降低AC至0.融合过程用倒置显微镜观察和照相,由于荔枝原生质体明显大于龙眼原生质体,因而可以直接在倒置显微镜下观察,观察并记录融合频率(原生质体融合频率/%=视野中融合的原生质体数/视野中原生质体总数×100).
2 结果与分析
2.1 融合过程
荔枝与龙眼原生质体电融合过程分两步进行,将经分离、纯化得到的龙眼、荔枝的原生质体(图2-A和图2-B)的密度调整到5×105个·mL-1,按1∶1混合(图2-C)后放入融合小室,在交变电场产生的双向电泳和正负电极吸引力作用下,双亲原生质体沿电场方向形成很多呈珍珠串的排列(图2-D);然后施加一次或多次直流方形脉冲使相互接触的原生质体的质膜发生可逆性电穿孔,原生质体融合在一起(图2-E-H),在短时间内融合体形成圆球形(图2-I-J).
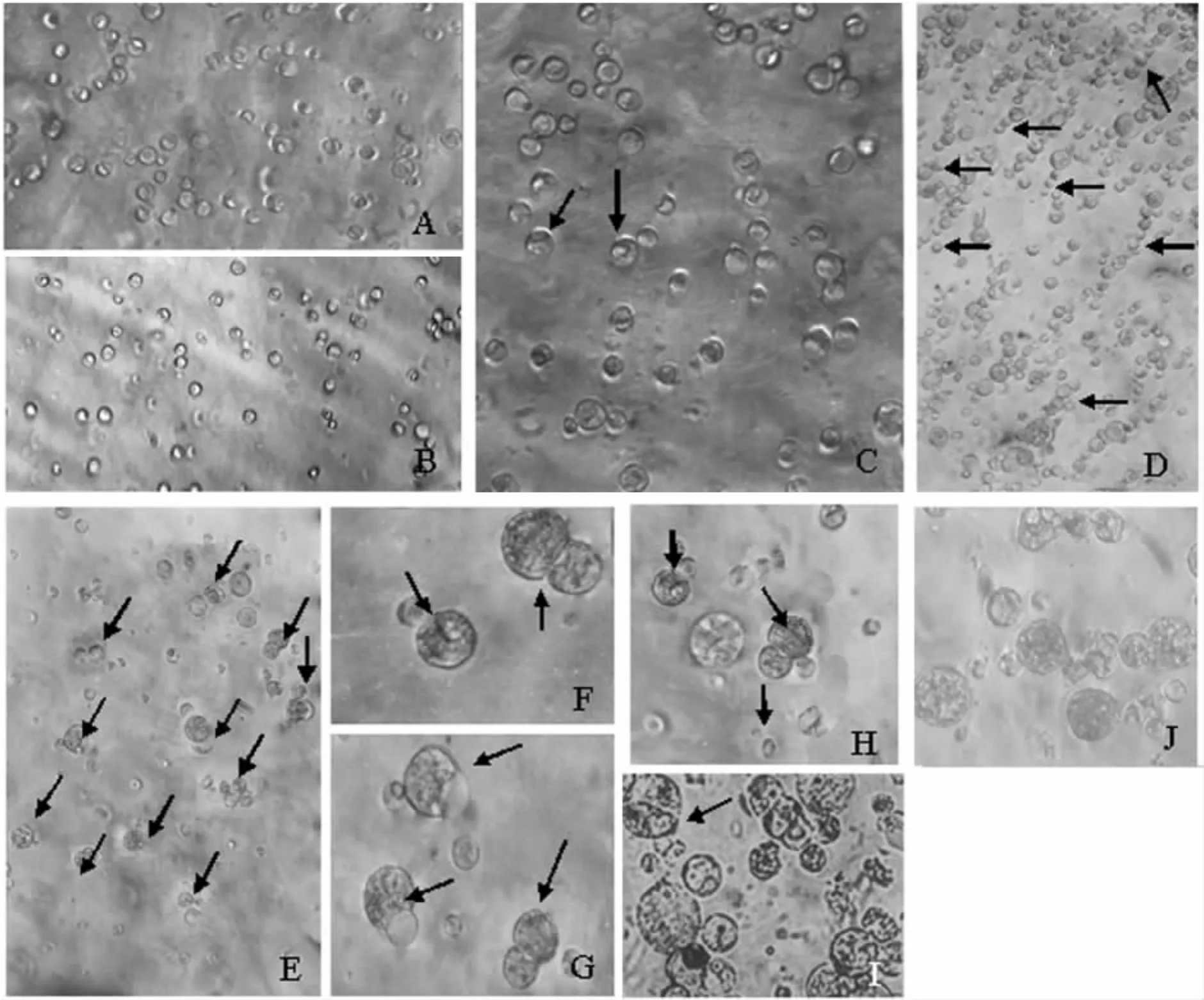
图2 荔枝TPEC与龙眼EC原生质体电融合过程Fig.2 Electrofusion process of protoplasts between longan EC and litchi TPEC
在融合过程中发现,交变电场的频率和强度越大,形成的珍珠串越快.交变电场作用时间越长,形成的珍珠串越长;直流脉冲电压越大,多核体越多,对原生质体的伤害越大,有时甚至造成不可逆击穿,导致原生质体碎裂;但如果直流脉冲电压过小,使原生质体之间不能发生质膜击穿,从而使原生质体不能融合或很少融合在一起.因此,选择适宜的电融合参数是十分必要的.
2.2 交流电场对原生质体成串的影响
原生质体在交流电场作用下,沿电场线方向泳动,并相互吸引排列成串.只有当原生质体排列成串,并紧密地结合在一起的情况下再施加直流脉冲,原生质体才能发生融合.交变电场是影响原生质体成串、膜接触的关键参数[23].在原生质体融合过程中发现,交变电场的频率、强度、作用时间影响原生质体成串的快慢及珍珠串的长短.
2.2.1 交变电场频率对原生质体成串的影响 由表1可以看出,当AC频率为1.0 MHz时,细胞串多为两个细胞的短串,多为一大一小的两个细胞成串,并且排列整齐(图3-A);当AC频率为1.5 MHz时,多为3-4个细胞排列成细胞串(图3-B).当AC频率>1.5 MHz时,原生质体形成的珍珠串较长(图3-C).由此可见,当交变电场频率为1.0 MHz时,龙眼、荔枝原生质体形成较为理想的细胞短串.

表1 交变电场频率对原生质体成串的影响1)Table 1 Effect of AC frequency on the pear lain of protoplasts
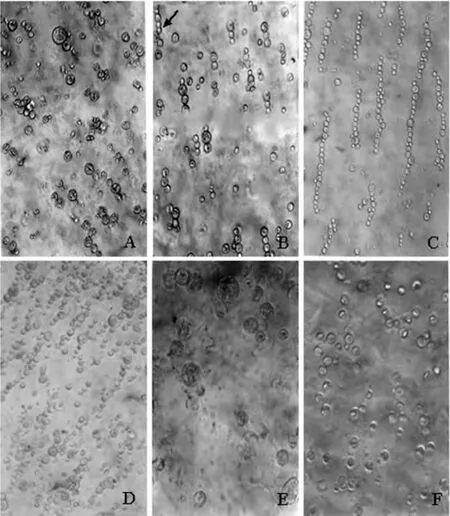
图3 交流电场(AC)对原生质体成串的影响Fig.3 The effect of AC on the pear lain of protoplasts
2.2.2 交变电场强度对原生质体成串的影响 由表2可以看出,当交变电场强度为50-60 V·cm-1时,原生质体形成的两细胞串较多,为理想的交变电场电压(图3-A).当交变电场强度为20、30 V·cm-1时,细胞不能成串或较少成串(图3-E),这可能是由于在AC作用时间(60 s)一定的情况下,交变电场强度较低,原生质体移动较慢,导致细胞不能成串或成串的比率很低.随着交变电压升高,原生质体在电场作用下移动速度加快,细胞接触的时间变短,成串的比率升高.当AC强度为70 V·cm-1时,细胞成串较长(图3-D).由此可见,调整交变电场电压对提高龙眼、荔枝原生质体理想细胞串有明显效果.

表2 交变电场强度对原生质体成串状况的影响1)Table 2 Effect of AC voltage on the pear lain of protoplasts
2.2.3 交变电场作用时间对原生质体成串的影响 交变电场作用时间是影响原生质体成串长短的另一个重要因素,其对荔枝、龙眼原生质体成串的影响结果见表3.AC作用时间为60 s时,两细胞串较多,排列整齐,是原生质体成串比较理想的交流电场作用时间;交流电场作用时间过短,原生质体不能成串(图3-F);交流电场作用时间过长,原生质体形成的珍珠串太长.因此,将理想成串的AC作用时间选定为60 s.

表3 交变电场作用时间对原生质体成串的影响1)Table 3 Effect of AC duration on the pear lain of protoplasts
2.3 直流脉冲对原生质体融合的影响
在电融合过程中,直流脉冲是决定原生质体能否成功的关键因素.直流脉冲振幅、作用时间、脉冲次数及脉冲间隔共同影响原生质体融合.
2.3.1 直流脉冲强度对原生质体融合的影响 直流脉冲强度是影响原生质体融合效果的另一个重要因素.本试验在AC强度为50 V·cm-1,AC频率1.0 MHz,AC作用时间60 s;DC作用持续时间5 ms,脉冲2 次,DC 间隔0.5 μs;原生质体密度为5 ×105个·mL-1的条件下,研究了不同直流脉冲强度对荔枝、龙眼原生质体融合效果的影响,其结果见图4.由图4可以看出,当脉冲强度为200 V·cm-1时,未能观察到原生质体融合;随着脉冲强度的增加,原生质体融合率逐渐升高,当脉冲强度为600 V·cm-1时,融合率达到最高,为35.7%;当脉冲强度增加到800 V·cm-1时原生质体融合率下降.因此,将600 V·cm-1作为龙眼、荔枝原生质体融合的适宜脉冲强度.
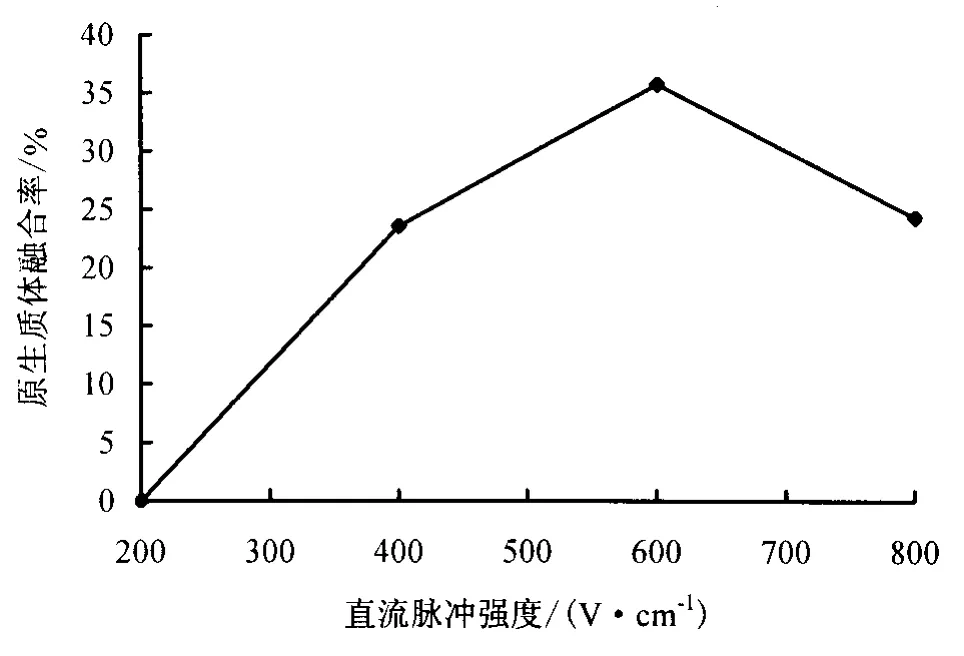
图4 不同直流脉冲强度对融合率的影响Fig.4 Effect of different DC on the frequency of pair fusion
2.3.2 直流脉冲时间对原生质体融合率的影响 在AC强度50 V·cm-1,AC频率1.0 MHz,AC作用时间60 s;DC 作用持续时间5 ms,脉冲2次,DC 间隔0.5 μs;原生质体密度5×105个·mL-1的条件下,研究了不同直流脉冲强度对荔枝、龙眼原生质体融合效果的影响(图5).
由图5可以看出,龙眼、荔枝原生质体在DC持续时间为5 ms时,融合率达到26.5%,脉冲持续时间为10 ms时融合率达到最大,为31.2%;随着脉冲作用时间的延长,原生质体融合率逐渐下降,同时原生质体会产生不可逆的破裂,多核融合体增加.因此,为了得到较理想的龙眼、荔枝一对一原生质体融合,其脉冲持续时间确定为10 ms.
2.3.3 直流脉冲次数对原生质体融合的影响 由图6中可以看出,以脉冲2-3次的效果最好,原生质体的融合率较高,融合率最高达33.8%.而脉冲4次以上的不仅没能提高原生质体的融合率,反而使一部分已形成的融合体破裂,从而使原生质体的融合率下降,不利于融合后原生质体的培养.因此,龙眼、荔枝原生质体电融合选定脉冲次数为2-3次.
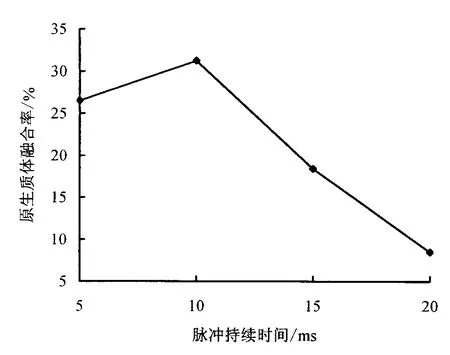
图5 直流脉冲作用时间对融合率的影响Fig.5 Effect of different DC time on the frequency of pair fusion
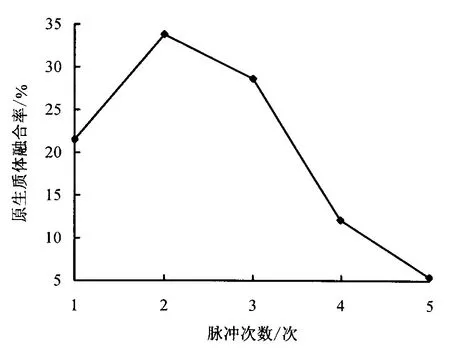
图6 直流脉冲次数对原生质体融合率的影响Fig.6 Effect of pulse on the fusion frequency of protoplasts
2.4 原生质体密度对融合率的影响
原生质体电融合率除了与交变电场、直流脉冲的相关参数有关外,与双亲混合后的原生质体密度也有很大关系.在其他电融合参数一定的情况下,原生质体密度较小时,原生质体成串较慢,融合率较低;原生质体密度较大时,原生质体成串过长,导致多细胞融合率升高,而理想融合率降低.由此可见,适宜的原生质体密度也是原生质体融合成功的关键因素.在龙眼、荔枝原生质体融合研究过程中发现,在电融合参数筛选过程中,原生质体密度为5×105个·mL-1时,原生质体理想成串率、融合率都比较高.因此,本研究采用的原生质体密度为5×105个·mL-1.
3 讨论
原生质体电融合参数的选择是影响原生质体融合频率的关键因素之一[12].近年来,已发表了数百篇关于电融合的基本化学机理及其在医学、分子生物学、生物技术学方面应用的科学论文.在不同研究中,由于所选用的细胞融合仪不一样或者所利用的材料不同、材料的生理状态不一样,报道的参数也不一样.AC强度、频率以及AC作用时间直接影响到原生质体的成串效果;DC强度、持续时间、次数及其脉冲时间间隔是影响原生质体融合率的关键参数.在本研究中,当原生质体密度为5×105个·mL-1时,交流电场的频率和场强分别选用1.0 Mhz和50 V·cm-1,作用时间为60 s时,龙眼、荔枝的原生质体能形成理想的珍珠串;当直流脉冲强度为600 V·cm-1、脉冲持续时间为10 ms,脉冲2-3次时,能获得较高的原生质体融合频率,最高能达到30%以上,这与赖钟雄[22]报道的参数有所不同,融合率高于其采用CNY-2融合仪的融合率,可能是由于使用的仪器不同的原因.本研究的交流电压的频率与大多数柑桔[24]、刺葡萄[12]的原生质体电融合时一致;交变电压的强度低于胡家金等[25]在水稻与空心莲子草,陈文品等[26]在小麦和黑麦,郭传敏[27]在杨树的原生质体电融合中交流电场的电压,但与不少柑桔原生质体电融合中的交流电场强度相近,柑桔原生质体电融合中的交流电场强度为75 V·cm-1[1,3].本研究筛选的荔枝、龙眼原生质体融合的 DC 电场相关参数与杨树[27]、刺葡萄与玫瑰香[12]、柑桔[28]、普通小麦与黑麦草[26]、水稻与空心莲子草[25]、烟草与构祀属[29]上所报道的不同.Harding et al[30]研究表明,最适的 DC 脉冲取决于所用的细胞系,直径大的原生质体要用弱电场,直径小的原生质体可以施以强电场.由此可见,根据植物选择原生质体适宜的参数是电融合的技术关键.在原生质体电融合研究中,应在综合考虑原生质体的密度和电融合参数等因素对融合率影响的同时,还要考虑所研究的植物材料因素,以提高原生质体的融合率.
荔枝、龙眼为近缘属,是亚热带常绿乔木果树,是我国南方的特产果树.目前我国栽培的荔枝和龙眼(及其它木本果树)品种大多数是通过实生选种、芽变选种以及常规的杂交育种等手段培育的,这些传统的育种方法选育的品种有很大的局限性,使新品种培育进展缓慢,难以培育出满足消费者和市场需求的优质品种,因此克服传统育种中育种周期长、有性杂交不亲和的障碍是获得荔枝、龙眼优良品种的关键.植物原生质体融合能通过一定技术转移细胞核中的染色体组、染色体片段或细胞质中的叶绿体DNA及线粒体DNA,同时又能克服有性杂交的障碍,扩展可利用的基因资源,使融合细胞的遗传物质发生复杂重组,能够改良品种或产生新物种.因此,育种学家将原生质体融合与常规育种技术相结合,希望能够实现品种改良或获得更为丰富的种质资源[31,32].随着原生质体培养技术的成熟,融合技术在研究和应用方面得到了发展与完善,电融合技术取得了很大的进展[2-8,33,34].据报道,电融合诱导产生的原生质体融合率比PEG诱导的高100倍,而且该法还具有操作简便,融合同步,不对细胞产生毒害作用的优点,因而得到了普遍应用[35-38].本研究以荔枝TPEC悬浮培养系和龙眼松散型胚性愈伤组织为材料,采用PA-4000电融合仪进行荔枝、龙眼原生质体融合,对其电融合参数进行了初步筛选,使融合率高达30%以上,初步建立了荔枝与龙眼原生质体电融合的技术体系.另外,本研究经过对电融合产物的初步培养,只得到多细胞团.因此,对荔枝TPEC与龙眼EC电融合产物的培养及其杂种的检测还有待进一步研究.
[1]刘继红,胡春根,邓秀新.澳洲指橘与柑橘属间原生质体电融合获得二倍体体细胞杂种[J].植物学报,1999,22(4):316-321.
[2]刘继红,胡春根,邓秀新.原生质体电融合再生柑橘属间体细胞杂种[J].实验生物学报,2000,33(4):325-331.
[3]刘继红,邓秀新.原生质体电融合再生柑橘属间四倍体体细胞杂种[J].中国农业科学,2000,33(2):98-100.
[4]刘继红,邓秀新.柑桔原生质体非对称融合植株再生及鉴定[J].植物学报,2002,42(1):1144-1149.
[5]刘继红,邓秀新.原生质体融合再生柑橘种间二倍体体细胞杂种[J].农业生物技术学报,2002,10(4):334-337.
[6]刘继红,胡春根,邓秀新.电场诱导原生质体融合获得柑橘属间四倍体体细胞杂种[J].园艺学报,2002,29(4):372-374.
[7]LIU J H,DENG X X.Regeneration and analysis of citrus interspecific mixoploid hybrid plants asymmetric somatic hybridization[J].Euphytica,2002,125:13-20
[8]邓秀新,郭文武,余桂红.柑桔体细胞融合再生9个组合的二倍体叶肉新木本型植株[J].园艺学报,2000,27(1):116-119.
[9]肖尊安,韩碧文.猕猴桃原生质体融合和植株再生[J].细胞生物学杂志(S),1995,1:24-25.
[10]TAMURA M,TAO R,SUGIURA A.Production of somatic hybrids of Japanese persimmon and its characterization[C].Abstracts of 24th International Horticultural Congress,Kyoto,Japan,1995,22(4):316-321.
[11]OCHATT S J.PATAT-OCHATT E M.RECH E L et al.Somatic hybridization of sexually incompatible top-fruit tree rootstocks,wild pear(Pyrus commnis var,Pyraster L.)and colt cherry(Prunus aviun × pseudocerasus)[J].Theor Appl Genet,1989,78:35-41.
[12]吕长平.刺葡萄原生质体分离、培养及植株再生与电融合技术体系的研究[D].长沙:湖南农业大学,2006.
[13]SENDA M.Plant Cell Physoil[J].Plant Cell Rep,1979,20(1):441-1443.
[14]汪和睦,谢廷栋.细胞电穿孔、电融合、电刺激——原理技术及应用[M].天津:天津科学技术出版社,2000:20-70.
[15]俞长河,陈振光.幼胚和花药培养诱导荔枝胚性愈伤组织[J].福建农业大学学报,1997,26(2):168-172.
[16]赖钟雄.龙眼原生质体培养高效再生体系的研究[D].福州:福建农林大学,1997.
[17]赖呈纯.荔枝转基因抗性胚性愈伤组织的继代保持及其应用初探[D].福州:福建农林大学,2004.
[18]赖呈纯,赖钟雄,黄浅,等.荔枝转基因悬浮细胞再生松散性胚性愈伤组织的原生质体分离与初步培养[J].亚热带农业研究,2007,3(2):137-141.
[19]黄枝英,赖钟雄.荔枝转基因胚性愈伤组织原生质体分离条件的优化[J].福建农林大学学报:自然科学版,2006,35(3):266-271.
[20]赖钟雄,黄浅,林秀莲,等.荔枝胚性悬浮细胞系的快速建立及其体胚植株的再生[J].中国农学通报,2007,23(1):28-32.
[21]孙勇如,安锡培.植物原生质体培养[M].北京:科学出版社,1991:52-57.
[22]赖钟雄,陈振光.龙眼荔枝属间原生质体电融合[J].福建农业大学学报,2001,30(3):347-352.
[23]田振东.提高马铃薯体细胞电融合成对融合频率的技术研究[D].兰州:甘肃农业大学,2000.
[24]刘继红.柑桔原生质体电融合研究进展[J].生物学杂志,1998,15(81):8-10.
[25]胡家金,萧浪涛,洪亚辉,等.水稻与空心莲子草原生质体电融合条件的研究[J].中国农学通报,2001,17(3):24-27.
[26]陈文品,吴琴生,刘大钧,等.普通小麦和黑麦草原生质体电融合的适宜条件[J].南京农业大学学报,1991,14(4):1-6.
[27]郭传敏.杨树原生质体分离及电融合技术体系的研究[D].南京:南京林业大学,2007.
[28]刘继红.柑桔原生质体电融合研究进展[J].生物学杂志,1998,15(81):8-10.
[29]刘宝,刑苗,张忠恒,等.烟草和枸杞属间原生质体电融合再生杂种植株[J].植物学报,1995,37(4):259-266.
[30]HARDING H P,ZHANG Y,BERTOLOTTI A,et al.Perk is essential for translational regulation and cell survival during the unfolded protein response.Molecular Cell,2000,5(5):897-904.
[31]周新民,陆帼一.原生质在作物改良上的应用[J].西北农业学报,1997,6(1):88-91.
[32]余晓丽.植物原生质体培养研究进展及应用[J].生物学通报,1998,35(5):7-9.
[33]甘霖,邓秀新,萧顺元,等.一个新的柑桔属间体细胞杂种[J].湖南农学院学报,1995,21(2):116-125.
[34]甘霖,邓秀新,章文才.桃原生质体培养再生愈伤组织[[J].植物生理学通讯,1993,29(3):191-192.
[35]廖劲松.原生质体融合提高玫瑰茄细胞生长速率的研究[D].广州:华南理工大学,2004.
[36]王天池,林葵.电融合技术在植物细胞工程中的应用现状[J].植物学通报,1994,11(3):19-24.
[37]KOOP H U,DIRK J,WOLFF D,et al.Somatic hybridization of two selected single cells[J].Cell Biol lnt Rep,1983,7(12):1123-1128.
[38]FIROOZABADY E,DEBOER D L.Isolation,culture,and cell division in cotyledon protoplasts of cotton(Gossypium hirsutum and Gossypium barbadense)[J].Plant Cell Rep,1986,5(2):127-131.
