松嫩盐碱草地土壤理化特性与丛枝菌根真菌侵染的相关性
2014-12-24岳英男杨春雪
岳英男,杨春雪
(东北林业大学园林学院,黑龙江哈尔滨150040)
丛枝菌根(Arbuscular Mycorrhizal,AM)真菌能与90%以上的高等植物形成丛枝菌根,促进植物对土壤中矿质元素,尤其是磷的吸收,同时改善植物对水分的吸收能力,促进植物的渗透调节并提高植物的光合作用,从而提高植物在盐胁迫下的耐性[1]。另一方面,随着盐胁迫强度的增大,AM真菌孢子萌发受到延缓或抑制,阻碍菌丝的生长,直接影响菌根的形成,进而影响AM真菌的侵染状况[2]。
松嫩草地位于东北大平原的中部,具有独特的群落构成和植物区系,以羊草(Leymus chinense)+杂类草群落为主,其中羊草是松嫩草地的优势禾草[3]。目前,针对AM真菌与植物共生状况的研究已有很多[4-5],但针对松嫩盐碱草地中土壤化学性质和AM真菌侵染状况关系的研究较少。本试验探究松嫩盐碱草地中AM真菌的侵染状况和土壤的化学性质,分析土壤化学性质和AM真菌之间的关系,以期为不同盐度的松嫩盐碱草地退化草地生态系统的生态修复与重建提供理论依据。
1 材料与方法
1.1 研究区自然概况
研究区选择黑龙江省肇东市西南部的盐碱土地,45°10'- 46°20'N,125°22'- 126°22'E,海拔137~138 m,地势平坦,土质肥沃。该区属温带大陆性季风气候;冬季严寒干燥,夏季温热湿润;年降水量为350~550 mm,主要集中在7-9月,而年蒸发量则为降水量的2~3倍。土壤类型多样,多为黑钙土和苏打草甸土。
1.2 样品采集与保存
2013年7月1日于肇东市的松嫩盐碱草地采集了11科26种常见植物。按照“多点混合法与平行采样对照法”[6]取样,每种植物随机选取3株作为重复,每株按东南西北4个方向,清除土壤表面5 cm深的杂草和地表土,用小铲轻轻挖取距地表10-20 cm深的根际土壤,并取粘附在根上的细土,最后经“四分法”[6]保留 1 kg,并剪取长度为 0.5 ~1.0 cm且粗细均匀的植物根系小段固定于1/2 FAA固定液(福尔马林5 mL,冰醋酸5 mL,70%酒精90 mL)[7]中,土壤和根系统一编号后带回,保存于4℃的冰箱中。
1.3 根际丛枝菌根侵染率测定
将小根段从固定液中取出,用清水冲洗3~5遍直到无刺激性气味后用10%KOH水浴软化透明,根系变软后用5%的乳酸中和,采用“改良Phillips和Hayman染色法”,用Trypan-blue对根系染色,在MOTIC-BA400显微镜下镜检菌丝、丛枝、泡囊等的形态结构[8],用 Trouvelot等[9]方法统计丛枝丰度(%)、泡囊丰度(%)、侵染强度(%)和侵染率(%),并详细记录菌丝的形态结构(利用 MYCOCALC软件分析)。
1.4 根际土壤理化性质的测定
参照《土壤农化分析》[10]和中国科学院南京土壤研究所的方法测定[11]。土壤的pH值采用2.5∶1的水土比,用电位法(雷磁PHS-3C)测定;土壤全盐量用电导率仪(雷磁DDS-307)测定;土壤有机质用重铬酸钾容量法测定;土壤全氮量采用半微量凯氏法测定(德国,ATN-1100型全自动凯氏定氮仪)。
1.5 数据分析
采用 SPSS 17.0软件中的单因素方差分析(Duncans)和多重比较(α=0.05)分别对AM真菌侵染状况和土壤化学性质进行统计分析,用平均值和标准误表示测定结果,用Duncans法对各测定数据进行多重比较;用Pearson相关系数分析土壤的化学性质和AM真菌的侵染状况之间的相关性;分析采用Microsoft Excel对数据进行处理和绘图。
2 结果
2.1 AM真菌的侵染状况
所有植物均有典型的AM菌根结构(图1),侵染率因植物的科属和种类不同而异(表1)。蔷薇科植物侵染率最高,100%被侵染;菊科和豆科平均侵染率分别为94.91%和99.77%,禾本科次之,平均侵染率为91.94%。其中,全叶马兰、艾蒿、蒲公英、羊草、大蓟、黄芪、野大麦、虎耳草、蔓委陵菜和鹅绒委陵菜的侵染率均为100%,草木樨、碱蒿、大籽蒿、毛茛、星星草次之,分别为 99.53%、97.24%、94.82% 、94.33%、90.98% ,而碱蓬的侵染率最低,
35.44%;通常被认为不能或不易形成菌根的植物,如蓼科中的碱蓼、扁蓄蓼,十字花科的葶苈和茜草科的蓬子菜,也均有不同程度的侵染(图1)。菌根侵染强度同样也因植物种类而异(表1),蒲公英的侵染强度最高,达到了79.25%;黄芪、全叶马兰次之,分别为68.76%和65.98%;扁蓄蓼侵染强度最低,仅有3.37%。但不是所有的植物都能形成丛枝结构,蓼科的碱蓼和扁蓄蓼,十字花科的葶苈没有观察到丛枝结构,其中丛枝丰度最高的是蒲公英,达到了50.19%;较低的是碱蓬,仅有 0.07%,不易形成丛枝的蓬子菜(图1),丛枝丰度也有1.16%。所有的植物均能形成泡囊结构,蒲公英的泡囊丰度最高,达到了 45.16%;星星草的泡囊丰度最低,仅有1.22%。通常被认为不能或不易被侵染的碱蓼、扁蓄蓼和葶苈,也观察到了泡囊结构(图1)。
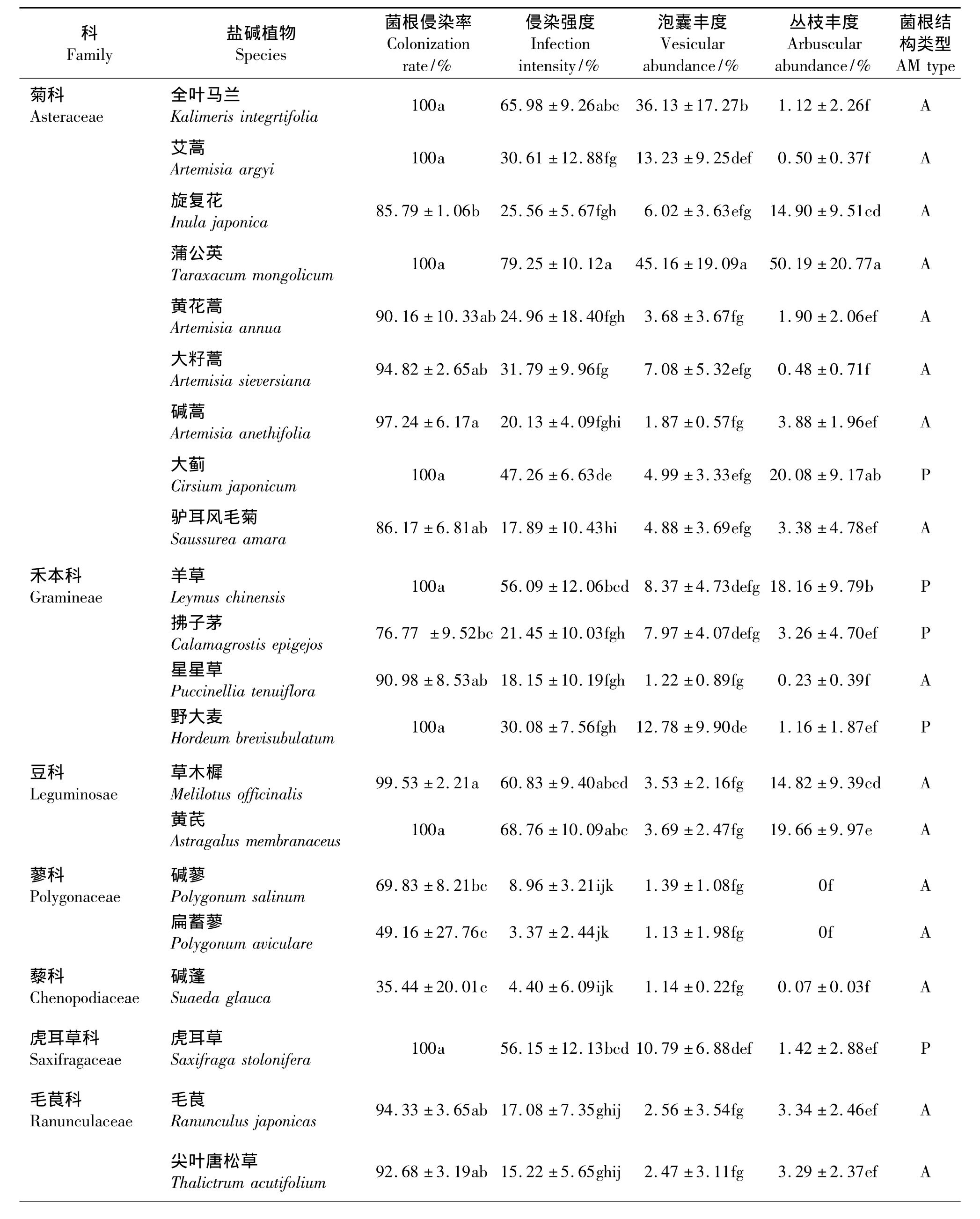
表1 AM真菌侵染植物状况Table 1 Plant’s colonization of AM fungi
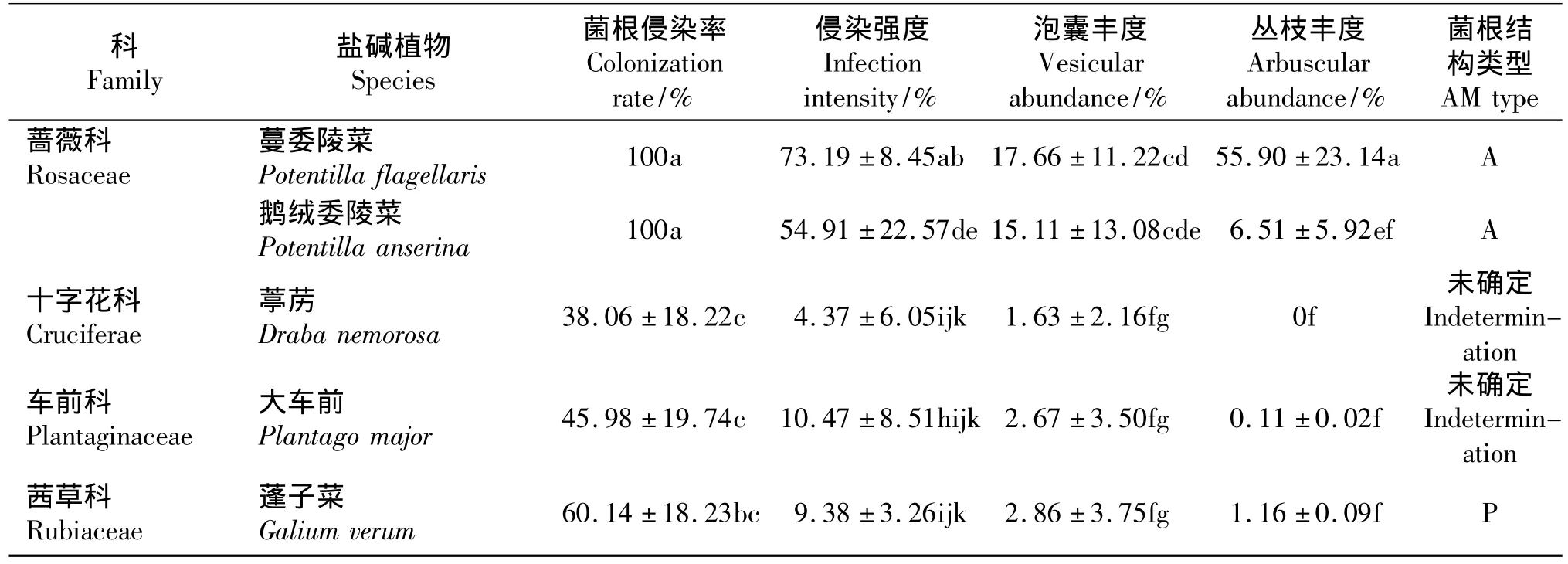
续表1
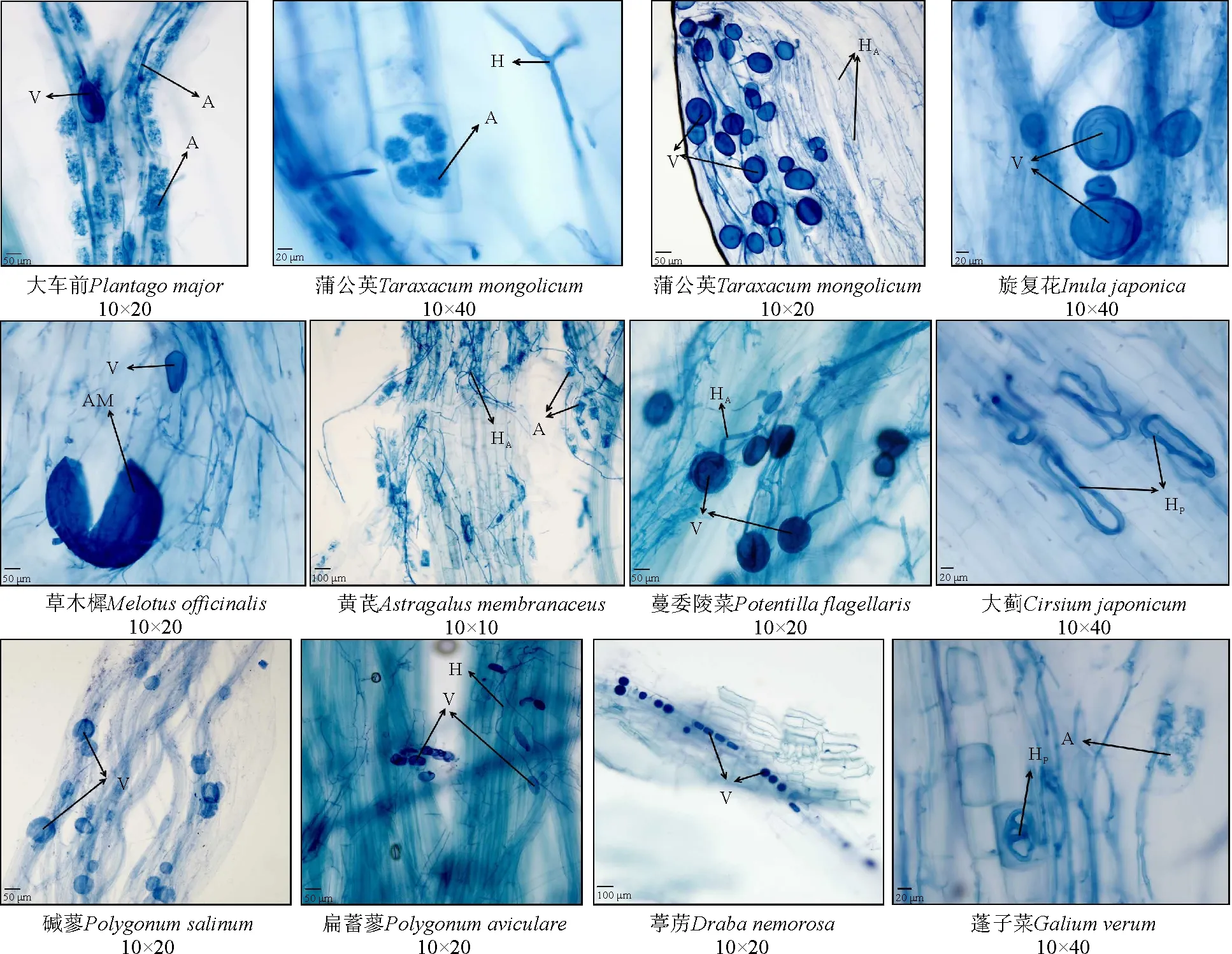
图1 AM真菌菌根典型显微结构Fig.1 Typical microstructure of mycorrhiza of AM fungi
2.2 AM真菌结构类型
丛枝菌根有疆南星型(Arum-type,简写为 A-型)和重楼型(Paris-type,简写为 P-型)两种类型。A-型的特征为:菌丝在宿主皮层细胞间隙生长,形成大量胞间菌丝,并侧向分枝进入细胞,通过顶端不断分叉形成典型的丛枝结构。而P-型的菌丝在皮层细胞内卷曲、缠绕生长,并在皮层细胞间直接传播,胞间菌丝较少,丛枝结构形成于卷曲的菌丝之间,且多限于紧贴中柱的几层内部皮层细胞[12]。在自然植物群落中,P-型较多见,尤其在苔藓、蕨类植物、裸子植物和野生的被子植物中占主导地位;而A-型则常见于栽培植物中[13]。本研究结果显示,被侵染的26种植物中,有18种植物形成A-型菌根,只有6种植物形成P-型菌根;而葶苈和大车前在观察其侵染情况时只观察到了少量的泡囊和一小部分的胞间菌丝,难以确定菌根结构类型(图1)。由此可见,菌根的结构类型随着植物种类的不同而变化。松嫩盐碱草地的野生植物菌根类型多为A-型,这与土壤的盐碱度、土壤质地和当地气候条件有着直接的关系。
2.3 根际土壤性质
随着植物种类的不同,根际土壤的pH值、全盐量、有机质和全氮量也随之变化(表2),26种植物根际土壤的pH值平均为8.21。各植物之间pH和全盐量相差不大,pH最高的是碱蓼,达到了8.96。蒲公英根际土壤的有机质含量和全氮量均达到所有植物中的最高值,分别为 24.32 和 1.72 g·kg-1,最低的是扁蓄蓼,分别为19.06 和1.38 g·kg-1。
2.4 根际土壤性质与AM真菌的相关性
pH值和侵染率、丛枝丰度之间的相关性不显著(P>0.05),但和侵染强度呈显著负相关(P<0.05),和泡囊丰度呈极显著负相关(P <0.01),相关系数分别为-0.555和-0.729。土壤的全盐量与菌根侵染率、丛枝丰度和侵染强度均无显著相关性(P>0.05),仅与泡囊丰度呈显著负相关(P<0.05),相关系数为 -0.449(表3)。土壤有机质和全氮与侵染率、侵染强度、泡囊丰度和丛枝丰度均有极显著影响(P <0.01),相关系数分别为 0.832、0.898、0.589、0.531 和 0.744、0.849、0.506、0.517(表3)。从结果可以看出,土壤有机质和全氮量对菌根侵染率和侵染强度的影响明显。
3 讨论
3.1 土壤p H值和全盐量对AM真菌的影响
土壤pH值对AM真菌的分布具有重要影响[14]。本研究发现,根际土壤的pH值与侵染率和丛枝丰度无显著相关(P>0.05),与侵染强度呈显著负相关(P<0.05),与泡囊丰度呈极显著负相关(P<0.01),这说明土壤的pH值对泡囊丰度和侵染强度有显著的影响。这可能是由于土壤pH值影响了AM真菌种的相对多度和产孢数量,从而影响了菌根的侵染强度,这与Gai等[15]对AM真菌侵染率的研究结果一致。Aliasgharzadeh等[16]认为,土壤盐碱化不仅没有抑制孢子的产生量,还使得AM真菌孢子的种类变得丰富,原因是在高盐度条件下,细胞内外会形成一种渗透压,细胞内的一些离子会在一定程度上渗透到土壤中,如,Na+、K+、Cl-、HCO3-,这就给AM真菌的侵染提供了一条通路,促进了AM真菌侵染植物根细胞,同时也促进了AM真菌孢子的形成,丰富了孢子的种类。中性偏酸的土壤盐碱度更有利于AM真菌侵染宿主植物,pH值过高则会抑制AM真菌菌丝的形成[16]。这与本研究中pH值与菌根侵染状况呈负相关的研究结果一致。本研究中,全盐量仅与泡囊丰度呈显著负相关(P<0.05),Sheng等[17]对甘肃地区的土壤全盐量和 AM真菌侵染状况之间的关系做了详细研究,结果显示,土壤全盐量和pH值呈极显著正相关(P<0.01),随着土壤全盐 量的 增加,AM 真 菌的侵染率和丛枝丰度呈现上升趋势,全盐量在0.21% ~0.25%范围内,AM真菌的侵染率、侵染强度、丛枝丰度达到最高。
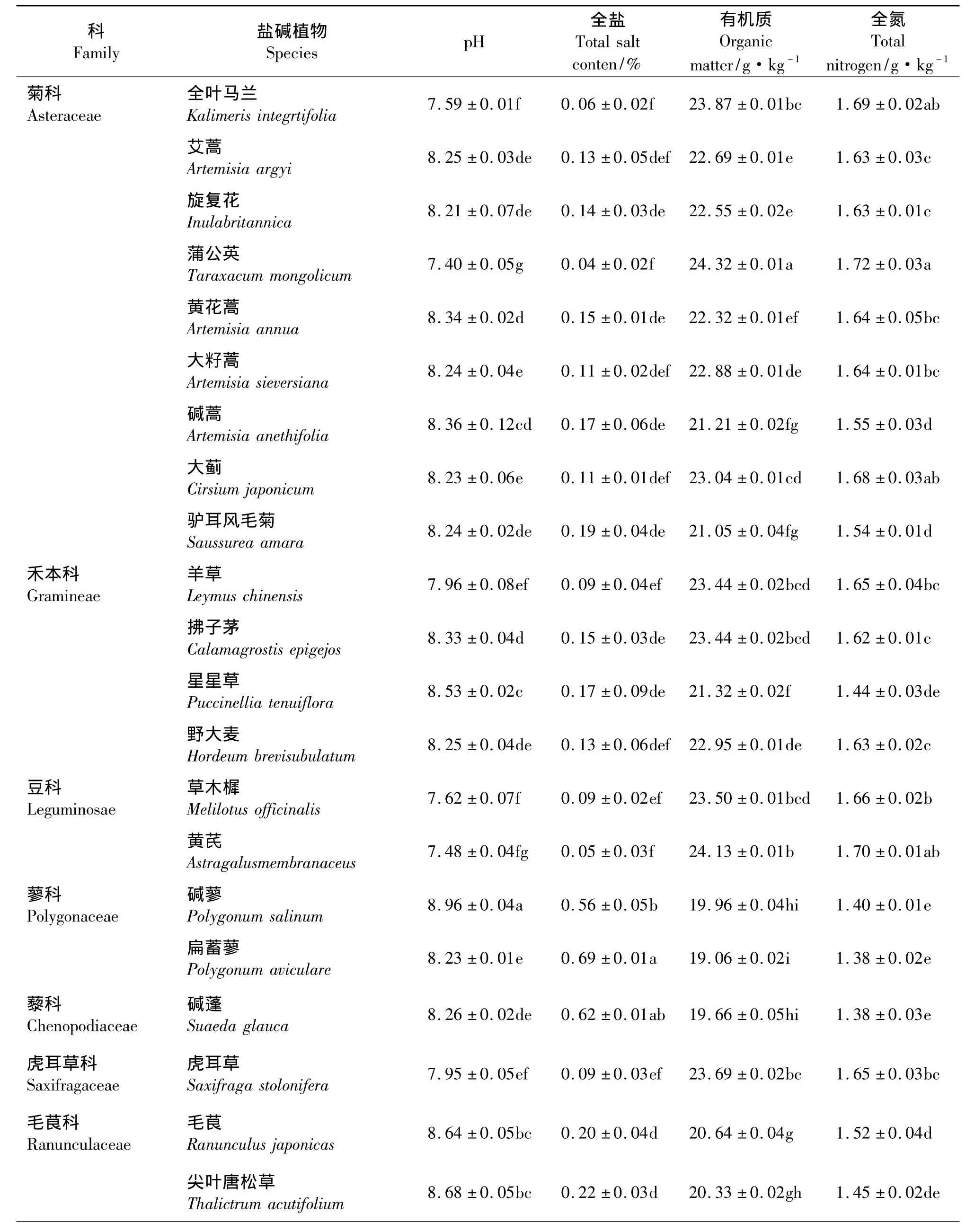
表2 盐碱植物根际土壤的化学性质Table 2 The rhizosphere soil chemical properties of salt-tolerant plants
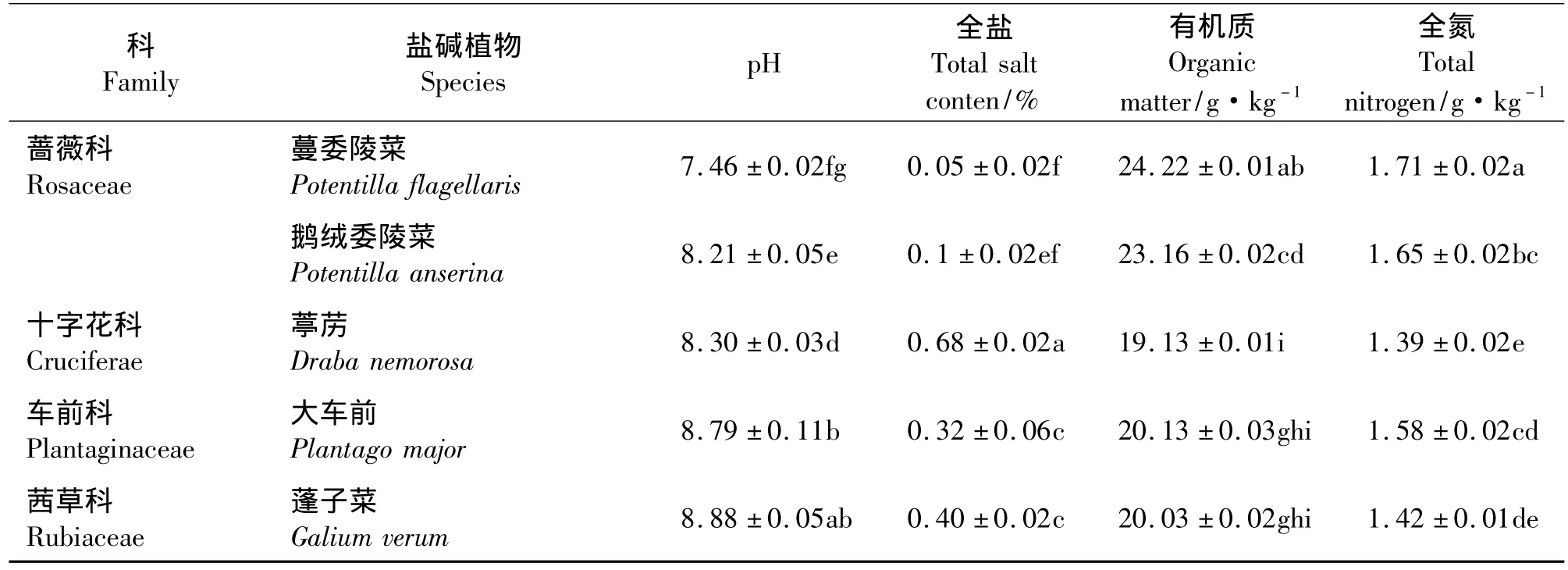
续表2

表3 土壤性质与AM真菌之间的相关性Table 3 The correlation between AM fungi and soil properties
3.2 土壤有机质和全氮量对AM真菌的影响
土壤有机质对AM真菌的侵染状况均呈极显著正相关(P<0.01),pH值仅与泡囊丰度表现出极显著负相关(P<0.01),全盐量仅与泡囊丰度表现出显著负相关(P<0.05),说明根际土壤有机质含量与AM真菌的侵染状况最为密切,在同一土壤环境下,土壤有机质对AM真菌侵染状况的影响要强于土壤pH值和全盐量对AM真菌侵染的影响,但这也与土壤有机质和氮素(无机态氮和有机态氮)含量的多少有密切关系,以侵染状况好(侵染率为100%)的蔷薇科植物和侵染状况差(平均侵染率<60%)的蓼科植物为例,蔓委陵菜和鹅绒委陵菜的侵染率均为 100%,侵染强度分别为73.19%和54.91%,比碱蓼和扁蓄蓼的侵染率高出30.17%和50.84%,侵染强度高出 64.23%和50.82%,与此相对应,蔓委陵菜和鹅绒委陵菜的有机质含量分别为24.22 和23.16 g·kg-1,全氮量分别为1.71 和1.65 g·kg-1,比碱蓼和扁蓄蓼的有机质含量高出4.26、3.16 和 3.20、4.10 g·kg-1,全氮量高出0.31、0.33和0.25、0.27 g·kg-1,且土壤有机质和氮素含量与侵染率的相关系数为0.832和0.744,与侵染强度的相关系数为0.898和0.849,均有着极显著相关。这说明,土壤有机质和氮素含量越高,土壤肥力和养分越丰富,就越有利于AM真菌的形成,本研究结果与已报道的一些研究结果一致[17],Agwa和 Abdel[14]调查了埃及盐碱土中AM真菌的侵染状况后表明,AM真菌的种的丰度和孢子相对多度与有机质含量呈正相关;Joner和Jakobsen[18]通过显微观察植物根系中的菌丝量发现,高含量的土壤有机质对透光球囊霉(Glomus diuphauam)菌丝的形成和发育具有积极作用,并能促进丛枝的发生;但本研究结果也与以往的研究结果略有不同,赵青华等[19]发现在一定范围内有机质含量与AM真菌的侵染率、丛枝丰度和泡囊丰度表现出显著的正相关,但超过一定范围后,AM真菌的侵染率和丛枝丰度就随着有机质含量的增加而减少。这可能是由于土壤有机质通过影响土壤其他因子来达到对AM真菌侵染状况的影响,由此可以看出,土壤有机质对AM真菌的影响始终处于动态变化之中,而不同地区土壤肥力、养肥和质地都存在着差异,因此在不同地区的盐碱地对有机质含量和AM真菌之间关系的研究可能会得出矛盾的结果。
[1]Prasad A,Kumar S,Khaliq A,Pandey A.Heavy metals and arbuscular mycorrhizal(AM)fungi can alter the yield and chemical composition of volatile oil of sweet basil(Ocimum basilicum L.)[J].Biology and Fertility of Soils,2011,47:853-861.
[2]黄文丽,范昕建,严铸云,马云桐,孟宪丽.三角叶黄连丛枝菌根真菌的多样性研究[J].中药材,2012,35(5):689-693.
[3]杜晓光,郑慧莹,刘存德.松嫩平原主要盐碱植物群落生物生态学机制的初步研究[J].植物生态学报,1994,18(1):41-49.
[4]Sheng M,Tang M,Chen H,Yang B W,Zhang F F,Huang Y H.Influence of arbuscular mycorrhizae on root system of maize plants under salt stress[J].Canadian Journal of Microbiology,2009,55(2):879-886.
[5]Wu Q S,Srivastava A K,Zou Y N.AMF-induced tolerance to drought stress in citrus:A review[J].Journal of Arid Environments,2013,164:77-87.
[6]孟繁荣.林木菌根学[M].哈尔滨:东北林业大学出版社,1996:137-150.
[7]Isabel B,Mário C,Luís A,Michael J G.Managing arbuscular mycorrhizal fungi for bioprotection:Mn toxicity[J].Soil Biology &Biochemistry,2014,68:78-84.
[8]Philips JM,Hayman D S.Improved procedures for clearing and staining parasitic and vesicular-arbuscular mycorrhizal fungi for rapid assessment of infection[J].Transactions of the British Mycological Society,1970,55:158-161.
[9]Trouvelot A,Kough J L,Gianinazzi-Pearson V G.Mesure du taux de mycorhization VA d’unsysteme radiculaire.Recherche de methodes d’estimation ayant une significantion fonctionnelle[M].Paris:INRA Press,1986,217-221.
[10]鲍士旦.土壤农化分析[M].北京:中国农业出版社,2000:22-42.
[11]中国科学院南京土壤研究所土壤物理研究室.土壤物理性质测定法[M].北京:科学出版社,1978:11-86.
[12]Gerdemann J W.Versicular-arbusclar mycorrhizea formed on maize and tuliptree by Endogone fasciculate[J].Mycologia,1965,57:562-575.
[13]Smith F A,Smith SE.Structural diversity in arbuscular mycorrhizal symbioses[J].New Phytologist,1997,137:373-388.
[14]Agwa H E,Abdel G M.Arbuscular mycorrhizal fungi(Glomales)in Egypt.II.An ecological view of some saline affected plants in the deltaic Mediterranean coastal land[J].Acta Botanica Hungarica,2002,44:1-17.
[15]Gai J P,Feng G,Li X L.Diversity of arbuscular mycorrhizal fungi in field soils from north China[J].Biodiversity Science,2004,12,435-440.
[16]Aliasgharzadeh N,Rastin N S,Towfighi H,Alizadeh A.Occurrence of arbuscular mycorrhizal fungi in saline soils of the Tabriz plain of Iran in relation to some physical and chemical properties of soil[J].Mycorrhiza,2001,11(3):119-122.
[17]Sheng M,Tang M,Zhang F F,Huang Y H.Effect of soil factors on arbuscular mycorrhizal fungi in saline alkaline soils of Gansu,Inner Mongolia and Ningxia[J].Biodiversity Science,2011,19(1):85-92.
[18]Joner E J,Jakobsen I.Growth and extracellular phosphatase activity of arbuscular mycorrhizal hyphaeas influenced by soil organic matter[J].Soil Biology and Biochemistry,1995,27:1153-1159.
[19]赵青华,孙立涛,王玉,丁兆堂,李敏.丛枝菌根真菌和施氮量对茶树生长、矿质元素吸收与茶叶品质的影响[J].植物生理学报,2014,50(2):164-170.
