长叶点地梅的细胞悬浮培养条件
2014-12-24张彦妮陈素波
张彦妮,陈素波
(东北林业大学园林学院,黑龙江哈尔滨150040)
报春花科植物共22属,约1 000种,其中点地梅属(Androsace)约有120种,分布于北半球温带,其中青藏高原地区和欧洲的阿尔卑斯山脉是该属的两个分布中心。中国有73个种7个变种,主要分布在青藏高原,适应高纬度地区生长,有部分种类分布在西北至内蒙古、东北以及秦岭以南各省区[1]。
目前,点地梅属植物的相关研究主要集中在化学成分的提取、药理作用、临床方面。已经从该属中提取了黄酮类化合物[2-4]和11个三萜皂苷类成分[5-7];在北点地梅(A.septentrionalis)中发现 11-cishexadecenoic acid 和 9-cis,12-cishexade-cadienoic acid两种植物中罕见的脂肪酸[8]。点地梅属的药理作用主要体现在能显著提高人肝癌细胞的抗增殖活性[9]、抑制人肺癌细胞A549、肝癌细胞BEL-7402和胃癌细胞 SGC7901的增殖等[10]。在临床方面,主要用于治疗咽喉炎和慢性咽喉肿痛[11]。所以点地梅属植物具有重要的药用价值。
悬浮培养作为一种植物细胞培养技术,主要是指愈伤组织在液体培养基中的培养过程[12],主要应用于获得再生植株和细胞内的次生代谢物质。长叶点地梅(A.longifolia)又称矮葶点地梅,为点地梅属多年生草本,叶丛生,线性,灰绿色,花冠白色,喉部紫红色,花朵娇小,花期为5月,是东北地区难得的早春花卉,更是一种不可多得的富有野趣的草坪植物和优良地被植物。目前,仅见通过叶片对长叶点地梅进行愈伤组织诱导及植株再生的报道[13],要使其快速地应用于园林绿化,就需要有大量的苗源。本研究以长叶点地梅愈伤组织作为试验材料,对其不同激素条件下细胞生长、培养液pH值、电导率的变化、对碳源的消耗等研究,以期为其液体悬浮培养及原生质体悬浮培养再生体系的建立提供一定的参考,同时为点地梅属植物利用悬浮培养进行次生代谢产物的生产奠定基础。
1 材料与方法
1.1 试验材料
在培养基 MS+1.0 mg·L-1,2,4-D+0.2 mg·L-16-BA上筛选出的淡绿色、疏松的愈伤组织。
1.2 试验方法
1.2.1 不同浓度植物生长调节剂对悬浮细胞生长的影响 将1.0 g(依据预试验结果)淡绿色、疏松愈伤组织分别接种于加有不同浓度2,4-D(0.4、0.6、0.8、1.0 mg·L-1)、或 6-BA(0.1、0.2、0.3、0.4 mg·L-1)的盛有 50 mL MS 液体培养基(灭菌前pH为5.4)的100 mL三角瓶中,于摇床上培养(转速100 r·min-1),培养温度25℃,光周期16 h/8 h。比较激素种类或浓度对细胞干质量的影响。每3 d测一次细胞干质量,每组重复3次,取平均值测至30 d。以培养天数为横坐标,以细胞干质量为纵坐标,绘制长叶点地梅的愈伤悬浮培养的生长曲线。
1.2.2 不同蔗糖浓度下愈伤组织对碳源的消耗规律将1.0 g淡绿色、疏松愈伤组织接种于蔗糖浓度分别为1%、2%、3%、4%的50 mL MS液体培养基(添加上面试验选出的最佳激素浓度,灭菌前pH为5.4)中,于摇床上培养(转速100 r·min-1),培养温度25℃,24 h光照下培养。利用3,5-二硝基水杨酸法测定还原糖,以蒽酮法测定蔗糖、果糖、葡萄糖[14]。
1.2.3 摇床转速对细胞生长的影响 将1.0 g淡绿色、疏松愈伤组织接种于加有上面试验筛选出的最佳浓度的激素和蔗糖的50 mL MS液体培养基(灭菌前pH值为5.4)中,于不同转速(设为75、85、95、105、115、125 r·min-1)的摇床上培养,培养温度25℃,光照下培养。12 d后(依据预试验结果)测细胞干质量。
1.2.4 培养液pH值、电导率及干质量的测定 每100 mL三角瓶盛有50 mL培养液(上面试验筛选出的最佳MS液体培养基,灭菌前pH为5.4),接种1.0 g淡绿色、疏松愈伤组织,培养温度25℃,24 h光照下培养。定期测定培养液pH、电导率和细胞干质量。
pH 测定:每隔3 d 取样一次,1 000 r·min-1离心4 min,用精密pH计测定上清液酸碱度,每个试验重复3次,取平均值。
电导率的测定:每隔3 d取一次悬浮培养的长叶点地梅培养液,过滤所得培养液用电导仪测定电导率,单位为 ms·cm-1。
干质量的测定:将三角瓶中的悬浮细胞用蒸馏水将残留的细胞培养液冲洗干净,再用滤纸将水分吸干,将细胞于60℃烘箱中烘干72 h后称其干质量。每3 d测一次细胞干质量,每次重复3组,取平均值测至30 d。
2 结果与分析
2.1 不同植物生长调节剂对悬浮细胞生长的影响
不同浓度的6-BA对悬浮细胞的生长均呈现先升高后降低的趋势(图1)。在前9 d,各个浓度的6-BA对细胞生长影响差异不大,低浓度(0.1 mg·L-1)6-BA中细胞干质量达到峰值所需时间较短(9 d),但数值小于其他3个浓度下的细胞干质量。当6-BA的浓度为0.3 mg·L-1时,细胞干质量值最大(0.153 g),细胞的生长最旺盛,下降速度较为缓慢。而在6-BA浓度升至0.4 mg·L-1时,细胞干质量有所下降,而且在达到最高峰时,细胞干质量急剧下降,可能是由于高浓度的细胞分裂素加速了细胞死亡[15]的原因。
不同2,4-D浓度对细胞生长的影响呈现先升高后降低的趋势(图1)。在培养9 d时,2,4-D浓度为0.4 mg·L-1时细胞干质量开始下降,但下降速度较为缓慢。在12 d时,其他3个浓度下的细胞干质量均达到峰值,但0.6 mg·L-1时 2,4-D 的细胞干质量最大(0.14 g),1.0 mg·L-1时细胞干质量最低,说明2,4-D浓度过高时,会抑制细胞增殖。
综上所述,长叶点地梅悬浮细胞培养的最佳激素为0.3 mg·L-16-BA,应在12 d之前获取细胞材料,以保持良好的细胞分裂能力。
2.2 不同蔗糖浓度下对碳源的消耗规律
在MS液体培养基中加入0.3 mg·L-16-BA,培养12 d时获取新鲜细胞测量干质量。液体培养基中的蔗糖首先被迅速水解为等分子的葡萄糖和果糖,然后被细胞吸收利用(图2)。当蔗糖浓度为1%时,蔗糖迅速水解,在3-12 d期间葡萄糖和果糖等活性糖的含量不断减少,培养12 d时,几乎被完全利用,易使长叶点地梅悬浮细胞处于碳源饥饿状态,不能充分满足甚至限制细胞的生长。随着蔗糖浓度的增加,当浓度达到3%时,在悬浮培养0-3 d,细胞生长处于迟滞期,蔗糖水解为活性多糖积累较慢,进入6-12 d,细胞生长处于对数期,活性糖的积累较多,之后下降缓慢,但到30 d时活性糖的量仍很多,说明培养基中的碳源能够很好地供细胞生长,当蔗糖浓度达到4%时,活性糖的积累量减少,蔗糖水解速度减慢。
过低和过高的蔗糖浓度都不利于活性多糖的积累,较低或较高的蔗糖浓度,影响培养液的渗透压,致使细胞增殖率较低,这可能与长叶点地梅的细胞内还原糖的积累和代谢水平有关。当蔗糖浓度为2%时,细胞生长状态最佳,干质量值接近于蔗糖浓度3%的干质量值(图3A),因此,总体来说,当接种量为1 g时,长叶点地梅细胞悬浮培养的最佳蔗糖浓度为2%。
2.3 摇床转速对细胞生长的影响
当摇床转速为105 r·min-1时,细胞干质量最大(0.150 g);转速为 125 r·min-1时,细胞部分死亡,三角瓶中的液体培养基变浑浊,干质量有所下降(图3B)。所以,长叶点地梅愈伤悬浮培养的最佳摇床转速为 105 r·min-1。
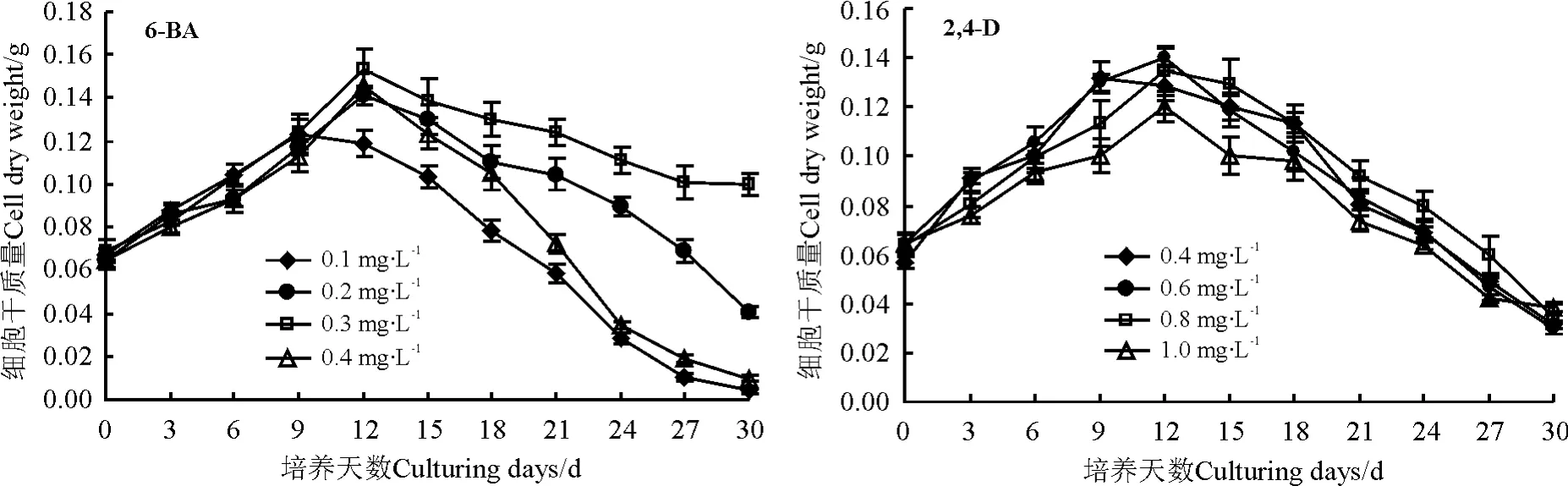
图1 不同6-BA和2,4-D浓度对悬浮细胞干质量的影响Fig.1 Effects of different 6-BA and 2,4-D concentrations on cell dry weight in suspension cultures
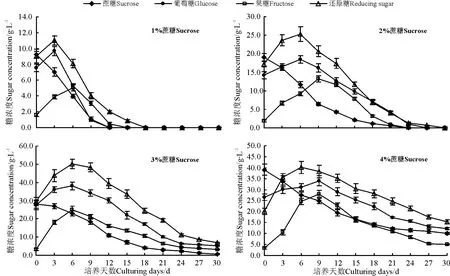
图2 不同起始蔗糖浓度下细胞外各种糖的变化Fig.2 Concentration changes of different sugar outside the cell in cell suspension cultures at various initial sucrose concentrations
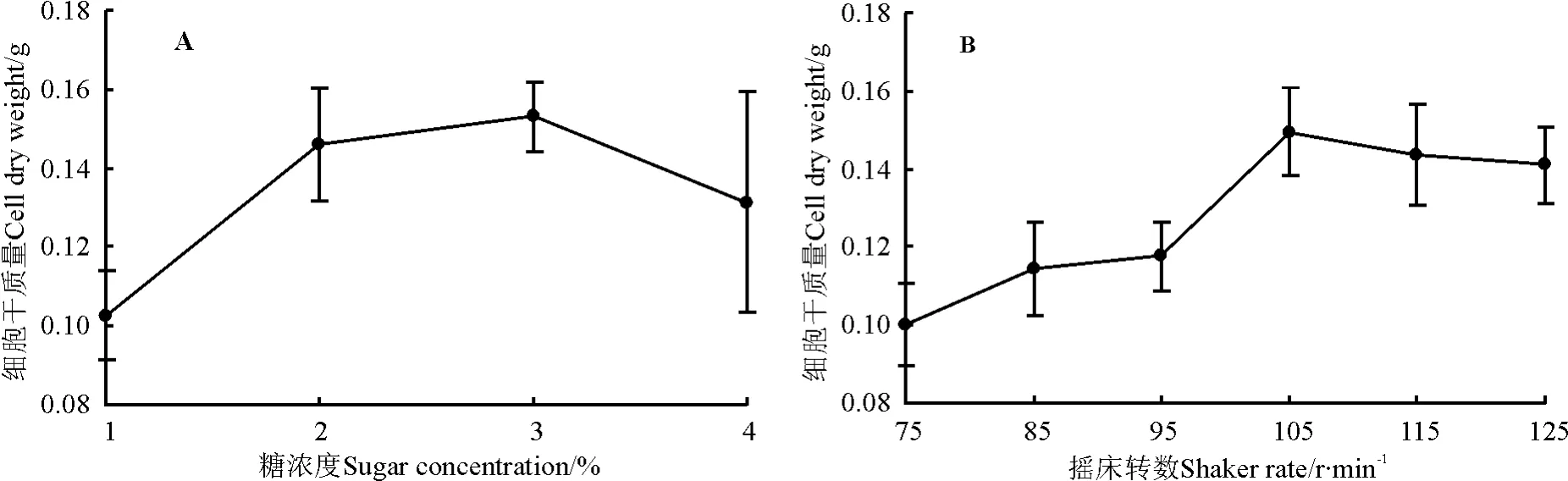
图3 不同蔗糖浓度(A)和摇床转数(B)对细胞干质量的影响Fig.3 Effects of sucrose concentrations(A)and shaker rate(B)on the cell dry weight in cell suspension cultures
2.4 培养液pH及电导率、细胞干质量的测定
MS液体培养基中附加2%蔗糖、0.3 mg·L-16-BA,接种1 g愈伤组织,摇床转速为105 r·min-1,定期测定培养液pH及电导率,12 d后测细胞干质量。
在整个生长周期中,长叶点地梅细胞培养液的pH呈先下降后缓慢上升的变化趋势(图4A),曲线近似“V”字形变化。灭菌前培养基的pH为5.4,可能由于灭菌过程中培养基中的水分散失的原因,灭菌后pH下降到5.32。在细胞悬浮培养的0-12 d,细胞生长处于延滞期,pH由起始的5.32降至4.01,在13-21 d时,pH开始回升,之后pH虽呈波动性变化,但总体上基本保持稳定,可能细胞自身的调节能力起到一定作用,这种调节作用是有限的,超过这个限度就会对细胞分裂生长起到抑制作用,不利于细胞生长。一方面pH的“V”形变化可能与植物细胞对离子的吸收先后有关,植物细胞优先利用培养液中的NH4+,使pH迅速下降,随后再利用NO3-,导致pH逐渐回升,另一方面细胞在从培养液中吸收营养物质的同时,还会释放出一些代谢产物,如生物碱、氨基酸等,这些都会导致培养液pH呈波动性变化。由于pH值的升降影响了细胞质膜的电位、通透性及细胞内外物质的交换,从而控制了细胞的生长[16]。
电导率可在一定程度上反映出液体培养基中的离子总量,因此,从溶液电导率的升降程度可以了解营养物质消耗的情况及细胞生长状态。在0-15 d,细胞悬浮培养过程中随着细胞数量的增加,溶液的电导率呈下降趋势。在15 d左右,培养液的电导率达到最低(图4B)。
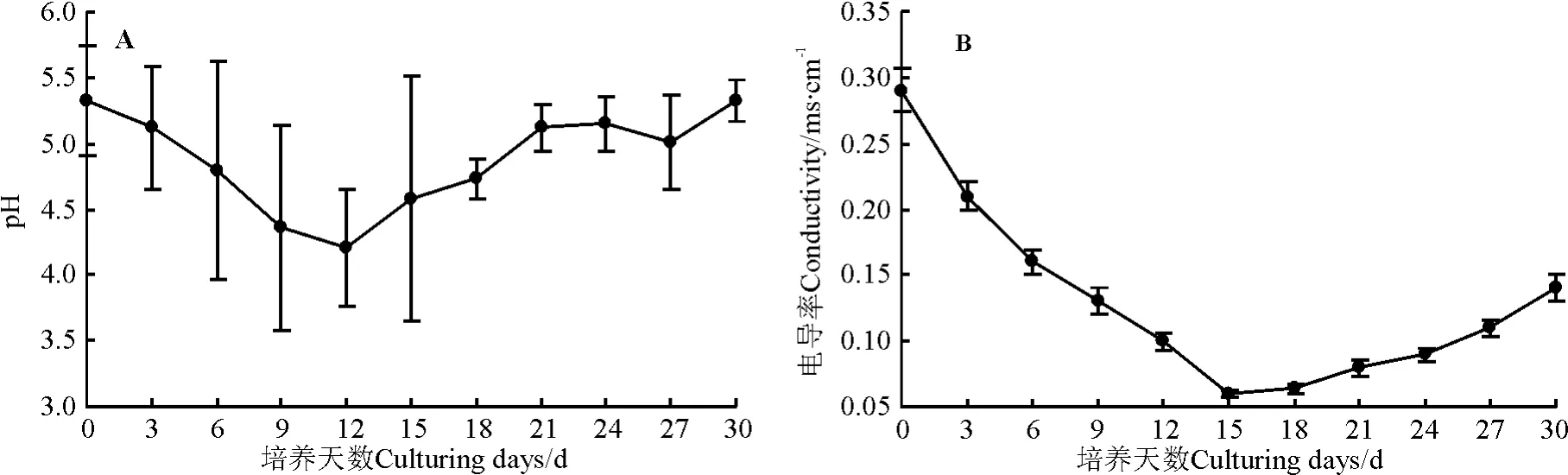
图4 不同时期细胞悬浮培养液pH值(A)和电导率(B)变化Fig.4 Variations of p H values(A)and conductivity(B)in cell suspension cultures during different cell growing period
长叶点地梅细胞悬浮生长的干质量曲线近似“S”形,开始的0-3 d,细胞生长处于迟滞期,分裂速度较慢,加之细胞对新环境的适应,可能有小部分死亡,细胞干质量下降;4-12 d细胞处于对数生长期,生长速度和细胞数量大幅度提高;12 d以后,细胞干质量开始呈下降趋势,导致这种现象的原因可能是蔗糖的消耗和次级代谢物质中有害物质的积累,不利于细胞生长,导致细胞开始死亡,在30 d时,细胞已经大量死亡,干质量下降(图5)。因此,长叶点地梅悬浮细胞的最佳获得时间为12 d左右。
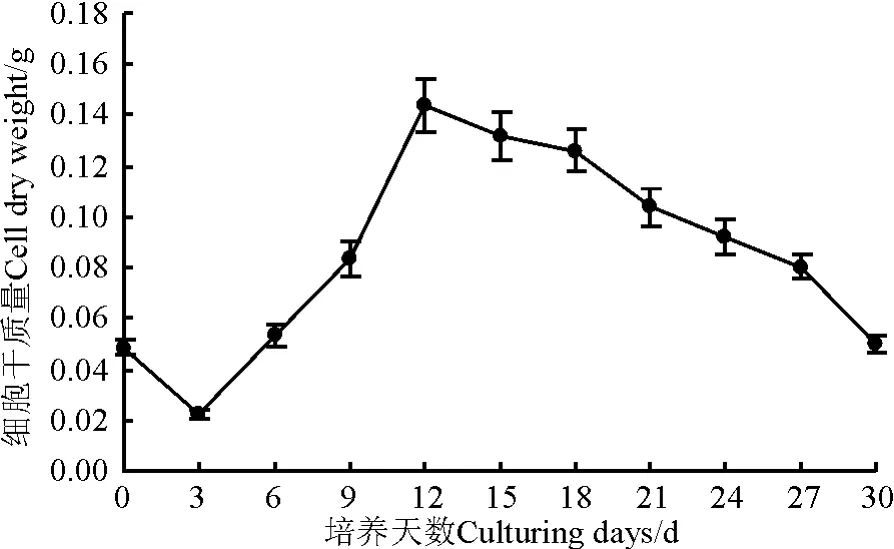
图5 细胞悬浮培养不同生长时期细胞干质量的变化Fig.5 Changes of cell dry weight in suspension cultures during cell growing period
3 讨论
植物材料在同等条件下的液体培养基和固体培养基中的生长状态不同。在液体培养基中细胞能与营养物质的接触面积更充分,但气体交换能力相对固体培养较弱,因此,对愈伤组织质量、接种量、激素浓度、蔗糖浓度、摇床转速等要求不同。本研究表明,低浓度碳源虽有利于加快细胞增殖的速度,但不能使细胞达到最佳状态,高浓度的碳源会抑制细胞的增殖,长叶点地梅愈伤悬浮培养的最佳蔗糖浓度为2%。不同的植物种类悬浮培养所用的激素种类和浓度差异很大,夜香牛(Vernonia cinerea)在基本培养基中加3%的蔗糖、1.0 mg·L-1NAA 和0.1 mg·L-1BA时培养4周后获得的生物量最高(9.85 g)[17]。本研究比较了 2,4-D 和 6-BA,0.3 mg·L-1的6-BA更有利于细胞增殖。新鲜愈伤在液体培养基中进行悬浮培养时,细胞的分散程度与摇床的转速有关,摇床的转速也会对细胞的增殖产生影响,转速太慢细胞不能够形成均匀的分散系,转速过快摇床产生的剪切力会破坏细胞,因此,适宜的转速也是影响细胞生长的因素之一。但不同植物细胞对摇床转速要求不同,如石榴悬浮培养摇床转速110 r·min-1[18]。摇床的转速影响了细胞增殖,但相对其他因素,其作用效果很小,一般转速控制在90~120 r·min-1[19],但有的植物要求转速较低,如野生草珊瑚(Sarcandra globra)的悬浮细胞在100 r·min-1速度下几乎不能存活,最佳的摇床转速为40 r·min-1[20]。长叶点地梅细胞悬浮培养的最佳摇床转速为 105 r·min-1。
长叶点地梅悬浮细胞培养体系的研究为进一步完善点地梅再生体系建立、次生代谢生产和逆境因子研究等奠定了基础,同时,为利用生物工程技术从点地梅属植物中获取有效药用成分、缓解天然资源压力提供新的研究思路。
[1]何希瑞,魏桂芳,姚宏,常育,徐磊,张春玲.点地梅属植物化学成分与药理活性研究进展[J].中国实验方剂学杂志,2012,18(11):296-299.
[2]李承花,殷志琦,黄晓君,王磊,叶文才.点地梅的化学成分[J].中国天然药物,2008,6(2):123.
[3]雷军,肖云川,王文静,席贞,余敏,黄静.点地梅中的黄酮苷成分[J].中国中药杂志,2011,36(17):2353.
[4]王文静,雷军,肖云川,席贞,余敏,黄静.点地梅中双黄酮类化学成分的分离和鉴定[J].华西药学杂志,2011,26(5):420.
[5]Dong W,Liu X,Li X,Yang D,Ding L.A new triterpene saponin from Androsace intega[J].Fitoterapia,2011,82(5):782-785.
[6]Park J,Kwak J,Khoo J,Park S,Kim D,Ha D,Choi S,Kang S,Zee O.Cytotoxic effects of triterpenoid saponins from Androsace umbellata against multidrug resistance(MDR)and non-MDR cells[J].Archives of Pharmacal Research,2010,33(8):1175-1180.
[7]Wang Y,Zhang D,Ye W,Yin Z,Fung K,Zhao S,Yao X.Triterpenoid saponins from Androsace umbellata and their anti-proliferative activities in human hepatoma cells[J].Planta Medica,2008,74(10):1280-1284.
[8]Zhang D,Wang Y,Tang M,Chan Y,Lam H,Ye W,Fung K.Saxifragifolin B from Androsace umbellata induced apoptosis on human hepatoma cells[J].Biochemical and Biophysical Research Communications,2007,362(3):759-765.
[9]黄先丽,王晓静,贾献慧.点地梅的挥发油成分分析[J].食品与药品,2009,11(3):37.
[10]李朋军,沈伟哉,叶文才,张冬梅,孙艳.点地梅提取物saxifragifolin B体外抗实体瘤活性研究[J].中国病理生理杂志,2011,27(5):838.
[11]栾宏庆.点地梅治疗咽喉炎72例[J].甘肃中医学院学报,1994,11(4):28.
[12]林顺权.植物细胞工程[M].厦门:厦门大学出版社,2000:40.
[13]张彦妮,陈素波.长叶点地梅愈伤组织诱导和植株再生[J].草业科学,2012,29(6):931-936.
[14]夏启中.棉花悬浮细胞系的建立及其培养细胞的程序性死亡的观察研究[D].武汉:华中农业大学,2005
[15]吕华,赵群华,曹日强,夏仲豪.固定化培养和产物释放促进剂对硬紫草细胞代谢的影响[J].植物生理学报,1995,21(2):111-116.
[16]Meiger E,Broughton W.Regeneration of whole plants from hypocotyl-,root-,and leaf-derived tissue cultures of the pasture legume Stylosanthes guyanensis[J].Physiologia Plantarum,1981,52(2):280-284.
[17]Maheshwari P,Songara B,Kumar S,Jain P,Srivastava K,Kumar A.Alkaloid production in Vernonia cinerea:Callus,cell suspension and root cultures[J].Biotechnology Journal,2007,2(8):1026-1032.
[18]程江华.石榴愈伤组织的诱导和细胞悬浮培养体系的建立[D].合肥:安徽农业大学,2009.
[19]Lee W,Chan L.Establishment of Orthosiphon stamineus cell suspension culture for cell growth[J].Plant Cell,Tissue and Organ Culture,2004,78:101-106.
[20]涂艺声,王碧琴,江洪如,奚昕,丁建南.不同色光、温度、pH对草珊瑚愈伤组织的培养效应[J].江西科学,1994(2):85-89.
