SQR 基因在Nisin 抗性乳酸乳球菌中的表达
2014-12-23于建宁潘伟芹王公金徐小波于峰祥
于建宁, 潘伟芹, 王公金, 徐小波, 李 燕, 于峰祥
(1.江苏省农业科学院畜牧研究所,江苏 南京210014;2.南京师范大学医学分子生物学重点实验室,江苏 南京210097)
随着畜牧产业的快速发展,养殖场规模的不断扩大,畜禽粪便产生的废气(H2S、NH3等)已经成为不容忽视的空气污染源,如何使这些废气无害化是保证环境友好型养殖业健康发展的必要条件之一。然而,目前只能采用吸附法、焚烧法或使用除臭剂等,这些方法一定程度上降低了废气对环境的污染,但还不能做到无害化。所以探求一种废气无害化处理方案很有必要。
硫化物-醌氧化还原酶[1](SQR)是一种黄素蛋白质,存在于一些必须依靠硫化物作为氢供体生长的光合化能自养菌中,SQR在蓝细菌、颤藻属和光合细菌荚膜红杆菌中已被深入研究,发现其具有分解硫化氢为厌氧光合细菌提供氢的特征[2-3]。乳酸菌是人和动物肠道中极为重要的益生菌,随着乳酸菌的各种表达调控元件的成功分离,使得乳酸菌成为较理想的转基因工程受体菌[4-10]。抗性基因NisⅠ作为筛选标记筛选乳酸乳球菌转化子是最早研究的乳酸菌食品级抗性筛选标记系统。芬兰赫尔辛基大学Takala 等[11]在2002 年构建了食品级克隆载体pLEB590,整个载体全部由乳酸乳球菌的片断构成:pSH71 复制子、NisⅠ基因、组成型启动子P45(控制NisⅠ的表达),将此载体电转化乳酸链球菌素(Nisin)敏感的乳酸乳球菌MGl614,以60 IU/ml 的nisin作为筛选浓度,1 μg DNA 可以得到105 个转化子,且在nisin 的选择压力下,pLEB590 可以在乳酸乳球菌MGl614 稳定存在。同时食品级表达载体pLEB590 已经成功地电转化入带有多个隐蔽型质粒的发酵干酪工业菌株(Lactobacillus casei),而且应用此载体已经成功地在植物乳杆菌中表达了来自瑞士乳杆菌(Lactobacillus brevis)的脯氨酸亚氨基肽酶基因(pepI)[11]。这些研究结果表明,载体pLEB590 可以应用于食品级表达系统来表达外源基因以应用于食品工业。
本研究拟构建携带SQR基因的重组表达载体,将其转入乳酸菌,鉴定其表达SQR的功能,为下一步开展SQR转基因乳酸菌微生态制剂的研制,以及有效解决畜禽养殖过程中H2S 等硫化物的排放问题提供关键技术支撑。
1 材料与方法
1.1 试验材料
大肠杆菌DH5a、乳酸乳球菌MG1363(Lactococcus LactisMG1363)、表达载体pMG36e 与质粒pcDNA3.1-SQR-Myc均由本实验室保存。大肠杆菌DH5a 培养采用LB 培养基,37 ℃振荡培养;乳酸菌MG1363 采用GM17 培养基,30 ℃静止培养。红霉素在大肠杆菌DH5a 和乳酸菌MG1363 培养中的浓度分别是250 μg/ml 和10 μg/ml。
T4 DNA 连接酶、DL5000 Marker、限制性内切酶、胶回收试剂盒及PCR 相关试剂均购自大连Takara 公司,电击杯为Bio-Rad 产品。抗Myc 的小鼠一抗、辣根过氧化物酶偶联的羊抗小鼠二抗购于天根公司。SDS-PAGE 所需生化试剂均购自上海生工公司。
1.2 重组质粒pLEB590-SQR 的构建
1.2.1SQR基因的扩增 提取质粒pcDNA3.1-
SQR:将本实验室保存的pcDNA3.1-SQR菌种进行扩大培养,按照常规方法快速提取质粒备用。PCR 扩增SQR片段:上游引物序列P1 为5'-CGGGATC CAAGTAGAAGATGGCTCATATCG-3', 下 划 线 部 分为BamH I 酶切位点,下游引物P2 为5'-GCTCTAGAGGCACAGTCGAGGCTGAT-3',下划线部分为XbaI酶切位点,PCR 反应为50 μl 反应体系。
1.2.2 回收的SQR片段TA 克隆至T 载体 对PCR 扩增片段回收产物(SQR片段)进行3'端加A反应,72 ℃保温10 min。在离心管中配制DNA 溶液(pMD18-T 1 μl,DNA 2 μl,溶液I 5 μl,双蒸水2 μl),16 ℃反应30 min。反应结束后将上述10 μl溶液全部加入至感受态细胞中,冰上放置10 min。42 ℃热激45 s 后,再在冰上放置1 min。加入890 μl 培养基,37 ℃振荡培养60 min。在含有X-Gal、IPTG、Amp 的琼脂平板培养基上37 ℃培养过夜。
1.2.3 pMD18-T-SQR的鉴定 挑取单克隆菌株于3 ml 试管摇菌过夜,小量提取质粒进行XbaI 与BamH I 双酶切鉴定,37 ℃作用1 h,反应结束后,取5 μl 反应产物在1 %琼脂糖凝胶上进行电泳观察。
1.2.4 表达载体pLEB590 的大量提取 根据分子克隆实验指南[12],并参考质粒大量提取试剂盒(天根公司)说明书,进行操作,获得的质粒保存于双蒸水中。
1.2.5BamHI 和XbaI 酶切载体pLEB590 和回收的PCR 产物 pLEB590 酶切体系如下:pLEB590 5.0 μl,XbaI、BamH I 各1.0 μl,10 倍缓冲液1.5 μl,双蒸水21.5 μl,共计30.0 μl。PCR 产物SQR酶切体系如下:SQR5.0 μl,XbaI、BamH I 各1.0 μl,10 倍缓冲液1.5 μl,双蒸水21.5 μl,共计30.0 μl。
1.2.6 胶回收载体pLEB590 和目的片段SQR按照胶回收试剂盒说明书进行操作。
1.2.7 载体pLEB590 与SQR连接 根据测定的回收载体pLEB590 和目的片段SQR的浓度,将载体与目的片段按一定比例连接,即pLEB590 10 μl,SQR5 μl,10 倍T4 DNA 连接酶缓冲液2 μl,T4 DNA 连接酶1 μl,双蒸水2 μl,共计20 μl 反应体系。
1.2.8 连接产物纯化 将数个连接反应管中的反应液合并至一个管内,加入3 倍体积的PCR-A 缓冲液;混匀后转移到制备管中,12 000g离心1 min,弃滤液。将制备管置回2 ml 离心管,加700 μl 缓冲液W2,12 000g离心1 min,弃滤液;加400 μl 缓冲液W2,12 000g离心1 min。将制备管置于洁净的1.5 ml 离心管中,在制备管中央加 25 ~30 μl 双蒸水,室温静置1 min,12 000g离心1 min 洗脱DNA。
1.3 重组质粒pLEB590-SQR 在乳酸乳球菌中的表达
1.3.1 乳酸乳球菌的感受态制备 挑取乳酸乳球菌MG1363 单菌落,在3 ml GM17 培养基中培养过夜。将过夜培养物按5 %接种量加入到含1 %甘氨酸的SGM17 培养基中,30 ℃培育6 h(OD值约为0.8)。冰浴使细菌停止生长,4 ℃ 5 000g离心10 min,弃上清,用冰预冷的洗涤液洗3 次,以去除培养基中的离子成份。用冰冷的原体积5 %电击缓冲液重悬菌体,放置10 min,每管100 μl 分装。
1.3.2 乳酸菌的电击转化 取10 μl 纯化连接产物与感受态MG1363 混合,冰浴10 min,电击。电击参数如下:电压2 kV,电容25 μF,电阻400 Ω。30℃复苏培养2 ~3 h 后,将其涂布在含有40 IU/ml Nisin 的GM17 平板上,培养1 ~2 d。
1.3.3 重组质粒鉴定 双酶切鉴定:挑取单菌落进行液体扩培,利用质粒小提试剂盒进行质粒提取。随后进行重组质粒XbaI 与BamH I 双酶切,30 ℃作用30 min 后,37 ℃水浴作用1 h。反应结束后,取5 μl 反应产物于1 %琼脂糖凝胶上进行电泳观察鉴定。重组质粒PCR 鉴定:根据SQR序列设计引物P3 与P4,P3 为5'-GGTTTGGGCGGTGCCATCAT-3',P4 为5'-CCCTTCTTCACGGCCTTCAGC-3'。PCR 反应体系为:Taq酶预混液12.5 μl,上下游引物各0.5 μl,重组质粒1.0 μl,双蒸水10.5 μl,共计25.0 μl。反应结束后取3 μl PCR 产物进行1 %琼脂糖电泳。
1.3.4 重组质粒pLEB590-SQR-MG1363 质粒遗传稳定性检测
1.3.4.1 pLEB590-SQR-MG1363 生长迟滞期及世代时间的测定 取1 ml 菌液于100 ml GM17 培养基中混匀,分装于10 ml 试管中,每个试管2 ml,30 ℃静置培养。每1 h 取3 个试管测菌液OD600值,并将菌液稀释一定倍数,接种于GM17 平板,30℃培养24 h,计算活菌数(CFU/ml)。以培养时间为横坐标,所测菌液OD600值为纵坐标绘制pLEB590-SQR-MG1363 生长曲线图。取对数生长期中的一段按以下公式计算世代时间,G=(t1-t0)ln2/(lnxlnx0),式中G为世代时间,t1为培养时间,t0初始培养时间,x0为开始时的活菌数,x为经t时间培养后的活菌数。
1.3.4.2 pLEB590-SQR-MG1363 遗传稳定性测定从不含nisin 的平板上选取100 个单菌落点种于含nisin 的平板上,最后长出的菌落数即为质粒稳定率。具体测定过程如下:从原代菌株平皿挑取单菌落于含40 IU/ml nisin GM17 的GM17 液体培养基中,培养过夜。第2 d 按1 %的接种量接种于含nisin 和不含nisin 的GM17 液体培养基中30 ℃静置培养。每隔10 代(9 h)转管,获得不同代数的菌液。分别取10 ~150 代的菌液适量按一定倍数稀释后,涂布于不含nisin 的GM17 平板,30 ℃培养24 h。分别挑取100 个单菌落点种于相应含nisin 的平板,30℃培养过夜,计算工程菌MG1363 在有、无nisin 选择压力传代质粒的丢失率。
1.3.5 重组质粒pLEB590-SQR在乳酸乳球菌MG1363 中的表达 收集菌体,用双蒸水洗2 次,加入终浓度10 mg/ml 溶菌酶100 μl,37 ℃消化30 min。加100 μl 2×上样缓冲液,100 ℃反应5 min,高速离心后用于SDS-PAGE 电泳。Western blot 分析:SDSPAGE 电泳结束后,取出凝胶。将PVDF 膜在甲醇中浸湿15 s,在双蒸水中浸泡2 min,然后转移到湿转液中。将在转移缓冲液中浸泡的胶与PVDF 膜放入转印夹中,接好转印装置并将其放入冰水中,300 mA,90 min。转膜结束后,将PVDF 膜放于5%脱脂奶粉中封闭,室温摇动2 h。一抗1 ∶1 000 稀释过夜,TBST 洗涤10 min,共洗3 次;二抗1 ∶500 稀释,室温摇动2 h,TBST 洗涤10 min,共洗3 次,ECL 显色。
2 结果
2.1 重组质粒pLEB590-SQR 的构建
以提取的质粒pcDNA3.1-SQR为模板,以引物P3、P4 进行PCR 反应,扩增得到大约1 400 bp 片段(图1),与预期片段长度相符。
将PCR 扩增到的SQR基因片段与pMD18-T-载体连接后转化E.coliDH5α,在含有Amp、IPTG 和X-gal 的LB 平板上进行蓝白筛选,含有插入目的片段的转化子呈现白色菌落,只转入空载体的大肠杆菌呈现蓝色,随机挑取几个白色菌落接种到5 ml LB液体培养基(100 μg/ml Amp),37 ℃培养过夜后提取质粒进行酶切鉴定。如图2 所示,可见已经成功将SQR片段连接入pMD18-T 载体中。

图1 PCR 扩增SQR 产物的琼脂糖凝胶电泳图Fig.1 Agarose gel electrophoresis of SQR amplified by PCR

图2 pMD18-T-SQR 质粒酶切电泳图Fig.2 Electrophoresis of pMD18-T-SQR digested by enzymes

图3 pLEB590-SQR 双酶切鉴定Fig.3 Identification of pLEB590-SQR digested with two enzymes

图4 pLEB590-SQR PCR 扩增产物Fig.4 PCR amplification of PLEB590-SQR
2.2 重组质粒pLEB590-SQR 在乳酸乳球菌MG1363 中的鉴定与表达
挑取含有40 IU/ml nisin 的GM17 平板上菌落,提取质粒进行双酶切鉴定。结果(图3)显示,重组质粒用BamH I 和XbaI 酶切后得到1 条 3 100 bp 的载体片段和1 个 1 400 bp 的目的片段。以pLEB590-SQR为模板扩增SQR内部片段,得到1 200 bp 片段(图4)。
提取转化前后乳酸乳球菌中的蛋白质,进行SDS-PAGE 电泳(图5),1 泳道为阴性对照,2、3 泳道为pLEB590-SQR-MG1363 阳性菌株,可见在分子量5.0×104下方有一特异条带,与SQR基因表达产物分子量一致,约 4.8×104。提取乳酸菌表达的蛋白质进行Western blot 杂交试验(图6),1 泳道为MG1363 阴性,无特异条带,2、3泳道为阳性pMG36e-SQR-MG1363,在分子量5.0×104下方有特异条带,表明乳酸菌中表达了目的蛋白质SQR(约4.8×104)。

图5 pLEB590-SQR 表达蛋白质的SDS-PAGE 电泳图Fig.5 SDS-PAGE of pLEB590-SQR expressed proteins

图6 Western blot 检测MG1363 中SQR 的表达Fig.6 SQR expression in MG1363 detected by Western blot
2.3 乳酸菌遗传稳定性分析
以培养时间为横坐标、菌数的OD600值为纵坐标绘制pLEB590-SQR-MG1363 的生长曲线(图7),从该曲线可以看出pLEB590-SQR-MG1363 的生长延滞期为2 h。再从曲线的对数生长期段上任取2个时间,本次取对数期的3 h、5 h 菌液按 10-7~10-8稀释菌液涂板,得出3 h 菌落数为 6×108CFU/ml,5 h 菌落数为4.2×109CFU/ml。根据公式G=(t1-t0)ln2/(lnx-lnx0)计算世代时间G=43 min。由以上结果可得出pLEB590-SQR-MG1363 从开始培养到传代10 次所需要的时间为:10G+t1=9 h。
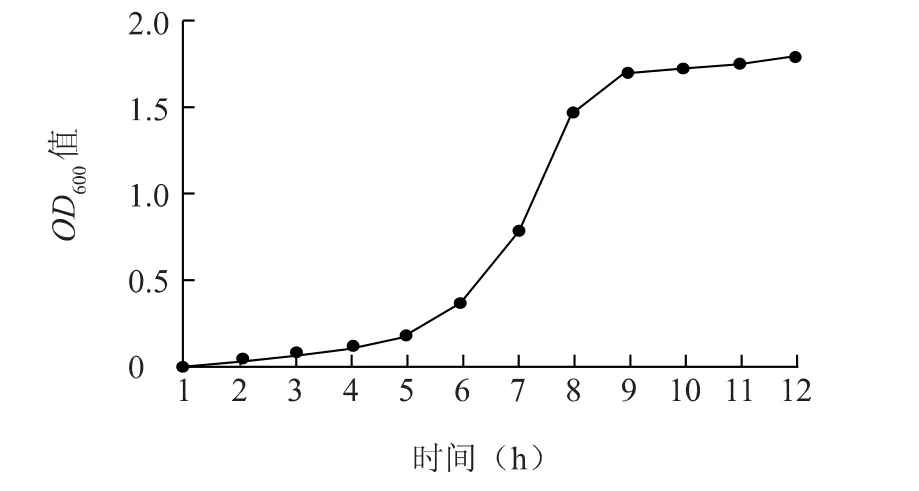
图7 乳酸菌pLEB590-SQR-MG1363 生长曲线图Fig.7 The growth curve of pLEB590-SQR-MG1363
将pLEB590-SQR质粒的乳酸乳球菌MG1363连续培养150 代,在有、无nisin 选择压力下质粒稳定率都在91 %以上(图8)。结果表明,pLEB590-SQR在乳酸乳球菌MG1363 中具有较好的遗传稳定性,并且稳定性不受nisin 影响。

图8 pLEB590-SQR-MG1363 在有、无选择压力下的遗传稳定率Fig.8 Genetic stability of pLEB590-SQR in MG1363 with and without nisin
3 讨论
近十余年来,国内外科学家对SQR基因的序列结构及其降解硫化物的生物功能进行了系统的研究,取得显著进展。Shütz 等[2]从红荚膜杆菌中分离纯化出SQR,并将SQR基因成功克隆于大肠杆菌,表达出具有生物酶活性的SQR。Bronstein 等[13]也得到相似的研究结果。本试验也将SQR成功导入大肠杆菌中并获得表达。但由于大肠杆菌还含有一些毒蛋白质且容易形成包涵体,表达产物需要一系列纯化复性过程,再加上大肠杆菌为非食用菌,不利于后期制作微生态制剂用于动物实验。为此,我们利用乳酸菌能够表达外源蛋白质的特点,在乳酸乳球菌中表达SQR 蛋白质。在我们的前期研究中,已经成功构建了SQR重组载体pMG36e-SQR[14],并由此获得了表达SQR的乳酸乳球菌MG1363,但需要红霉素进行阳性筛选,对环境易造成二次污染,因此在本试验中构建携带食品级抗性筛选标记的Nisin质粒pLEB590,从SQR质粒构建到表达SQR乳酸菌的筛选及SQR在乳酸菌中的稳定性几个方面研究获得食品级SQR 乳酸菌。
根据SDS-PAGE 电泳图可以看出在5.0×104处有目的蛋白质,Western blot 杂交检测也证实了SQR在乳酸乳球菌MG1363 中的表达。Takala 等[11]用pLEB590 在乳酸乳球菌和植物乳杆菌中表达了来源于瑞士乳杆菌中的pep I基因,其表达的目的蛋白质浓度是原菌株的200 倍。罗立新等[15]将小鼠的mCu/ZnSOD基因与 pLEB590 重组,在宿主菌MG1464 中进行表达,结果该基因可以在宿主菌中进行活性表达,但是表达量较低。pLEB590 载体中目的蛋白质与食品级载体启动子相距较远,其表达量与RBS 位点碱基种类、数量以及与起始密码子AUG 之间的距离都有很大关系。本试验SQR表达量介于两者之间。蛋白质的差异表达可能与基因以及所用的宿主乳酸菌种类亦有一定的关系。
本试验结果表明,我们已经成功获得了遗传稳定性好的携带SQR质粒的食品级乳酸乳球菌。汪川等[16]研究结果表明,质粒pMG36e 在有、无红霉素压力下在乳酸乳球菌MG1363 中均能保持质粒的稳定性。范硕等[17]将质粒pLEB590 电转入植物乳杆菌Lact2 中,在300 U/ml nisin 的MRS 培养基中连续转接30 代,提取质粒进行鉴定,结果仍含有质粒,说明在有nisin 选择压力下,菌株能够保持外源质粒的遗传稳定性;而含有pLEB590 的植物乳杆菌Lact2 在无nisin 的液体MRS 培养基中,连续培养3代质粒丢失,说明在没有nisin 的压力下,质粒pLEB590 很容易丢失。本试验检测重组乳酸菌pLEB590-SQR-MG1363 的遗传稳定性,在40 U/ml nisin GM17 培养基中传代150 次,稳定性在96%以上,在无nisin 的选择压力下质粒保持其遗传稳定性91%,说明乳酸乳球菌MG1363 能够保持质粒遗传稳定性。如何提高SQR在乳酸乳球菌中的表达量将是以后的研究重点,虽然SQR已经成功表达,但是否具有生物酶活性,能否有效降解畜禽粪便中的硫化物还有待进一步研究。
[1] SHAHAK Y,ARIELI B,PADAN E,et al.Sulfide quinone reductase (SQR)activity in chlorobium[J].FEBS Lett,1992,299(2):127-130.
[2] SHÜTZ M,SHAHAK Y,PANDAN E,et al.Sulfide-quinone reductase fromRhodobacter capsulatus[J].J Biol Chem,1997,272(15):9890-9894.
[3] REINARTZ M,TSCHAPE J,BRUSER T,et al.Sulfide oxidation in the phototrophic sulfur bacteriumChromatium vinosum[J].Arch Microbiol,1998,170(1):59-68.
[4] 徐义刚,崔丽春.乳酸杆菌基因表达系统的研究进展[J].微生物学杂志,2007,27(3):87-91.
[5] DE VOS W M.Gene expresion systems for lactic acid bacteria[J].Curr Opin Microbiol,1999,2(3):289-295.
[6] 赵 莹,孙 哲,刘 燕,等 酸性纤维素酶CBH II基因与非抗性穿梭表达载体的重组及在乳酸杆菌的表达及其活性检测[J].畜牧兽医学报,2009,40(5):670-675.
[7] 赵 丹.基因工程乳酸菌保护效果检测及其在雏鸡盲肠内定植的研究[D].长春:吉林农业大学,2007.
[8] 潘伟芹,于建宁,王公金,等.SQR 基因在大肠杆菌和乳酸菌中的表达[J].江苏农业学报,2012,28(1):131-134.
[9] 韩 梅,徐致远,沈 玲,等.褐色乳酸茵饮料的研制[J].江苏农业科学,2013,41(7):243-245.
[10] 云月英,王文龙,王雅娟.耐酸乳酸菌的筛选及初步鉴定[J].江苏农业科学,2013,41(1):256-259.
[11] TAKALA T M,SARIS P E.A food-grade cloning vector for lactic acid bacteria based on the nisin immunity gene nisI[J].Appl Microbiol Biotechnol,2002,59(4-5):467-471.
[12] 萨姆布鲁克J,拉塞尔D W.分子克隆实验指南[M].3 版.黄培堂,译.北京:科学出版社,2002:32.
[13] BRONSTEIN M,SCHÜTZ M,HAUSKA G,et al.Cyanobacterial sulfide-quinone reductase:cloning and heterologous expression[J].J Bacteriol,2000,182(12):3336-3344.
[14] 潘伟芹,于建宁,王公金,等.SQR基因在大肠杆菌和乳酸菌中的表达[J].江苏农业学报,2012,28(1):131-134.
[15] 罗立新,王 成,施周铭.一种新型食品级表达载体pLEB590表达小鼠mCu/ZnSOD 的初步研究[J].食品与发酵工业,2009(2):22-26.
[16] 汪 川,张朝武,杜 江,等.表达型质粒载体pMG36e 在宿主菌中的遗传稳定性研究[J].卫生研究,2005,34(2):214-216.
[17] 范 硕.植物乳杆菌的分离鉴定及其作为食品级基因工程受体菌的特性研究[D].北京:中国农业大学,2007.
