免疫增强剂对禽流感疫苗免疫持续期、安全性和鸡淋巴细胞转化的影响
2014-12-23唐应华陆吉虎吴培培查国飞刘振兴侯继波
唐应华, 陆吉虎, 吴培培, 查国飞,4, 刘振兴,2, 陈 辉, 侯继波
(1.江苏省农业科学院国家兽用生物制品工程技术研究中心/农业部兽用生物制品工程技术重点实验室,江苏 南京210014;2.南京农业大学动物医学院,江苏 南京210095;3.南京天邦生物科技有限公司,江苏 南京211102;4.安徽农业大学动物科技学院,安徽 合肥230036)
H5 和H9 亚型禽流感灭活油乳剂疫苗在中国禽流感防控中发挥了重大作用,但现有疫苗质量有待进一步提高,如加速抗体产生、延长免疫持续期等。在临床生产中,种禽或蛋禽的生产周期内,需要多次免疫,每增加一次免疫均对动物带来较大应激,影响生产性能,同时也增加人力成本,临床生产中亟需一种佐剂能有效延长疫苗免疫持续期。
免疫增强剂与疫苗共同使用,具有较好的协同效应,可以提高疫苗抗原的免疫效力,延缓抗原的释放等。人用流感疫苗免疫增强剂MF59 已经在欧洲应用多年[1],美国FDA 也已批准[2]。葛兰素史克公司的人流感疫苗使用AS03 佐剂[3];Intervet 的猪圆环病毒疫苗和繁殖与呼吸综合征病毒疫苗均使用Diluvac Forte 佐剂[4-5];Boehringer 的猪圆环病毒疫苗使用Ingelvac CircoFLEX 佐剂[6];Pfizer 的猪圆环病毒疫苗使用Suvaxyn 佐剂[7];猪支原体疫苗、伪狂犬疫苗和细小病毒疫苗等使用Amphigen 佐剂[8];Seppic 公司的口蹄疫疫苗使用ISA206 佐剂,新城疫疫苗使用ISA70 佐剂[9-10]。
本研究中,我们将筛选的免疫增强剂以不同形式添加至疫苗中,评价免疫增强剂对疫苗免疫持续期和安全性以及对免疫鸡淋巴细胞转化的影响。
1 材料和方法
1.1 病毒、疫苗和检测抗原
H5 亚型禽流感商品疫苗和H5 检测抗原,均购自哈尔滨维科生物技术开发公司。H9 亚型禽流感疫苗由本实验室制备,疫苗毒株和检测用抗原均为A/Chicken/Nanjing/02/2001(H9N2,简称NJ02)。
1.2 鸡
1 日龄商品海兰褐鸡购自海安通榆种鸡场,在普通环境饲养至使用,检测针对H5 或H9 亚型禽流感母源抗体,仅抗体低于2lg2 时用于免疫。无特定病原体(Specific pathogen free,SPF)鸡购自北京梅里亚维通实验动物技术有限公司,养在负压隔离器内,直至使用。
1.3 含免疫增强剂疫苗的配制
含VA5 免疫增强剂疫苗的配制详见专利(申请号201210235427.0)。增强剂的使用形式有2 种,一种以疫苗伴侣形式使用:将免疫增强剂配制成油乳剂疫苗伴侣,使用时将该疫苗伴侣与H5 常规疫苗按体积比为1∶ 9 混合,即为含VA5 免疫增强剂的伴侣疫苗(VA5-H5);另一种是免疫增强剂与H9 疫苗抗原共同混匀形式使用:将免疫增强剂直接添加至抗原溶液中混匀后,制备水相,再与事先制备的油相混匀,制备含免疫增强剂的H9 疫苗(VA5-H9)。
1.4 免疫持续期
选择10 日龄海兰褐蛋鸡,共设4 个免疫组,包括VA5-H5 伴侣疫苗免疫组和H5 常规疫苗免疫组(H5);VA5-H9 共混疫苗免疫组和H9 常规疫苗免疫组。海兰褐蛋鸡均经颈背部皮下免疫,每只鸡注射0.3 ml。另设空白对照组。免疫和空白组每组各20 只鸡。在免疫后第2 周、第3 周、第4 周以及后续每隔2 周采血,其中VA5-H5 和H5 疫苗免疫组检测至免疫后26 周,而VA5-H9 和H9 疫苗免疫组检测至免疫后30 周。分离血清检测血凝抑制抗体效价(HI)。根据H5 疫苗制造规程,设定HI高于或等于7lg2 为合格抗体效价,低于7lg2 为不合格抗体效价。对于H9 疫苗,设定HI高于或等于6lg2 为合格抗体效价,低于6lg2 为不合格抗体效价。
1.5 含免疫增强剂疫苗的安全性检测
1.5.1 单剂量接种安全性 2 批次含免疫增强剂的疫苗(VA5-H9)和常规疫苗(H9)单剂量各免10只鸡,共3 组,每只鸡经颈部皮下注射疫苗0.3 ml。另设不免疫的空白对照组10 只鸡。
1.5.2 双倍剂量接种安全性 2 批次含免疫增强剂的疫苗(VA5-H9)和常规疫苗(H9)双倍剂量各免10 只鸡,共3 组,每只鸡经颈部皮下分两点注射疫苗0.6 ml。另设不免疫空白对照组10 只鸡。
1.5.3 单剂量重复接种安全性 2 批次含免疫增强剂的疫苗(VA5-H9)和常规疫苗(H9)单剂量各免10只鸡,共3 组,每只鸡经颈部皮下注射疫苗0.3 ml。第1 次接种后2 周,按第一次接种方法再次接种,每只鸡颈部皮下注射0.3 ml。另设不免疫空白对照组10 只鸡。上述接种鸡在最后一次注射疫苗后,均观察14 d,详细记录采食饮水等情况。观察期结束后,扑杀5 只,观察注射部位的疫苗吸收情况。再过14 d后将剩下的5 只扑杀,观察疫苗吸收情况。
1.6 鸡淋巴细胞转化
VA5-H9 疫苗和H9 疫苗分别免疫14 日龄无特定病原体SPF 鸡,另设空白对照,每组10 只SPF 鸡。在免疫后第1 d、3 d、5 d、7 d、10 d 放血处死各组2只鸡,无菌分离免疫鸡的脾脏淋巴细胞,于96 孔板每孔加100 μl 1 ml 1 ×106的淋巴细胞,每个样品设置3 个重复,于37 ℃孵育4 h 后,加入25 μg/ml的PHA 刺激培养68 h 后,每孔加入15 μl 浓度为5 mg/ml的MTT,孵育6 ~8 h 后加入50 μl DMSO,于分光光度计上读数,检测OD570值。按每3 个重复样品的平均值计算刺激指数,即疫苗免疫组OD570均值/空白对照组OD570均值。刺激指数与免疫效力呈正相关性,即刺激指数值越高表示免疫效力越好。
2 结果与分析
2.1 添加VA5 免疫增强剂的H9 疫苗的免疫持续期
将免疫增强剂VA5 与H9 抗原共同混匀后,制备疫苗免疫鸡,持续监测抗体效价。含免疫增强剂疫苗免疫后至第6 周一直处于抗体上升期,直至第30 周抗体效价下降至6lg2 以下,常规H9 疫苗免疫组抗体类似于含免疫增强剂组,抗体上升至第6 周达到高峰,抗体效价在第22 周低于6lg2。对照组母源抗体一直低于2lg2。含免疫增强剂H9 免疫组抗体水平一直高于常规H9 疫苗免疫组,且在18 周之前一直高于1.8lg2 以上(图1)。以疫苗规程要求的6lg2 作为合格抗体界限,添加免疫增强剂的H9疫苗比常规H9 疫苗能延长抗体持续期4 周。
2.2 添加VA5 免疫增强剂的H5 疫苗的免疫持续期
将免疫增强剂VA5 制备成油乳剂疫苗伴侣,再与H5 商品疫苗共同混匀后免疫鸡,持续监测抗体效价。含免疫增强剂疫苗免疫后,第2 周抗体达到7lg2,在第3 周达到高峰,一直维持至第12 周,之后逐渐下降,在第24 周抗体效价低于7lg2;常规疫苗在免疫后第2 周抗体仅为4.25lg2,在第3 周至第10周维持较高抗体水平,之后逐渐下降,在第20 周抗体效价低于7lg2;空白对照组一直未检测出抗体(图2)。与常规H5 疫苗相比,含免疫增强剂VA5-H5疫苗免疫后,合格抗体产生提前1 周,即缩短窗口保护期1 周;在免疫后14 周前,VA5-H5 组抗体效价高于常规H5 疫苗2lg2 以上;常规疫苗在免疫后第20周降至7lg2 以下,而VA5-H5 疫苗免疫组至第24 周降至7lg2 以下,即VA5-H5 延长抗体持续期4 周。
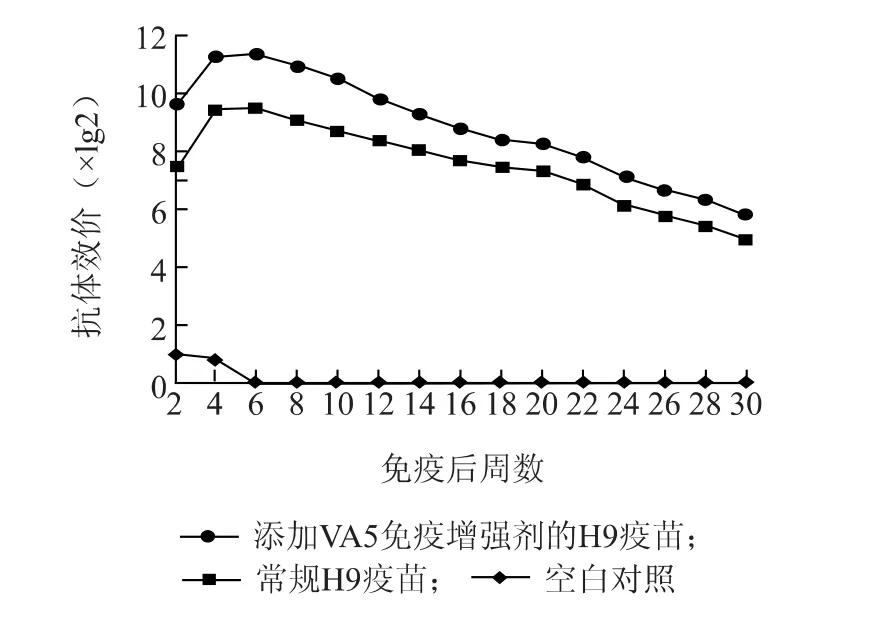
图1 H9 疫苗免疫后抗体持续期Fig.1 Duration of immunity provided by H9 vaccine
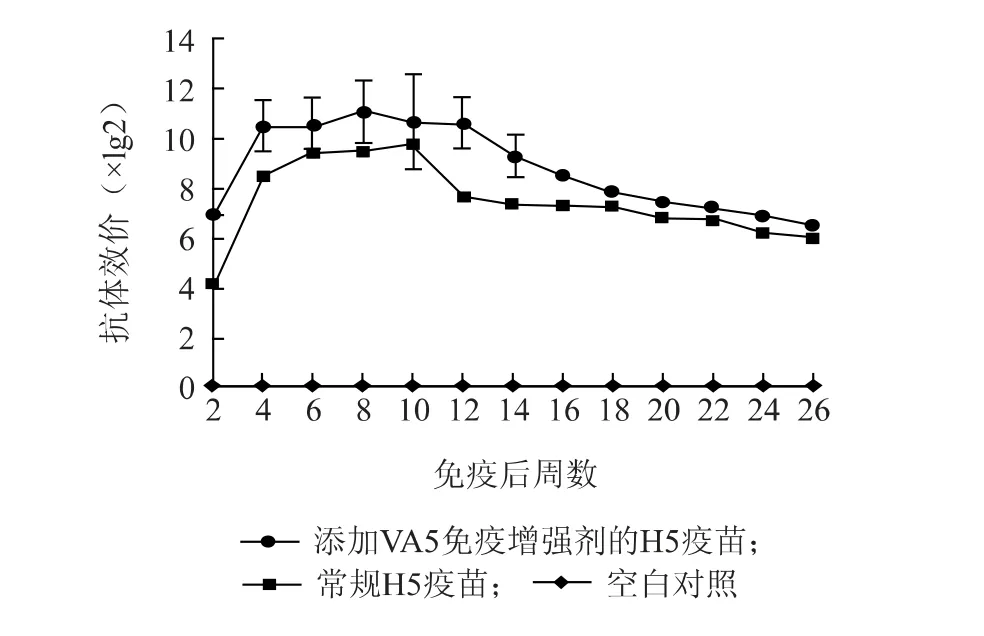
图2 H5 疫苗免疫后抗体持续期Fig.2 Duration of immunity provided by H5 vaccine
2.3 添加免疫增强剂的疫苗安全性
2 批次含免疫增强剂疫苗经单剂量接种鸡,或两倍超剂量接种鸡,或经间隔2 周单剂量重复接种鸡,在最后一次接种后扑杀,肉眼观察疫苗吸收情况。
2.3.1 单剂量免疫试验 在免疫后第14 d,各组扑杀5 只鸡,检查疫苗吸收情况。其中VA5-H9 疫苗第一批次、第二批次组和常规H9 疫苗组均有2 只鸡在颈部皮下免疫处有淡黄色类脂肪粒,常规疫苗组另有1 只有乳白色颗粒和弥散性淡黄色类脂肪粒。各组其余剖检鸡均正常。在第28 d 剖检时,VA5-H9 疫苗第一批次免疫组有1 只鸡、第二批次免疫组有3 只鸡,常规疫苗组有2 只鸡有淡黄色类脂肪粒,各组其余剖检鸡均正常。非免疫的空白对照组在第14 d 和第28 d 均正常。3 组鸡在免疫后的观察期内均健康,饮食正常。
2.3.2 超剂量免疫试验 在免疫后第14 d,VA5-H9 疫苗第一批次组和常规疫苗组5 只鸡均在颈部皮下免疫处有淡黄色类脂肪粒;VA5-H9 疫苗第二批次组2 只鸡在颈部皮下免疫处有淡黄色类脂肪粒,另3 只鸡均正常。在第28 d 剖检时,VA5-H9 疫苗第一批次和第二批免疫组均有2 只鸡以及常规疫苗组5 只鸡均有淡黄色类脂肪粒,其余剖检鸡均正常。非免疫的空白对照组在第14 d 和第28 d 均正常。3 组鸡在免疫后的观察期内均健康,饮食正常。
2.3.3 单剂量重复免疫试验 在二免后第14 d,VA5-H9 疫苗第一批次免疫组3 只鸡有乳白色颗粒,2 只鸡有乳白色颗粒和黄色类脂肪混合颗粒。VA5-H9 疫苗第二批次免疫组中1 只鸡有乳白色颗粒,4 只鸡有淡黄色类脂肪颗粒。常规疫苗组的2只鸡有乳白色颗粒,3 只鸡有乳白色和淡黄色类脂肪混合颗粒。在二免后第28 d,VA5-H9 疫苗第一批次免疫组和常规疫苗组,均有2 只鸡在免疫部位有淡黄色类脂肪样颗粒,另3 只正常。而VA5-H9疫苗第二批次免疫组,1 只鸡有白色颗粒状未吸收完全的疫苗,另1 只有淡黄色脂肪样颗粒,剩余3 只鸡均正常。不免疫的空白对照组均正常。3 组鸡在免疫后的观察期内均健康,饮食正常。
根据各组在免疫后不同时期的疫苗吸收情况比较可以得知,含免疫增强剂的2 批次疫苗,与常规疫苗的吸收情况较类似,无明显延后。该结果提示,将免疫增强剂添加至疫苗中,并不影响机体对疫苗的吸收。
2.4 VA5 免疫增强剂对免疫鸡淋巴细胞转化效率的影响
各疫苗免疫组鸡的淋巴细胞在免疫后,刺激指数逐渐升高,即淋转活性逐渐上升,且含VA5 免疫增强剂剂的灭活疫苗组的淋巴细胞转化活性高于常规疫苗组,特别在第5 d 以后更加明显(图3)。根据刺激指数与免疫效力的正相关性可以得知,免疫增强剂提高免疫鸡的淋巴细胞转化活性,即含免疫增强剂疫苗能提高机体对疫苗的免疫应答。这与抗体检测结果中含免疫增强剂的疫苗抗体效价高一致。
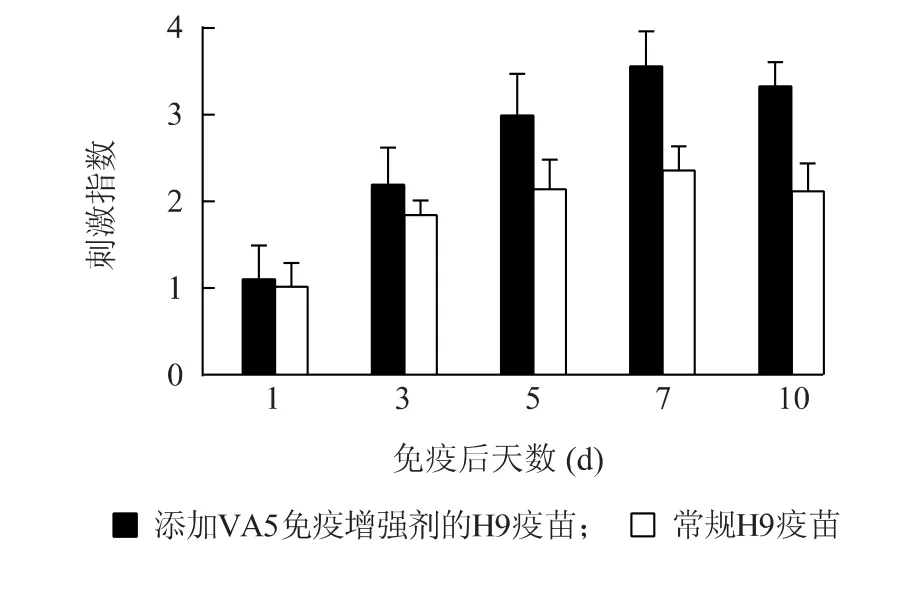
图3 添加VA5 免疫增强剂的疫苗免疫鸡后的淋巴细胞转化Fig.3 The lymphocyte transformation of chicken inoculated with VA5-contained vaccine
综上所述,本研究获得的免疫增强剂,无论以添加至抗原中混合使用的形式或以疫苗伴侣的形式使用,均能有效提高鸡对禽流感疫苗的抗体效价和免疫持续期。安全性研究表明,该免疫增强剂不影响鸡体对疫苗的吸收。
[1] KHURANA S,CHEARWAE W,CASTELLINO F,et al.Vaccines with MF59 adjuvant expand the antibody repertoire to target protective sites of pandemic avian H5N1 influenza virus[J].Sci Transl Med,2010,2(15):15.
[2] REYNALES H,ASTUDILLO P,DE VALLIERE S,et al.A prospective observational safety study on MF59 ® adjuvanted cell culture-derived vaccine,Celtura ® during the A/H1N1 (2009)influenza pandemic[J].Vaccine,2012,30(45):6436-6443.
[3] PULESTON R,BUGG G,HOSCHLER K,et al.Multi-centre observational study of transplacental transmission of influenza antibodies following vaccination with AS03(A)-adjuvanted H1N1 2009 vaccine[J].PLoS One,2013,8(1):e47448.
[4] BROERS P,VISSER N,EGGER W.Field study for reduction of spread of Aujeszky’s disease virus in finishing pigs with different vaccination regimes[J].Acta Vet Hung,1994,42(2-3):397-403.
[5] MARTELLI P,FERRARI L,MORGANTI M,et al.One dose of a porcine circovirus 2 subunit vaccine induces humoral and cellmediated immunity and protects against porcine circovirus-associated disease under field conditions[J].Vet Microbiol,2011,149(3-4):339-351.
[6] WEIBEL H,SYDLER T,BRUGNERA E,et al.Efficacy of simultaneous vaccination with Enterisol® Ileitis and Ingelvac® CircoFLEXTM in a Swiss breeding farm[J].Schweiz Arch Tierheilkd,2012,154(10):445-450.
[7] OPRIESSNIG T,PATTERSON A R,ELSENER J,et al.Influence of maternal antibodies on efficacy of porcine circovirus type 2(PCV2)vaccination to protect pigs from experimental infection with PCV2[J].Clin Vaccine Immunol,2008,15(3):397-401.
[8] WILLSON P J,ROSSI-CAMPOS A,POTTER A A.Tissue reaction and immunity in swine immunized withActinobacillus pleuropneumoniaevaccines[J].Can J Vet Res,1995,59(4):299-305.
[9] DUPUIS L,ASCARATEIL S,AUCOUTURIER J,et al.SEPPIC vaccine adjuvants for poultry[J].Annals of the New York Academy of Sciences,2006,1081:202-205.
[10] BARNETT P V,PULLEN L,WILLIAMS L,et al.International bank for foot-and-mouth disease vaccine:assessment of Montanide ISA 25 and ISA 206,two commercially available oil adjuvants[J].Vaccine,1996,14(13):1187-1198.
