PCV2 与PPV 体外混合感染猪肺泡巨噬细胞对细胞因子的影响
2014-12-23王永帅张雪花刘国洋侯继波张道华
王永帅,唐 波, 张雪花, 华 涛, 常 晨, 刘国洋, 侯继波, 张道华,
杨德吉1
(1.南京农业大学 动物医学院,江苏 南京210095;2.江苏省农业科学院国家兽用生物制品工程技术研究中心,江苏 南京210014)
猪圆环病毒2 型(Porcine circovirus type 2,PCV2)属于圆环病毒科圆环病毒属,为已知的最小的动物病毒,是猪圆环病毒相关疾病(Porcine circovirus associated disease,PCVAD)的必须病原,是危害当今全球养猪业最主要的免疫抑制性疾病之一[1-3]。断奶仔猪多系统衰竭综合征(PMWS)是PCVAD 的一种重要的表现形式,严重影响仔猪断奶后的生长发育[4]。无论在临床或实验条件下,单独的PCV2 感染很难诱发PMWS,在临床条件下PCV2 与猪细小病毒(PPV)混合感染可以显著提高PMWS 发病率[5-7],另外在试验条件下PPV 已被广泛应用于PMWS 的发病模型[6,8-9]。PCV2 与PPV 共同的靶细胞猪肺泡巨噬细胞(PAMs)[10-13]是猪体先天性免疫的第一道防线[14],当PAMs 感染PCV2 或与PRRSV(猪繁殖与呼吸综合征病毒)混合感染后可以增强IL-10 或TNF-α 等免疫调节性细胞因子的作用,导致免疫抑制或对猪体先天性免疫产生损伤[15]。PPV 同样可感染PAMs,而关于PCV2 与PPV 共同感染PAMs 并对其细胞因子影响的研究较少。本研究通过PCV2 和PPV 混合感染体外猪肺泡巨噬细胞,测定两种病毒在该细胞中的增殖规律及不同细胞因子mRNA 表达水平,以阐明PMWS 发病机理,为有效预防和治疗该病提供理论依据。
1 材料与方法
1.1 病毒
PCV2 病毒NJ 株由本实验室分离并保存,其TCID50为1 ml 105.6。PPV 病毒NJ 株由本实验室分离并保存,其TCID50为1 ml 107。
1.2 试验动物
7 周龄断奶仔猪,经PCR 或RT-PCR 检测PRRSV、PCV2、PPV、PRV(猪伪狂犬病毒)、SIV(猪流感病毒)、CSFV(猪瘟病毒)和猪肺炎支原体均为阴性。用ELISA 检测PPV、PCV2 特异性抗体均为阴性。
1.3 主要试剂和仪器
RNAiso Plus、 PrimeScriptTMReverse Transcriptase、SYBR Premix Ex TaqTM(Tli RNaseH Plus)购自宝生物工程(大连)有限公司;RPMI 1640 购自Invitrogen 公司;胎牛血清购自浙江天杭生物科技有限公司。LightCycler480 Realtime PCR 购自罗氏公司,超净台购自苏州净化设备有限公司。AIRTECH超净工作台购自苏州净化设备有限公司,Lightcycler480 实时荧光定量PCR 仪和实时荧光定量PCR加样板购自Roche 公司,Eppendor 微量移液器,倒置荧光显微镜(Zeiss4.7)购自德国zeiss 公司,CO2恒温培养箱购自美国Thermo 公司。
1.4 PAM 的分离
选取2 头7 周龄断奶仔猪,无菌摘取其肺脏,用含有5%FBS 的PBS 100 ml 灌洗肺脏,2 ~5 min 后回收灌洗液,共灌洗3 次。灌洗液经3 层纱布过滤后,1 500 r/min离心10 min,用无菌PBS 洗涤2 次,最后重悬于10%胎牛血清的RPMI1640 培养液,经0.2%台盼蓝检测细胞活性在95%以上,调整细胞浓度至1 ml 2 ×106个,铺至6 孔细胞板,37 ℃贴壁培养2 h 后弃去未贴壁的细胞,用无菌PBS 清洗细胞表面,37 ℃培养24 h 以备接种病毒。
1.5 试验设计
将生长在6 孔板上的PAMs 细胞分为4 组,分别为PPV 组、PCV2 组、PPV/PCV2 混合感染组和对照组,每组3 个重复。各组按照0.1 MOI 接种病毒,对照组接种等体积的细胞培养液,分别于感染后12 h、24 h、36 h、48 h、60 h 和72 h 收集细胞,冻存于-80 ℃,之后对各组细胞因子mRNA 水平进行Realtime-PCR 检测,比较组间差异。
1.6 PCV2、PPV 及细胞因子基因实时荧光定量PCR 检测方法的建立
按照常规方法构建PCV2、PPV 和细胞因子基因的重组质粒,并提取阳性重组质粒测定OD260吸光值,参照文献[16]介绍的方法计算出各重组质粒的拷贝数。Realtime-PCR 反应体系:SYBR PremixExTaqTM(Tli RNaseH Plus)10 μl,10 μmol/L上、下游引物(表1)各0.5 μl,cDNA 2 μl,加超纯水补足20 μl。按以下程序进行Realtime-PCR 反应:94 ℃预变性5 min;94 ℃5 s,60 ℃20 s,共40 个循环。
1.7 Realtime-PCR 检测病毒拷贝数及细胞因子mRNA 水平
按照RNAiso 试剂盒说明书提取总RNA,应用PrimeScriptTM反转录酶,以Oligo(dT)15为引物进行反转录获得cDNA 用于检测细胞因子。Realtime-PCR反应体系:SYBR PremixEx TaqTM(Tli RNaseH Plus)10 μl,10 μmol/L上、下游引物(表1)各0.5 μl,cDNA 2 μl,加超纯水补足20 μl。按以下程序进行Realtime-PCR 反应:94 ℃预变性5 min;94 ℃5 s,60 ℃20 s,共40 个循环。PCR 反应结束后得到检测样品中细胞因子cDNA 拷贝数。每个细胞因子的检测样品重复3 次。
1.8 数据处理与统计分析
经Realtime-PCR 反应后,获得每个检测样品中细胞因子及管家基因拷贝数,应用2-△△Ct法对各组细胞因子进行比较,数据用SPSS 进行统计学分析,并进行差异分析。

表1 实时荧光定量PCR 引物Table 1 The primers for realtime PCR
2 结果与分析
2.1 PCV2、PPV 及细胞因子基因标准曲线的建立
将含有目的基因片段的重组质粒进行10 倍倍比稀释6 ~7 个梯度(1 μl 109~103),采用Realtime-PCR 扩增,获得PCV2、PPV 和细胞因子基因的Realtime-PCR 标准曲线和直线回归方程(图1)。结果显示,所有标准曲线的线性回归方程相关系数R2>0.99,重复性好,可用于计算待测样品的拷贝数。
2.2 PCV2 和PPV 在PAMs 中病毒拷贝数的变化
感染后12 h、24 h、36 h、48 h、60 h 和72 h 收集感染细胞,应用Realtime PCR 测定各组PAMs 中PCV2和PPV 核酸拷贝数(图2),结果显示,PCV2 单独感染组与PCV2/PPV 混合感染组相比,在整个试验过程中混合感染组PCV2 核酸拷贝数都高于单独感染组。PPV 单独感染组PPV 核酸拷贝数在24 h 比12 h 提高40%,并持续到试验结束,PPV 单独感染组与PCV2/PPV 混合感染组相比,混合感染组PPV 核酸拷贝数在48 h 后上升,并在60 h、72 h 比PPV 单独感染组高10 倍。
2.3 PCV2 和PPV 体外感染PAMs 对IFN-γ 的影响
PCV2 与PPV 体外感染PAMs 后,收取感染12 h、24 h、36 h、48 h、60 h 和72 h 后的PAMs 提取的RNA进行反转录,之后进行Realtime-PCR 检测,检测结果如图3。PCV2/PPV 混合感染组IFN-γ 的表达量显著低于PCV2 或PPV 单独感染组,并低于对照组水平。相比于对照组,PCV2 或PPV 单独感染后能显著促进IFN-γ 表达量的增加,PCV2 促进作用最大。由此说明,PCV2 和PPV 单独感染能激活IFN-γ 的表达,PCV2 和PPV 混合感染可能显著抑制IFN-γ 的表达。
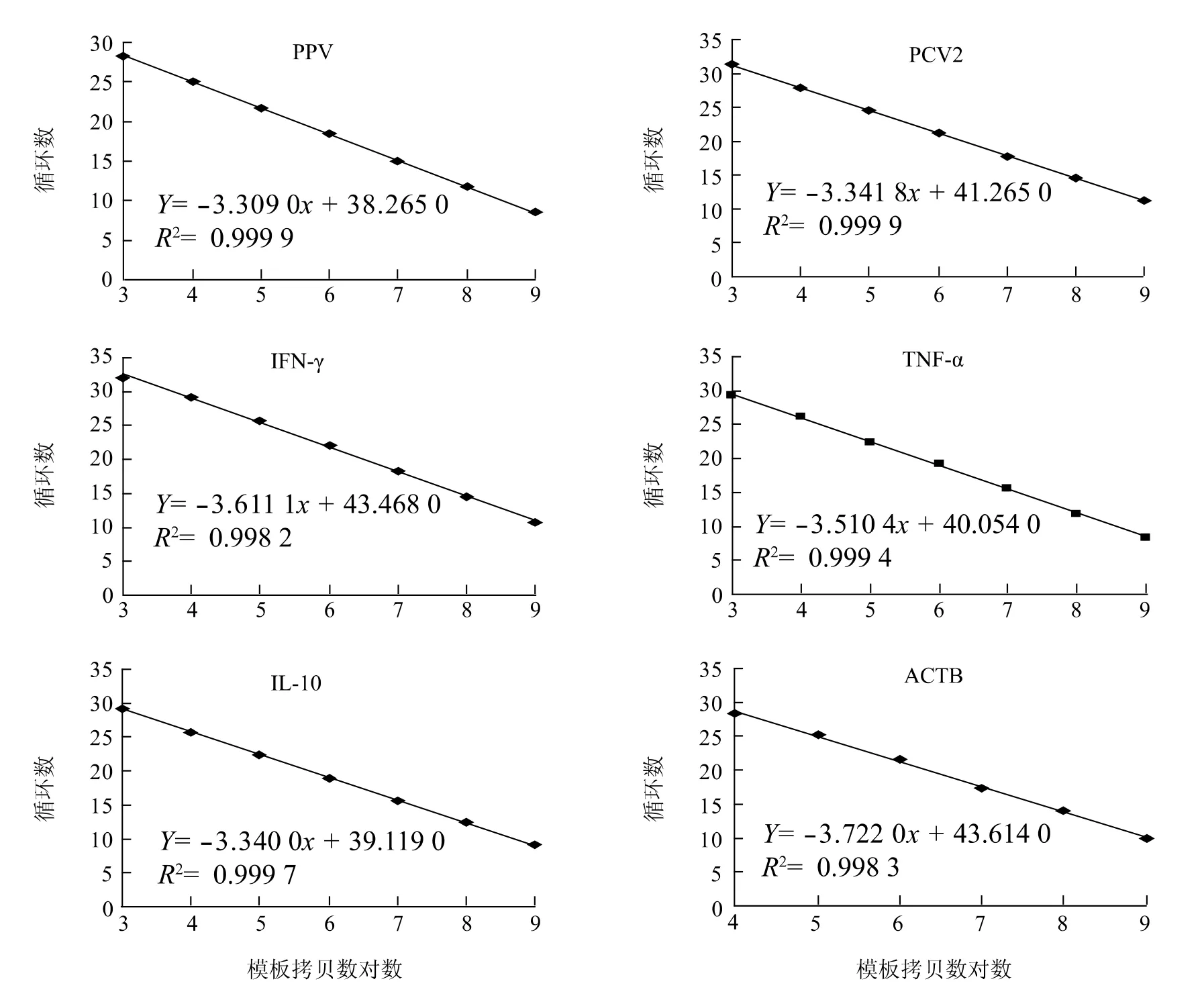
图1 PPV、PCV2 和细胞因子部分基因Realtime-PCR 标准曲线和直线回归方程Fig.1 Standard curve and linear regression of realtime-PCR for PPV,PCV2 and cytokines

图2 PPV 和PCV2 单独以及PPV、PCV2 混合感染病毒拷贝数Fig.2 The copy numbers of PPV,PCV2,and PPV/PCV2 coinfection
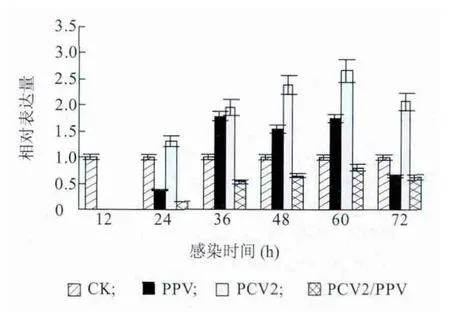
图3 PAMs 受PCV2 和PPV 体外感染后IFN-γ 表达量Fig.3 The expressions of IFN-γ mRNA in PAMs in response to PCV2 and/or PPV infection over time
2.4 PCV2 和PPV 体外感染PAMs 对TNF-α 的影响
Realtime-PCR 法测定各组PAMs 感染12 h、24 h、36 h、48 h、60 h 和72 h 后TNF-αmRNA 表达水平变化。图4 显示,PPV 和PCV2 单独感染都可以引起TNF-α 的大量表达,分别在48 h 和36 h 达到最高峰,之后下降;PCV2/PPV 混合感染导致TNF-α 的持续表达并在48h 达到最高峰,之后下降,在整个试验过程显著高于PCV2 单独感染组和PPV 单独感染组。由此说明,PCV2/PPV 混合感染促进了TNF-α的大量表达。
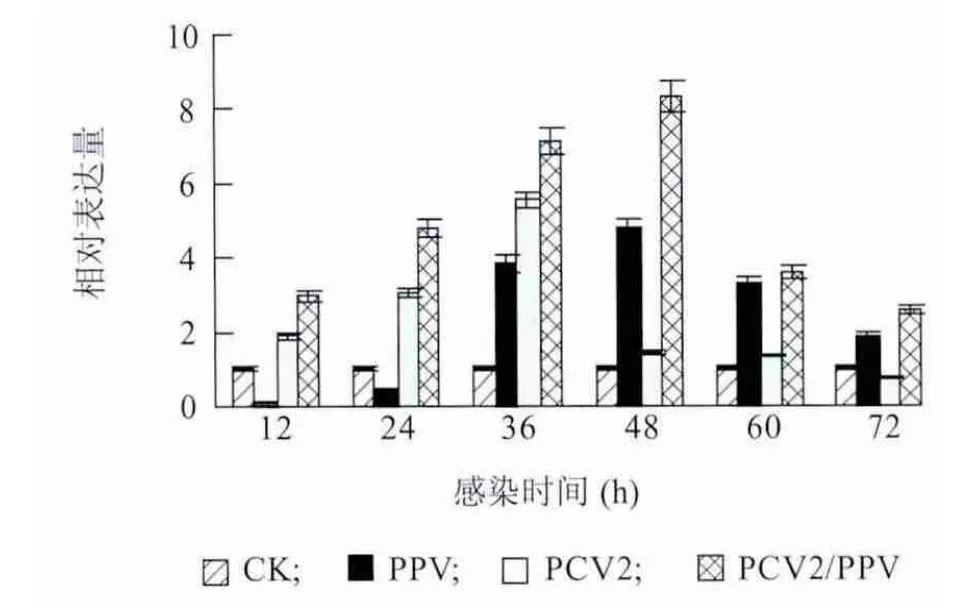
图4 PAMs 受PCV2 和PPV 体外感染后TNF-α mRNA 定量检测结果Fig.4 The expressions of TNF-α mRNA in PAMs in response to PCV2 and/or PPV infection over time
2.5 PCV2 和PPV 体外感染PAMs 对IL-10 的影响
Realtime-PCR 测定各组PAMs 感染12 h、24 h、36 h、48 h、60 h 和72 h 后IL-10 的mRNA 表达量变化。图5 显示,PPV 组与PCV2 组IL-10 表达量差异不显著,PCV2/PPV 混合感染组IL-10 表达量在36h和48h 显著高于PCV2 组和PPV 组,其他时间差异不显著。
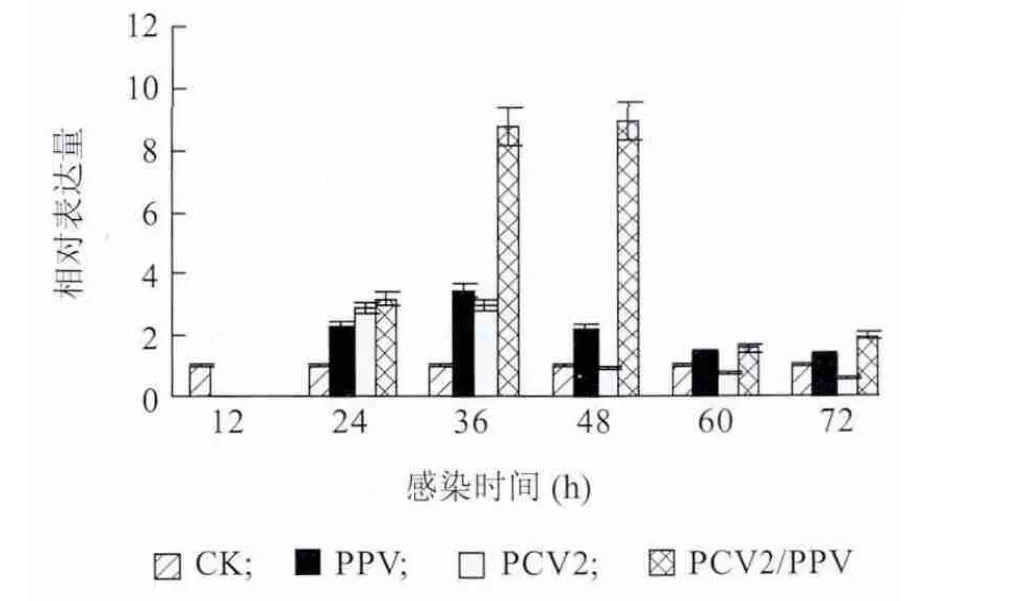
图5 PAMs 受PCV2 和PPV 体外感染后IL-10 mRNA 定量检测结果Fig.5 The expressions of IL-10 mRNA in PAMs in response to PCV2 and/or PPV infection over time
3 讨论
PMWS 是由猪圆环病毒2 型(PCV2)造成的一种消耗性疾病,给世界养猪业造成了严重的经济损失[6]。PPV 已被用于与PCV2 合并感染引起PMWS的模型[6,8-9,17-19],有将近15%患有PMWS 的猪存在PCV2 与PPV 的混合感染[20]。单核细胞和巨噬细胞在感染宿主的免疫反应中占据着举足轻重位置。肺泡巨噬细胞(PAMs)能够抵抗各种病原体的感染,是肺脏初级防御中的重要细胞,同时它又是PCV2与PPV 共同的靶细胞[10-13]。本试验将PCV2 与PPV体外单独、混合感染PAMs 后动态检测各细胞因子的变化,推测两种病毒混合感染对机体免疫系统的影响。
本研究通过PCV2 与PPV 体外混合感染PAMs,动态检测PCV2 与PPV 病毒核酸含量。在感染早期,PPV 组中PPV 病毒量略高于PCV2/PPV 混合感染组,但是在感染后期,后者PPV 病毒量明显高于前者,由此推测,在混合感染中,PPV 能促进PCV2感染PAMs,同时PCV2 能显著促进PPV 在PAMs 中的增殖。
国内外研究结果表明,PCV2 与PPV 混合感染可以引起猪体质量下降、黄疸、衰竭、贫血、以及全身淋巴结炎症、肾炎、肺炎等PMWS 的典型症状[17,21]。PCV2 感染可使猪淋巴结、扁桃体、胸腺等局部免疫器官和免疫细胞内细胞因子分泌失衡,导致机体免疫调节功能紊乱和免疫应答能力降低[2,14]。IFN-γ主要由抗原刺激T 细胞产生,在机体抵抗病毒反应和免疫调节中起着重要的作用。刘祥义[14]等PAMs体内试验研究结果表明PCV2/PPV 混合感染使PAMs 持续低水平的IFN-γ 表达。本试验中,PCV2/PPV 混合感染组,IFN-γ 表达量明显减少,IFN-γ 主要发挥免疫调节功能,具有抗病毒能力,由此推测,IFN-γ 表达量的减少增加了病毒感染机率。PCV2/PPV 混合感染组PAMs 持续较低水平的表达IFN-γ可能会导致IL-10 的过量表达,从而导致机体免疫反应失衡,造成更为严重的病理损伤。
TNF-α 是一种前炎性细胞因子,主要由活化的单核-巨噬细胞产生,能起到抵抗细菌或寄生虫感染,阻碍病毒复制,调控细胞生长及调节免疫的作用;是体内热源分子之一,它与炎症感染后体温升高有关。Kim[6]等证明PPV 对猪圆环病毒引起的断奶仔猪多系统衰竭综合征的增强作用与TNF-α 过量表达有关。Chang 等[22]的研究结果表明PCV2 感染的PAMs 中TNF-α 过量表达。本试验中,PCV2 单独感染TNF-α 表达量明显增加,而且PCV2/PPV 混合感染TNF-α 表达量较PCV2 单独感染组显著增加,由此推断,PPV 的感染活化了PAMs,增强了TNF-α的表达,最终导致体温升高等一系列临床表现。
Darwich 等[23]的研究结果表明亚临床PCV2 感染的猪有短暂的IL-10 过量表达。IL-10 和其他促炎症细胞因子可能在PCV2 致病机制中发挥着重要的作用[24-25]。IL-10 由巨噬细胞、B 细胞、TH2 细胞分泌,能抑制巨噬细胞、抑制TH1 细胞分泌细胞因子,促进B 细胞增殖和抗体生成,促进胸腺和肥大细胞的增殖。本试验中PCV2/PPV 组短暂的IL-10表达量增加,且IFN-γ 的表达持续被抑制,由此推断PPV 与PCV2 混合感染引起IL-10 的过量表达,使肺泡巨噬细胞IFN-γ 表达水平持续较低,导致机体免疫反应失衡,不能有效的清除PCV2 病毒,进而导致更为严重的病理损伤。
综合上述分析结果推测,PPV 与PCV2 混合感染抑制了肺泡巨噬细胞IFN-γ 的表达,并促进了TNF-α 的表达及短暂的IL-10 的表达,导致感染早期机体抗病毒能力降低,引起机体免疫抑制,进而引起感染免疫系统紊乱,影响特异性免疫动能的正常运转,为PMWS 的发病创造了前提条件。
[1] TODD D,BIAGINI P,BENDINELLI M,et al.Circoviridae[C]//Fauquet C M,Mayo M A,Maniloff J,et al.Virus taxonomy,VIIIth report of the international committee for the taxonomy of viruses.London:Elsevier/Academic Press,2005:327-334.
[2] MENG X J.Porcine Circovirus Type 2(PCV2):Pathogenesis and Interaction with the Immune System[J].Annu Rev Anim Biosci,2013,1:43-64.
[3] 郭广富,曹军平,吴艳涛,等.江苏泰州地区猪圆环病毒2 型感染情况调查[1].江苏农业科学,2013,41(10):188-189.
[4] CHAE C.Postweaning multisystemic wasting syndrome:a review of aetiology,diagnosis and pathology[J].Vet,2004,168:41-49.
[5] RINKU S,SAIKUMARG.Porcine parvovirus and porcine circovirus 2-associated reproductive failure and neonatal mortality in crossbred Indian pigs[J].Trop Anim Health Prod,2010,42:515-522.
[6] KIM J,HA Y,CHAE C.Potentiation of porcine circovirus 2 induced postweaning multisystemic wasting syndrome by porcine parvovirus is associated with excessive production of tumor necrosis factor-α[J].Vet Pathol,2006,43:718.
[7] KRAKOWKA S,ELLIS J A,MEEHAN B,et al.Experimental reproduction of postweaning multisystemic wasting syndrome in gnotobiotic swine by coinfection with porcine circovirus 2 and porcine parvovirus viral wasting syndrome of swine[J].Vet Pathol,2000,37:254.
[8] KENNEDY S,MOFFETT D,MCNEILLY F,et al.Reproduction of lesions of postweaning multisystemic wasting syndrome by infection of conventional pigs with porcine circovirus type 2 alone or in combination with porcine parvovirus[J].J Comp Pathol,2000,122:9-24.
[9] KRAKOWKA S,ELLIS J A,MEEHAN B,et al.Viral wasting syndrome of swine:experimental reproduction of postweaning multisystemic wasting syndrome in gnotobiotic swine by coinfection with porcine circovirus 2 and porcine parvovirus[J].Vet Pathol,2000,37:254-263.
[10] GILPIN D F,MCCULLOUGH K,MEEHAN B M,et al.In vitrostudies on the infection and replication of porcine circovirus type 2 in cells of the porcine immune system[J].Veterinary Immunology and Immunopathology,2003,94:149-161.
[11] ROAAELL C,BALASCH M,KENNEDY S,et al.Pathological,immunohistochemical and in-situ hybridization studies of natural cases of post-weaning multisystemic wasting syndrome (PMWS)in pigs[J].Journal of Comparative Pathology,2010,120:59-78.
[12] CHOI C,CHAE C.Distribution of porcine parvovirus in porcine circovirus 2-infected pigs with postweaning multisystemic wasting syndrome as shown by insitu hybridization[J].J Comp Pathol,2000,123:302-305.
[13] KIM J,CHOI C,CHAE C.Pathogenesis of postweaning multisystemic wasting syndrome repro-duced by co-infection with Korean isolates of porcine circovirus 2 and porcine parvovirus[J].J Comp Pathol,2003,128:52-59.
[14] 刘祥义,陈立功,宋勤叶,等.猪圆环病毒2 型与猪细小病毒共感染对猪肺泡巨噬细胞吞噬功能及其干扰素表达水平的影响[J].微生物学报,2011,51(1):105-114.
[15] FAN PEIHU,WEI YANWU,GUO LONGJUN,et al.Synergistic effects of sequential infection with highly pathogenic porcine reproductive and respiratory syndrome virus and porcine circovirus type 2[J].Virology Journal,2013,10:265.
[16] RAYMOND C R,WILKIE B N.Th-1/Th-2 type cytokine profiles of pig T-cells cultured with antigen treated monocyte derived dendritic cells[J].Vaccine,2004,22:1016-1023.
[17] ALLAN G M,KENNEDY S,MCNEILLY F,et al.Experimental reproduction of severe wasting disease by co-infection of pigs with porcine circovirus and porcine parvovirus[J].J Comp Pathol,1999,121:1-11.
[18] ELLIS J,KRAKOWKA S,LAIRMORE M,et al.Reproduction of lesions of postweaning multisystemic wasting syndrome in gnotobiotic piglets[J].J Vet Diagn Invest,1999,11:3-14.
[19] KENNEDY S,MOFFETT D,MCNEILLY F,et al.Reproduction of lesions of postweaning multisystemic wasting syndrome by infection of conventional pigs with porcine circovirus type 2 alone or in combination with porcine parvovirus[J].J Comp Pathol,2000,122:9-24.
[20] ELLIS J A,BRATANICH A,CLARK E G,et al.Coinfection by porcine circoviruses and porcine parvovirus in pigs with naturally acquired postweaningmultisystemic wasting syndrome[J].Vet Diagn Invest,2000,12:21-27.
[21] ELLIS J,CLARK E,HAINES D,et al.Porcine circovirus-2 and concurrentinfections in the field[J].Veterinary Microbiolog,2004,98(2):159-63.
[22] CHANG H W,JENG C R,LIN T L ,et al.Immunopathological effects of porcine circovirus type 2 (PCV2)on swine alveolar macrophages by in vitro inoculation[J].Vet Immunol Immunopathol,2006,110:207-19.
[23] DARWICH L,SEGALÉS J,RESENDES A,et al.Transient correlation between viremia levels and IL-10 expression in pigs subclinically infected with porcine circovirus type 2 (PCV2)[J].Res Vet Sci,2008,84:194-198.
[24] RAMAMOORTHY S,MENG X J.Porcine circoviruses:a minuscule yet mammoth paradox[J].Anim Health Res Rev,2009,10:1-20.
[25] DARWICH L,MATEU E.Immunology of porcine circovirus type 2 (PCV2)[J].Virus Res,2012,164:61-67.
