有效微生物菌群与大薸联合净化养殖水体的效果
2014-12-23许国晶杜兴华王春生田功太张金路张明磊
许国晶,杜兴华, 王春生, 田功太, 张金路, 张明磊, 栗 明, 李 敏,
马亚梅3
(1.山东省淡水渔业研究院,山东 济南250013;2.上海海洋大学生命学院,上海201306;3.山东省鱼台县渔业技术推广站,山东 鱼台272300)
水产养殖过程中排放的污染物危害了水域生态环境,对养殖业的健康发展造成了一定影响。有效改善养殖池塘水环境质量,减少污染物排放量,对保证水产养殖业健康发展具有重要意义。目前,许多专家学者采用不同的方法研究养殖水体净化。其中有益微生物菌群(Effective microoganisms,EM)对养殖废水的净化已经得到很多学者的证实[1-3]。有效微生物菌是由多种有益菌群(光合细菌、乳酸菌、芽孢杆菌、硝化细菌等)组成[1,4],在净化水质、降低氨氮(NH+4-N)和亚硝态氮(NO-2-N)等污染物浓度和实现健康养殖方面发挥重要作用[5-6]。邵青[5]通过实验证明EM 菌可显著提高氨氮(NH+4-N)和总磷(TP)的去除率;田功太等[6]研究了EM 菌原液对海参养殖水体的净化效果,发现EM 菌能显著降解NH+4-N、NO-2-N、化学耗氧量(Chemical oxygen demand,COD)。
利用水生植物净化修复水体是一种成本低廉、节约能源、简便易行的办法,作为水体净化修复的有效手段被广泛运用于研究和实践[7-10]。其中大薸(Pistia stratiotes)为一种多年生漂浮性的水生植物,在养殖排放水和城市污水处理中发挥重要作用[11-17]。Nahlik 等[16]等利用水葫芦(Eichhornia crassipes)和大薸净化湿地废水,结果表明两种水生植物对NO-2-N、TP 有较好的去除效果;王国惠[17]在研究大薸和海芋(Alocasia macrorrhiza)对池塘水净化时发现,两种植物对NH+4-N 和COD 有明显的去除效果。但是目前把EM 菌和大薸(即有效微生物菌群和水生植物)相结合来净化养殖排放水的研究还很少。水生植物及其根系为微生物生长、繁殖提供了良好的生长环境,直接或间接地促进微生物对氮、磷、硫和COD 的代谢[18-20],从而有利于微生物和水生植物更好地联合净化养殖水体。因此,本研究利用EM 菌与大薸构建微生物-水生植物联合净化体系,比较不同大薸覆盖面积构建的联合净化体系对总氮(TN)、TP、NH+4-N、NO2--N、COD 等的去除效果,分析该联合净化体系对养殖水体中氮、磷等物质的去除率,从而为构建养殖水净化技术体系提供技术支撑。
1 材料与方法
1.1 试验材料
EM 原液由山东济宁九益生物科技有限公司提供,有效微生物含量为1.0 ×1010CFU/ml,主要成分为光合细菌(Photosynthetic bacteria)、硝化细菌(Nitrobacteria)、乳酸菌(Lactobacill)、放线菌(Actinomycetes)、酵母菌(Yeast)及芽孢杆菌(Bacillus cohn)。
水生植物采用大薸,选取个体均匀完整、叶子较小、具有快速生长特性的植株,先用供试水体进行14 d 的预驯化培养,待用。
1.2 试验设计
试验在山东济宁浩洋生态科技有限公司养殖基地进行。选择12 个代表性的小池塘,单个池塘面积为24 m2(4 m×6 m),池塘水深1.5 m。在每个池塘中放养鲤鱼(Cyprinus carpio,规格每尾0.06 kg,密度1 m230.0 尾)、鲢鱼(Hypophthalmichthys molitrix,规格每尾0.05 kg,密度1 m25.6 尾)和鳙鱼(Aristichthys nobilis,规格每尾0.05 kg,密度1 m21.5 尾),各池塘中放养鱼的种类、数量、规格基本一致。试验共分4组,第1、2 组分别移植覆盖面积为10%、20%的大薸(分别为3.5 kg、7.0 kg),浮床边框采用竹竿为材料,并在此基础上添加EM 菌液,终浓度为3.0×1010CFU/m3;第3 组只添加EM 菌液,终浓度同上;第4 组为空白对照组。每组3 个重复。在放置大薸及EM菌液前(即0 d)采样1 次,作为对照,放置之后每隔2 d 采样检测1 次,连续检测8 次。
1.3 养殖管理
鱼种放入水泥池后第2 d 开始投喂德琨牌鲤鱼配合饲料。每天分别于上午8∶ 00及下午15∶ 00投喂,每个池塘投喂量占鱼体质量的比例均为2% ~3%。投喂至试验结束。
1.4 检测项目和方法
每次取样检测时间均为当日上午8∶ 00,在水面下30 cm 处采样5 L,采集的水样立即送实验室检测,在24 h 内完成相应的分析测试。水温、pH 值、溶解氧(DO)采用YSI556MPS 多参数水质仪现场测定。浓度等用Spectroquant Pharo 100 分光光度计(德国MERCK 公司生产)测定;COD 浓度测定方法:用消解炉148 ℃消解2 h 后,用Spectroquant Pharo 100 分光光度计测定。
1.5 去除率计算
考虑到试验条件下水体内可能发生吸附、沉淀及降解等作用,为消除上述作用对去除效果的影响,准确评价浮床的净化效果,去除率计算中扣除了空白对照池塘的去除效果。计算方法为:去除率=(空白对照组浓度-处理组浓度)/空白对照组浓度×100%。
1.6 数据、图表处理
试验数据用SPSS16.0 统计软件进行方差分析。用Microsoft Excel 2007 进行图表处理。
2 结果与分析
2.1 EM 菌与大薸对养殖水体总氮(TN)的净化效果
图1 反映了试验期间各池塘养殖水体中TN 随时间的变化情况。从图1 中可以看出,对照组和处理组中TN 浓度呈现随时间上升的趋势。从试验开始至试验结束时,对照组池塘TN 的浓度从2.00 mg/L 上升到3.80 mg/L,增加1.80 mg/L;EM 菌液组从1.80 mg/L上升到3.00 mg/L,增加1.20 mg/L;EM 菌液+10% 大薸组从1.70 mg/L上升到2.33 mg/L,增加0.67 mg/L;EM 菌液+20% 大薸组从1.80 mg/L 上升到1.87 mg/L,增加0.07 mg/L。试验结果表明,各处理组TN 水平的绝对增加量均显著低于对照组(P<0.05),同时EM 菌液+10%大薸组及EM 菌液+20%大薸组TN 绝对增加量显著低于EM 菌液组(P<0.05),并且随移植面积的增大,EM 菌液+大薸组TN 水平的绝对增加量呈下降趋势,但两组间差异不显著。在试验后期(14 d),各处理组TN 水平均能达到淡水养殖排放水一级标准(SC/T9101-2007)。从图1 还可以看出,EM 菌液组、EM 菌液+10%大薸组及EM 菌液+20%大薸组在前8 d 对TN 的去除速率较快,8 d 之后,去除速率明显下降。到14 d 时,EM 菌液+10%大薸组对TN的去除率为38.60%,EM 菌液+20%大薸组对TN的去除率为50.88%,均显著高于EM 菌液组去除率21.05%(P<0.05)。

图1 EM 菌和大薸处理组中总氮(TN)浓度及去除率的变化Fig.1 The changes of total nitrogen (TN)concentration and removal rate in effective microorganisms (EM)and Pistia stratiotes treatment groups
2.2 EM 菌与大薸对养殖水体NH4+ -N 的净化效果
从图2 中可以看出,试验期间对照组和EM 菌液组NH4+-N 浓度在第8 d 达到最高值,试验后期(8 ~14 d)有不同程度的下降;EM 菌液+10%大薸组及EM 菌液+20%大薸组NH+4 -N 浓度整体呈下降趋势。对照组中NH+4-N 浓度变化范围为0.35 ~1.24 mg/L,在14 d 时NH+4-N 浓度为0.99 mg/L,较试验初期(0 d)增加0.64 mg/L;EM 菌液组变化范围为0.33 ~0.59 mg/L,在14 d 时NH+4-N 浓度为0.33 mg/L,较试验初期没有变化;EM 菌液+10%大薸组变化范围为0.17 ~0.31 mg/L,在14 d 时NH+4-N 浓度为0.20 mg/L,较试验初期下降0.11 mg/L,与对照组差异显著(P<0.05);EM 菌液+20%大薸组变化范围为0.17 ~0.28 mg/L,在14 d 时浓 度 为0.17 mg/ml,较试验初期下降0.11 mg/L,与对照组差异显著(P<0.05)。试验结果表明,添加EM 菌液后,水体中NH+4-N 浓度得到了控制,其中EM 菌液+10%大薸组及EM 菌液+20%大薸组NH4+-N 减少量显著高于EM 菌液组(P<0.05),但两组之间NH+4-N 减少量差异不显著。从图2 还可以看出,EM 菌液+10%大薸组及EM 菌液+20%大薸组在前8 d 对NH+4-N 的去除速率较快,8 d 之后,去除速率明显下降。到第14 d 时,EM 菌液+10%大薸组对NH+4-N 的去除率为79.46%,EM 菌液+20%大薸组对NH+4 -N 的去除率为83.16%,均显著高于EM 菌液组对NH+4-N 的去除率66.67%(P<0.05)。
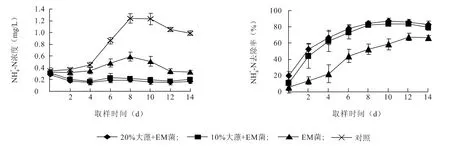
图2 EM 菌和大薸处理组中NH +4 -N 浓度及去除率的变化Fig.2 The changes of NH +4 -N concentration and removal rate in EM and P.stratiotes treatment groups
2.3 EM 菌与大薸对养殖水体NO2- -N 的净化效果
对照组、EM 菌液组、EM 菌液+10%大薸组和EM 菌液+20%大薸组水体中NO2--N 浓度的变化范围分别在0.27 ~0.53 mg/L、0.18 ~0.25 mg/L、0.09~0.26 mg/L 和0.04 ~0.25 mg/L(图3)。在14 d时,对照组池塘较之于养殖初期NO-2-N 浓度上升0.26 mg/L;而EM 菌液组、EM 菌液+10%大薸组和EM 菌液+20%大薸组水体较之于养殖初期NO-2-N浓度分别下降0.07 mg/L、0.17 mg/L和0.21 mg/L。与对照组相比,各处理组NO-2-N 水平显著降低(P<0.05),同时两组EM 菌液+大薸处理组NO2--N减少量均显著高于EM 菌液组(P<0.05),并且随移植面积的增大,NO2--N水平的绝对减少量显著增加(P<0.05)。EM 菌液+10%大薸组及EM 菌液+20%大薸组在前8 d 对NO-2 -N 的去除速率较快,8 d 之后,去除速率明显下降。到14 d 时,EM 菌液+10%大薸组对NO2--N 的去除率为81.63%,EM 菌液+20%大薸组对NO-2-N 的去除率为95.52%,均显著高于EM菌液组对NO2--N 的去除率63.27%(P<0.05)。
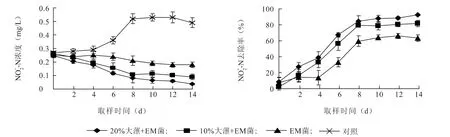
图3 EM 菌和大薸处理组中NO -2 -N 浓度及去除率的变化Fig.3 The changes of NO-2 -N concentration and removal rate in EM and P.stratiotes treatment groups
2.4 EM 菌与大薸对养殖水体NO-3-N的净化效果
图4 反映了试验期间各池塘养殖水体中NO3--N 浓度随时间的变化情况。对照组中NO-3-N 的浓度变化范围为0.80 ~1.10 mg/L,在14 d 时NO-3-N浓度为1.1 mg/L,较试验初期(0 d)增加0.30 mg/L;EM 菌液组NO-3-N 浓度变化范围为0.90 ~1.40 mg/L,在14 d 时为1.40 mg/L,较试验初期增加0.40 mg/L,与对照组差异不显著;EM 菌液+10%大薸组NO-3-N 浓度变化范围为0.93 ~2.27 mg/L,在14 d 时为2.27 mg/L,较试验初期增加1.34 mg/L,与对照组差异显著(P<0.05);EM 菌液+20%大薸组NO-3-N 浓度变化范围为0.97 ~1.90 mg/L,在14 d 时较试验初期增加0.93 mg/L,与对照组差异显著(P<0.05)。试验结果表明,EM 菌液+10%大薸组及EM 菌液+20%大薸组NO-3-N 增加量显著高于EM 菌液组(P<0.05),但两组之间NO3--N 增加量差异不显著。
2.5 EM 菌与大薸对养殖水体总磷(TP)的净化效果
如图5 所示,对照组、EM 菌液组、EM 菌液+10%大薸组和EM 菌液+20%大薸组水体中TP 浓度的变化范围分别在0.08 ~0.43 mg/L、0.07 ~0.28 mg/L、0.07 ~0.20 mg/L 和0.07 ~0.18 mg/L。在14 d 时,对照组池塘较之于养殖初期TP 浓度上升0.34 mg/L;EM 菌液组、EM 菌液+10%大薸组和EM 菌液+20%大薸组水体较之于养殖初期TP 浓度分别上升0.21 mg/L、0.12 mg/L、0.10 mg/L。各处理组TP 水平的绝对增加量均显著低于对照组(P<0.05),同时两组水生植物与EM 菌液处理组TP 增加量显著低于EM 菌液组(P<0.05),并且EM 菌液+10%大薸组TP 增加量显著低于EM 菌液+20%大薸组(P<0.05)。在试验后期(14 d),各处理组TP 水平均能达到淡水养殖排放水一级标准。从图5 还可以看出,EM 菌液组、EM 菌液+10%大薸组及EM 菌液+20%大薸组在前8 d 对TN 的去除速率较快,8 d 之后,去除速率明显下降。到14 d 时,EM 菌液+10%大薸组对TP 的去除率为54.76%,EM 菌液+20%大薸组对TP 的去除率为60.32%,均显著高于EM 菌液组对TP 的去除率33.33%(P<0.05)。
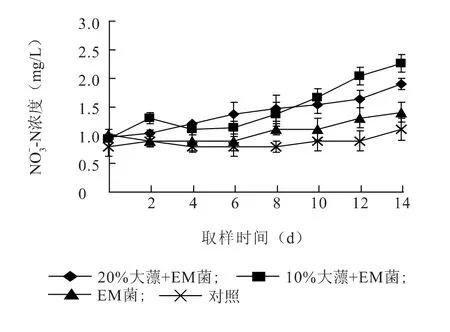
图4 EM 菌和大薸处理组中NO -3 -N 浓度及去除率的变化Fig.4 The changes of NO -3 -N concentration in EM and P.stratiotes treatment groups
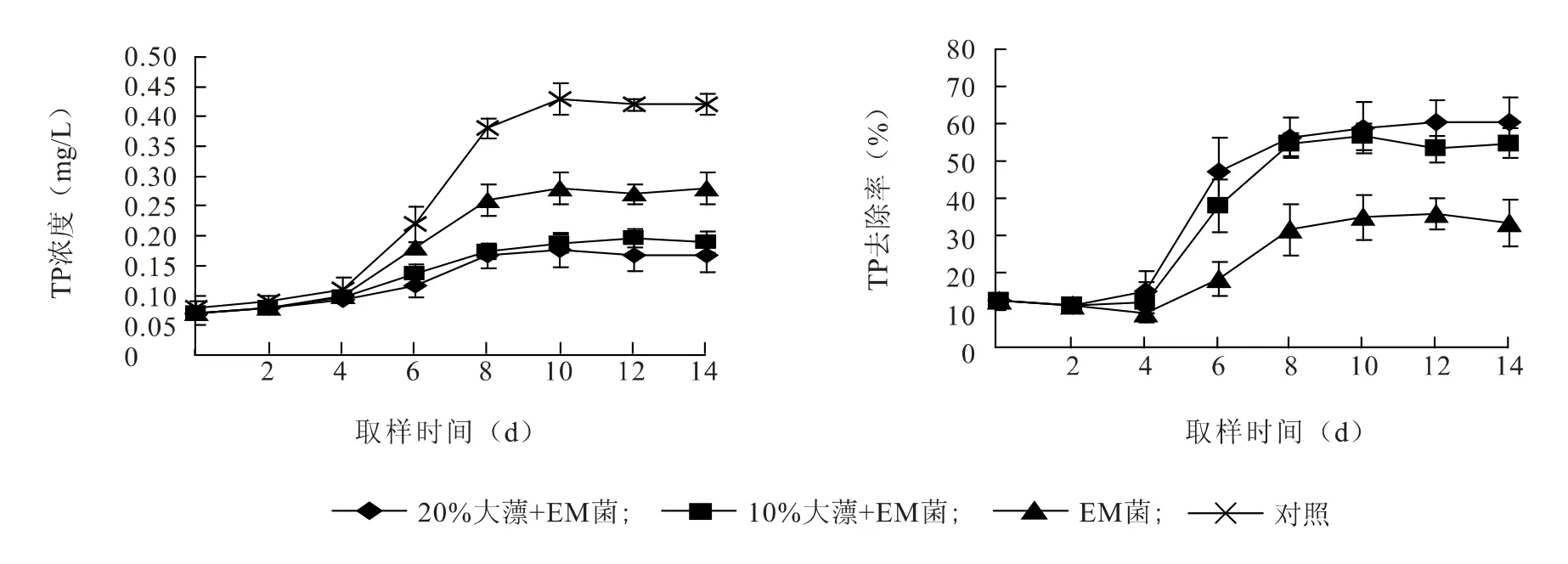
图5 EM 菌和大薸处理组中总磷(TP)浓度及去除率的变化Fig.5 The dynamic changes of total phosphorus (TP)concentration and removal rate in EM and P.stratiotes treatment groups
2.6 EM 菌与大薸对养殖水体化学耗氧量(COD)的影响
对照组、EM 菌液组、EM 菌液+10%大薸组和EM 菌液+20%大薸组水体中COD 浓度的变化范围分别在60 ~65 mg/L、48 ~61.67 mg/L、40 ~61.67 mg/L 和30.67 ~62.67 mg/L。在14 d 时,对照组池塘COD 浓度较之于养殖初期COD 浓度下降3 mg/L;而EM 菌液组、EM 菌液+10%大薸组和EM 菌液+20%大薸组较之于养殖初期COD 浓度分别下降13.67 mg/L、21.67 mg/L、32 mg/L。与对照组相比,各处理组COD 水平显著降低(P<0.05),同时两组EM 菌液+大薸处理组COD 减少量均显著高于EM菌液组(P<0.05),并且随移植面积的增大,COD 水平的减少量显著增加(P<0.05)。EM 菌液+10%大薸组对COD 的下降率为35.48%,EM 菌液+20%大薸组对COD 的下降率为50.54%,均显著高于EM 菌液组对COD 的下降率22.58%(P<0.05)(图6)。

图6 EM 菌和大薸处理组中化学耗氧量(COD)浓度及下降率的变化Fig.6 The dynamic changes of chemical oxygen demand (COD)concentration and removal rate in EM and P.stratiotes treatment groups
2.7 EM 菌与大薸对养殖水体溶解氧(DO)的改善效果
对照组、EM 菌液组、EM 菌液+10%大薸组和EM 菌液+20%大薸组水体中DO 浓度的变化范围分别在4.12 ~4.74 mg/L、4.14 ~5.54 mg/L、4.34 ~7.27 mg/L 和4.43 ~7.78 mg/L(图7)。在14 d 时,对照组池塘较之于养殖初期DO 浓度上升0.62 mg/L;而EM 菌液组、EM 菌液+10%大薸组和EM 菌液+20%大薸组水体较之于养殖初期DO 浓度分别上升1.40 mg/L、2.93 mg/L和3.35 mg/L。与对照组相比,各处理组DO 水平显著上升(P<0.05),同时两组EM 菌液+大薸处理组DO 增加量均显著高于EM菌液组(P<0.05),但两组之间差异不显著。

图7 EM 菌和大薸处理组中溶解氧(DO)浓度的变化Fig.7 The dynamic changes of dissolved oxygen(DO)concentration in EM and P.stratiotes treatment groups
3 讨论
本研究结果显示,在养殖水体中添加EM 菌液的基础上,移植漂浮植物大薸,构建的微生物-10%水生植物体系及微生物-20%水生植物体系对TN、NH4+-N、NO2--N 去除率显著高于EM 菌液组,且两组微生物-水生植物体系净化后的养殖水体中,TN、TP 水平分别达到淡水池塘养殖排放水一级标准,NH4+-N 水平控制在0.3 mg/L 以下,NO2--N 水平控制在0.1 mg/L 以下,均显著低于EM 菌液组及对照组,说明构建的微生物-水生植物体系,通过联合作用,提高了微生物-水生植物对TN、NH+4-N、NO-2-N的利用能力。这与邹万生等[21]研究微生物菌与水生植物联合净化养殖废水的结果及吴伟等[22]研究微生物-水生植物强化系统对日本沼虾养殖水体的生物净化结果一致。推测原因是加入微生物菌液后,大薸发达的根系扩大了微生物的附着面积,为微生物的生长、繁殖提供了良好的环境,在增加养殖水体中微生物数量的同时,提高了大薸根系表面微生物的数量,扩大了其接触养殖水体的时间和面积;同时,大薸发达根系还能分泌一些有机物质,直接或间接促进微生物的新陈代谢[23],促进对N、P、S 和COD 等物质的去除,大幅提高了联合净化体系对养殖水体的净化效果。李淑英等[24]在研究水生植物净化中微生物的变化及净化效果时也发现大薸净化水质的效果明显,根际效应也明显,根际微生物数量比水中微生物数量多。但是联合净化体系中大薸与微生物对水体污染物去除的贡献率分别为多少还需要深入研究。本研究结果表明可利用EM 菌和大薸构建微生物-水生植物净化体系,有效控制池塘水体中的TN、TP、NH+4-N 和NO-2-N 水平。
本研究还发现,各试验组NO3--N 浓度非但没有降低,反而显著升高,推测原因可能是试验池塘DO充足并且呈上升状态,在DO 充足的情况下,硝化细菌等好氧型细菌处于活跃状态,硝化作用强烈,将水体中NH+4-N、NO-2-N 等形式氮转化为NO-3-N 状态。同时,受生物量的限制,水生植物的净化能力是有限的,因而形成较高浓度的NO-3-N 积累[2,25]。这与刘福军等[2]及田功太等[6]的研究结果一致,但与吴伟等[22]及常会庆等[26]的研究结果不同,推测是由于水生植物对N 吸收能力的不同。本试验中采用漂浮植物大薸,吴伟等及常会庆等分别采用沉水植物轮叶黑藻(Hydrilla verticillata)和伊乐藻(Elodea muttalli),同时水体中不同溶解氧含量对加入的微生物菌群的硝化、反硝化作用影响不同,造成水体中NO3--N 水平呈现不同变化趋势。
从各处理组对污染物的去除情况看,微生物-水生植物联合净化体系对N、P 的去除效果与净化体系使用时间呈现较好的正相关关系,在前8 d 对TN、NH4+-N、NO2--N、TP 去除速率较快,8 d 后去除速率明显下降。同时随移植时间的延长,水生植物覆盖面积与去除效果的正相关性越明显,尤其是对去除TP、NO-2-N、COD,EM 菌液+10%大薸组和EM菌液+20%大薸组差异显著,说明适当提高水生植物大薸的覆盖面积,有利于微生物-水生植物联合净化体系去除水中N、P 等营养物质。但是当覆盖面积超过最适范围时,水生植物的自屏效应会影响水体的透光作用,进而影响水体复氧及水体中微生物硝化和反硝化作用的进行。因而,并不是水生植物覆盖面积越大越有利于池塘的水质净化[27]。在本试验中,由于大薸覆盖面积只设置了10%和20% 2个梯度,因此,在构建微生物-水生植物联合净化体系时大薸的最佳覆盖面积仍需进一步研究。但值得说明的是,在本试验期间,各试验组池塘并没有出现鱼浮头,并且3 组处理塘中DO 浓度均随时间显著增加,说明在构建微生物-水生植物联合净化体系时大薸浮床覆盖面积为20%时的效果比10%的效果更好。
[1] 王梦亮,马清瑞,梁生康.光合细菌对鲤鱼养殖水体生态系统的影响[J].水生生物学报,2001,25(1):98-101.
[2] 刘福军,胡文英.光合细菌在盐碱地池塘改良水质的研究[J].淡水渔业,1999,2(10):13-16.
[3] 许志强.固定化光合细菌在暗纹东方鲍养殖中的应用[D].南京:南京师范大学,2006:20-28.
[4] HUYNH A,HONG D U C,SIMONM M,et al.The use of bacterial spore formers as probiotics[J].Annual Review of Microbiology,2005,29(4):813-835.
[5] 邵 青.EM 对生活污水中常见污染物的去除效果[J].中国给水排水,2001,17(3):74-76.
[6] 田功太,刘 飞,段登选,等.EM 菌对海参养殖水体主要污染物净化效果的研究[J].山东农业大学学报,2012,43(3):381-386.
[7] 李 猛,马旭洲,王 武.大薸对网箱养殖长吻鮠生长及氮、磷排放的影响[J].大连海洋大学学报,2012,27(5):402-406.
[8] 童昌华,杨肖娥,濮培民.富营养化水体的水生植物净化实验研究[J].应用生态学报,2005,15(8):1447-1450.
[9] 钟云霄,胡洪营,钱 易.大型水生植物在水污染治理中的应用研究进展[J].环境污染治理技术与设备,2003,4(2):36-40.
[10] 黄 亚,傅以钢,赵建夫.富营养化水体水生植物修复机理的研究进展[J].农业环境科学学报,2005,24(增刊):379-383.
[11] 邵林广.水浮莲净化富营养化湖泊试验研究[J].环境与开发,2001,16(2):28-29.
[12] 娄 敏,廖伯寒,刘红玉,等.3 种水生漂浮植物处理富营养化水体的研究[J].中国生态农业学报,2005,13(3):194-195.
[13] 吾甫尔·米吉提,艾尔肯·热合曼,苏里坦·阿巴拜克力,等.利用水浮莲(Pistia stratiotesL.)净化城市污水的实践[J].中国环境科学,2002,22(3):268-271.
[14] SOOKNAH R D,WILKIE A C.Nutrient removal by floating aquatic macrophytes cultured in anaerobically digested flushed dairy manure wastewater[J].Ecological Engineering,2004,22:27-42.
[15] ZIMMELS Y,KIRZHNER F,MALKOVSKAJA A.Application of
Eichhornia crassipesandPistia stratiotesfor treantment of urban sewage in Isreael[J].Journal of Environmental Management,2006,81:420-428.
[16] NAHLIK A M,MITSCH W J.Tropical treatment wetlands dominated by free-floating macrophytes for water quality improvement in Costa Rica[J].Ecological Engineering,2006,28:246-257.
[17] 王国惠.大薸和海芋对池塘水净化作用研究[J].净水技术,2008,27(6):46-49.
[18] 李 霞.微生物对水体中主要有机碎屑的循环作用[J].松辽学刊:自然科学版,1997(4):34-38.
[19] 李勤生,华 俐.武汉东湖磷细菌种群结构的研究[J].水生生物学报,1989,13(4):340-347.
[20] ROGERS K H,BREEN C M.Decomposition ofPotamogeton criapusL.:The effects of drying on the pattern of mass and nutrient loss[J].Aquattic Botany,1982,12:1-12.
[21] 邹万生,张景来,刘良国,等.有效微生物菌与水生植物联合净化珍珠蚌养殖废水[J].环境工程学报,2012,6(6):1771-1779.
[22] 吴 伟,瞿建宏,王小娟,等.水生植物一微生物强化系统对日本沼虾养殖水体的生物净化[J].生态与农村环境学报,2011,27(5):108-112.
[23] 唐静杰.水生植物-根际微生物系统净化水质的效应和机理及其应用研究[D].无锡:江南大学,2009:2-4.
[24] 李淑英,周元清,胡 承.水生植物净化中微生物变化及净化效果研究[J].环境科学与技术,2009,32(11):75-80.
[25] 黄秀犁,辛明秀.微生物学[M].北京:高等教育出版社,2010:274-276.
[26] 常会庆,杨肖娥,方云英.伊乐藻和固定化细菌共同作用对富营养化水体中养分的影响[J].水土保持学报,2005,19(3):114-117.
[27] 邴旭文,陈家长.浮床无土栽培植物控制池塘富营养化水质[J].湛江海洋大学学报,2001,21(3):29-33.
