山羊PID1 基因组织表达谱及其与肌内脂肪含量的相关性
2014-12-23凌英会丁建平王丽娟张运海章孝荣
殷 捷, 凌英会, 丁建平, 王丽娟, 张运海, 章孝荣
(1.安徽农业大学动物科技学院,安徽 合肥230036;2.安徽省地方畜禽遗传资源保护和生物育种重点实验室,安徽 合肥230036)
磷酸酪氨酸互作结构域1(Phosphotyrosine interaction domain containing 1,PID1)是通过抑制性消减杂交(Suppression subtractive hybridization,SSH)技术筛选的肥胖与正常人腹膜后脂肪组织中差异表达基因[1]。Wang 等[2]发现在肥胖与健康者腹膜后脂肪组织中PID1基因差异表达,且在肥胖者脂肪组织中显著上调。PID1基因在脂肪细胞生长中起着重要的作用[3],已有学者提出将PID1基因作为一个抑制胰岛素而导致肥胖的作用靶位点[4]。PID1基因在脂肪细胞中过表达可显著促进3T3-L1 脂肪前体细胞的增殖,导致脂肪细胞数目增多,进而参与脂肪的发生发展[5]。反之,利用基因敲除手段下调PID1基因表达量后,脂肪细胞中胰岛素敏感的葡萄糖大量摄取,促进IRS-1/PI3K/AKT信号通路,降低葡萄糖的浓度[6]。而且PID1基因参与了多组织胰岛素的敏感调节,脂肪细胞胰岛素敏感性的高低与脂肪沉积密切相关[7]。PID1基因是近年来发现的新基因,作为一种信号分子在细胞生长和成脂过程中直接起作用,在脂肪组织中有PID1的高表达现象。钱源等将猪PID1基因作为重要生产性状候选基因进行研究,通过肌内脂肪(IMF)含量测定与基因表达关联性分析,发现PID1基因与脂肪沉积性状存在一定的关系[8]。
为了进一步验证PID1基因对肌内脂肪含量这一性状的影响,筛选影响山羊生长性状的候选基因,本研究采用Real time-PCR 技术对山羊PID1基因的组织表达特点以及PID1基因在安徽白山羊不同组织脂肪组织中的表达水平和肌内脂肪含量进行关联分析,从分子水平上揭示PID1基因与肌内脂肪含量的关系。
1 材料与方法
1.1 试验材料
试验样品采自合肥博大牧业种羊场。选择0 月龄(6 只)、6 月龄(8 只)和12 月龄(9 只)的安徽白山羊,统一饲养管理,饲喂等量日粮,自由饮水。禁食12 h 后颈静脉放血屠宰。准确称量胴体质量后立即取屠体的心、肝、脾、肺、肾、小肠、脂肪、腿肌、背最长肌和胸肌等10 个组织样,标记后放入液氮保存,后转入实验室-80 ℃冰箱保存,用于PID1基因表达分析。另采集腿肌、背最长肌和胸肌约30 g,置于-20 ℃保存,用于测定肌内脂肪含量。
1.2 试剂和仪器
TIANpure Midi Plasmid Kit、Top10 感受态细胞、pMD18-T Simple Vector 为北京天根生物技术有限公司产品;RNAiso Plus Total 、RNAPrimeScript RT reagent kit 为TaKaRa 公司产品;SYBR Premix 为罗氏公司产品;引物由华大基因公司合成;StepOnePlus实时荧光定量PCR 仪为美国ABI 公司;低温高速离心机(Centrifuge 5417R)为德国Eppendorf 公司产品;PCR 仪、凝胶成像系统为美国Bio-rad 公司产品。电泳仪为北京六一仪器厂产品。
1.3 肌内脂肪(IMF)含量测定
取胸肌、腿肌和背最长肌,去除可见脂肪,粉碎后采用索氏抽提法分别测定胸肌、腿肌和背最长肌的肌内脂肪含量。
1.4 PID1 基因表达分析
1.4.1 总RNA 的提取和反转录 取约100 mg 样品,用TaKaRa 公司的RNAiso Plus Total RNA 试剂提取安徽白山羊各组织的总RNA,将提取到的总RNA 分装。取2 μl 粗提总RNA 在0.8%琼脂糖凝胶上电泳检测完整性,利用分光光度计SMA1000 测定其浓度和纯度,检测合格的RNA 于-80 ℃中保存备用。提取的总RNA 按照TaKaRa 公司Prime-Script RT reagent kit 说明书将RNA 反转录成cDNA,-20 ℃保存备用。
1.4.2 RT-PCR 反应与克隆测序 以cDNA 第一链为模板进行PCR 扩增,分别对反应条件、循环数等进行优化。PID1和GAPDH(3-磷酸甘油醛脱氢酶)基因的PCR 反应体系均为50.00 μl,其中10 ×Ex Tapbuffer 5.00 μl,Ex TapHS 0.25 μl,dNTP mixture 4.00 μl,上下游引物(20 μmol/L)各1.00 μl,cDNA 模板(50 ng)1.00 μl,ddH2O 34.75 μl。PCR扩增程序:94 ℃预变性5 min;94 ℃变性30 s,55 ℃退火30 s,72 ℃延伸1 min,35 个循环;最后72 ℃延伸5 min。PCR 扩增产物经1.5%琼脂糖凝胶电泳检测,采用天根50 bp Marker 作为标记。纯化的DNA 片段与PMD-18T simple 载体连接,并转化TOP10 感受态细胞,均匀涂布于固体培养基(33 g营养琼脂加入1 000 ml 蒸馏水,以1 000∶ 1 的比例加入Amp+)表面,37 ℃培养16 ~18 h 获得重组子,挑取阳性克隆,提取质粒,PCR 鉴定后送华大基因公司测序。
1.4.3 实时荧光定量PCR 及熔解曲线分析 用实时荧光定量仪检测肌肉组织中PID1mRNA 表达水平。反应体系15.0 μl,包括1.5 μl cDNA,0.9 μl 上下游混合引物,7.5 μl SYBR Green mixture,5.1 μl ddH2O。反应条件:95 ℃预变性30 s;95 ℃5 s,60℃31 s,39 个循环。
1.5 安徽白山羊PID1 基因的组织表达特异性分析
以3-磷酸甘油醛脱氢酶(GAPDH)基因作为参照基因,SYBR GreenΙ 为荧光染料,采用RT-qPCR检测安徽白山羊PID1基因在心、肝、脾、肺、肾、小肠、脂肪、腿肌、背最长肌和胸肌10 个组织中的相对表达量。以cDNA 为模板,用定量引物进行检测,其反应体系(15.0 μl)为:1.5 μl cDNA,0.9 μl上下游混合引物,7.5 μl SYBR Green mixture,5.1 μl ddH2O。于ABI StepOne RT-PCR 反应仪上进行检测,其反应条件为:95 ℃预变性30 s;95 ℃5 s,60 ℃31 s,39 个循环,60 ℃捕捉荧光值。每个组织重复检测4 次。采用2-ΔΔCt法进行相对定量分析,其中ΔCt=CtPID1-CtGAPDH,ΔΔCt= ΔCt组织-ΔCt腿肌。
1.6 定量引物设计
根据GenBank 中已公布的山羊的PID1基因(JN257257)序列,采用premier5.0 软件设计目的基因上下游引物。以持家基因GAPDH为内参,根据GenBank 中山羊GAPDH基因(AJ431207.1)序列设计引物(表1)。所有引物均由华大基因公司合成。
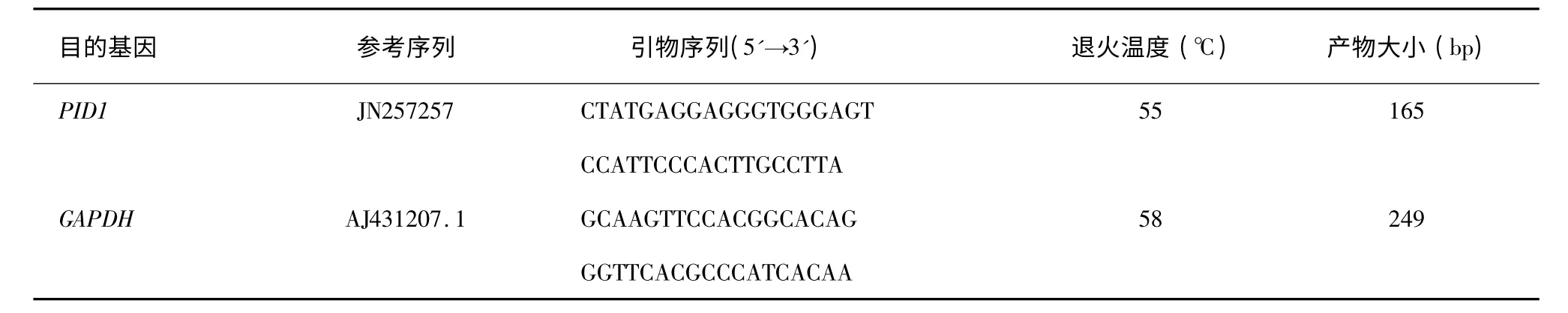
表1 目的基因引物序列Table 1 Primer sequence of the target genes
1.7 数据分析
根据熔解曲线来判断PCR 反应的特异性,根据荧光定量PCR 的Ct值和标准曲线中的扩增效率计算定量试验结果。所得结果采用MX3000p 定量软件进行分析。相对定量的结果采用2-ΔΔCt方法进行分析。
2 结果与分析
2.1 各部分肌肉内脂肪含量的比较
选取0 月龄组、6 月龄组和12 月龄组3 个生长阶段个体,屠宰后分别测定背最长肌、腿肌和胸肌的肌内脂肪(IMF)含量。随着月龄的增加,山羊各部分肌肉肌内脂肪含量的发育性变化模式基本一致,呈上升趋势,且0 ~12 月龄背最长肌IMF 含量均显著高于腿肌和胸肌(表2)。
2.2 PID1 基因的时空表达谱分析
通过测序和Blast 比对发现,PID1和GAPDH基因的TR-PCR 扩增产物片段大小与预期一致,同源性在99%以上,其中GAPDH基因同源性为100%。利用实时定量PCR 对心、肝、脾、肺、肾、小肠、脂肪、腿肌、背最长肌和胸肌10 个组织中PID1基因的表达情况进行检测,检测结果见图1。PID1基因在所有组织中均表达,其中在0 月龄肺、6 月龄小肠和脂肪、12 月龄脂肪组织中高度表达,在0 月龄肝、6 月龄肝、脾和肺及12 月龄的脾和肺部组织中度表达,在其余组织中相对低度表达。
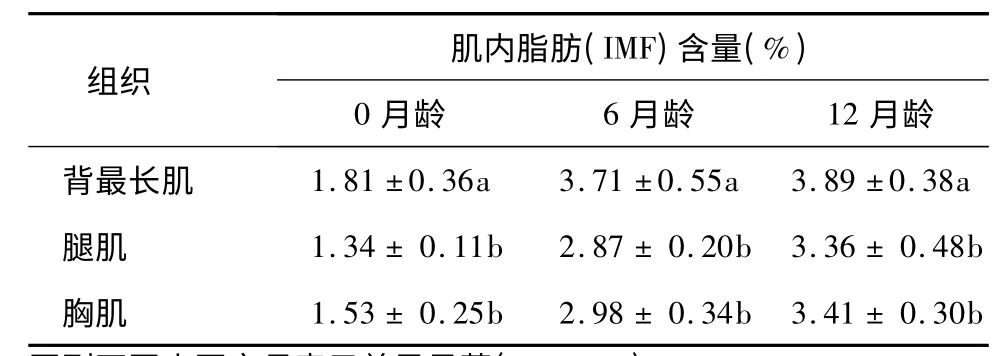
表2 3 个组织的肌内脂肪含量比较Table 2 The comparison of IMF content among three tissues

图1 PID1 基因的相对表达谱Fig.1 The relative expression level of PID1 gene
由图2 可见,随着年龄的增加,肝脏中PID1表达量呈显著直线下降趋势(P<0.05),脾中PID1表达量逐渐上升,心PID1表达量先上升后下降,肺中PID1表达量先下降后上升;PID1在肾中一直为低表达,12 月龄时有稍微上升的趋势;腿肌、背最长肌和胸肌中的PID1基因表达量均呈上升的趋势。

图2 各组织PID1 基因表达量的发育性变化Fig.2 The developmental changes of the expression level of PID1 in tissues

图3 脂肪组织中PID1 表达量的发育性变化Fig.3 The developmental changes of the expression level of PID1 in the adipose
2.3 脂肪组织中PID1 基因表达水平分析
利用实时荧光定量技术对各月龄组山羊PID1基因表达水平进行检测,结果(图3)显示各月龄组间脂肪组织PID1基因表达水平均差异显著(P<0.05)。
2.4 PID1 基因表达水平与肌内脂肪含量的相关性
对山羊脂肪组织PID1基因mRNA 表达量及肌内脂肪含量进行简单线性相关分析,结果表明0 ~12 月龄期间PID1基因mRNA 表达量与背最长肌IMF 含量呈显著相关(r= 0.968,P<0.05),而PID1表达量与腿肌(r= 0.910)和胸肌(r= 0.879)IMF 含量间没有显著相关(P>0.05)。
3 讨论
大量遗传学、药理学和生理学试验结果表明,PID1在细胞生长和成脂过程中起直接调节作用,对于啮齿类动物的研究也证实了这一点[9]。PID1基因有一个PTB(磷酸酪氨酸作用位点)结构域,与信号蛋白shc 上PTB 结构域相似,参与生长因子刺激下细胞增殖等下游效应[10]。PTB 结构域可参与低密度脂蛋白受体信号转导途径,在哺乳动物中首先作为一种失效(Dab-1)蛋白使小鼠mdabl基因自发常染色体隐形突变[11]。近年来研究发现PID1基因在3T3-L1 脂肪细胞中过表达能够显著下调脂肪细胞胰岛素信号途径中胞膜葡萄糖转运密切相关的基因-葡萄糖转运子4(GLUT4)的表达[12],明显促进3T3-L1 前体脂肪细胞增殖,不影响脂肪细胞的分化过程[13]。同时张春梅[14]等的研究结果也证明,PID1基因过表达能抑制胰岛素刺激直接影响脂肪细胞对葡萄糖摄取,并抑制葡糖的转换,进而影响机体的胰岛素敏感性,导致脂肪组织的沉积。有研究结果表明,参与能量代谢的基因可能会影响家畜的重要经济性状[15]。这一结论在陈哲等[16]、王兴平[17]等的试验结果中得到印证。Xu 等[18]从天府山羊中克隆出PID1基因,获得一段896 bp 的cDNA序列,PID1基因在天府山羊背最长肌中的表达随着年龄的增长而显著增加。
本研究发现PID1基因在不同组织(如肺、小肠、脂肪组织、肝、脾)呈中度、高度表达,这与对猪的研究结果相符[19]。肝脏中PID1基因表达显著降低(P<0.05),而脂肪组织中PID1表达呈显著增长趋势(P<0.05),这一结果可能与肝脏是机体脂肪代谢的重要器官相关[20]。如果能利用RNAi 等技术进一步降低组织中PID1基因表达水平,或许能直接观察到PID1的表型效应。PID1基因在不同个体脂肪组织中表达水平的检测结果表明,随着肌内脂肪含量的增加,PID1的表达水平呈递增趋势,且各月龄组之间表达量差异显著(P<0.05),这与其在成脂过程中的调节功能是相一致的。进一步的相关分析结果表明,0 ~12 月龄期间PID1基因的表达量与背最长肌肌内脂肪含量呈显著相关(r=0.968,P<0.05),与Xu 等[18]的结论一致;PID1基因表达量与0 ~12 月龄腿肌肌内脂肪含量间的相关系数r=0.910,但未达到显著水平;PID1基因表达量与0 ~12月龄胸肌肌内脂肪含量间的相关系数r=0.879,也未达到显著水平。以上结论说明PID1基因的表达量与山羊脂肪沉积有关联。PID1的表达对腿肌和胸肌IMF 没有影响,但不足以说明其只对山羊背最长肌有影响,因为腿肌和胸肌中IMF 含量差异不显著,这需要扩大群体数量重新选择样本进行研究。
本研究利用实时定量PCR 技术对PID1基因在山羊不同体组织中的表达情况进行了研究,发现其在心、肝、脾、肺、肾、小肠、脂肪、腿肌、背最长肌和胸肌中均有不同程度的表达。进一步研究PID1基因在不同个体脂肪组织中的表达水平,发现PID1基因的表达量均与背最长肌、腿肌和胸肌IMF 相关。进一步证明了PID1基因可以作为影响山羊育肥性状的重要分子遗传标记进行研究,为优质肉羊的选育提供了理论依据。
[1] QIU J,NI Y H,GONG H X,et al.Identification of differentially expressed genes in omental adipose tissues of obese patients by suppression subtractive hybridization[J].Biochem Biophys Res Commun,2007,352(2):469-478.
[2] WANG B,ZHANG M,N I Y,et al.Identification and characterization of NYGGF4,a novel gene containing a phosphotyrosinebinding(PTB)domain that stimulates 3T3-L1 preadipocytes proliferation[J].Gene,2006,379:132-140.
[3] ZHAO Y,ZHANG C,ZHU C,et al.NYGGF4 homologous gene expression in 3T3-L1 adipocytes:regulation by FFA and adipokines[J].Mol Biol Rep,2010,37(7):3291-3296.
[4] YU Z,GUO X.NYGGF4 as a new therapeutic target for obesityassociated insulin resistance[J].Med Hypotheses,2012,78(4):432-434.
[5] 吴伟玲,王 玢,张 敏,等.肥胖相关新基因NYGGF4对3T3-L1 脂肪前体细胞的增殖调节作用[J].实用儿科临床杂志,2008 (7):498-500.
[6] ZENG X Q,ZHANG C M,TONG M L,et al.Knockdown of NYGGF4 increases glucose transport in C2C12 mice skeletal myocytes by activation IRS-1/PI3K/AKT insulin pathway[J].J Bioenerg Biomembr,2012,44(3):351-355.
[7] WU W,GAN W,TONG M,et al.Over -expression of NYGGF4(PID1)inhibits glucose transport in skeletal myotubes by blocking the IRS1/PI3K/AKT insulin pathway [J].Mol Genet Metab,2011,102(3):374-377.
[8] 钱 源,曾勇庆,杜金芳,等.猪PID1基因CDS 区的克隆及其mRNA 表达与肌内脂肪沉积关系[J].遗传,2010,32 (11):1153-1158.
[9] DULOR J P,REYNE Y,NOUGUES J.In vivoeffects of a treatment with antibodies to adipocyte plasma membranes in the rabbit[J].Reprod Nutr Dev,1990,30(1):49-58.
[10] LIAO Y C,SI L,DEVERE W R W,et al.The phosphotyrosineindependent interaction of DLC-1 and the SH2 domain of cten regulates focal adhesion localization and growth suppression activity of DLC-1[J].Cell Biol,2007,176(1):43-49.
[11] GOTTHARD M,TROMMSDORFF M,NEVITT M F,et al.Interactions of the low density lipoprotein receptor gene family with cytosolic adaptor and scaffold proteins suggest diverse biological functions in cellular communication and signal transduction[J].J Biol Chem,2000,275(33):25616-25624.
[12] ZHANG C M,CHEN X H,WANG B,et al.Over-expression of NYGGF4 inhibits glucose transport in 3T3-L1 adipocytes viaattenuated phosphorylation of IRS-1 and Akt[J].Acta Pharmacol Sin,2009,30(1):120-124.
[13] CHIBA T,YAMAZA H,KOMATSU T,et al.Pituitary growth hormone suppression reduces resist in expression and enhances insulin effectiveness:relationship with caloric restriction[J].Exp Gerontol,2008,43(6):595-600.
[14] 张春梅,邱 洁,陈小慧,等.NYGGF4基因过表达对脂肪细胞胰岛素敏感性及分泌功能的影响[J].中国当代儿科杂志,2009,11(10):846-849.
[15] SHERMAN E L,NRUMAH J D,MURDOCH B M,et al.Polymorphismsandhaplotypes in the bovine neuropeptide Y,growth hormonecarcass merit in beef cattle and their associations with measures of growth,performance,feed efficiency,andreceptor,ghrelin,insulinlike growth factor 2,and uncoupling proteins 2 and 3 genes[J].J Anim Sci,2008,86:1-16.
[16] 陈 哲,于峰祥,于建宁,等.猪UCP3基因第4 内含子BccⅠ多态性检测及其与胴体和肉质性状的关联分析[J].江苏农业学报,2012,2(6):1338-1343.
[17] 王兴平,罗仍卓么,李 峰,等.湘西黄牛LPL exon 5 的多态性与生长性状的相关性[J].江苏农业学报,2012,28(4):792-796.
[18] XU H G,XU G Y,WANG D H,et al.Molercular cloning and tissue distribution of the phosphotyrosine interation domain containing 1 (PID1)gene in Tianfu goat[J].Gene,2013,515:71-77.
[19] QIAN Y,ZENG Y Q,CUI J X,et al.Functional analysis and tissue specific expression profile of PIDl gene in Laiwu pig[J].Acta Veterinaria et Zootechnica sinica,2011,42(5):621-628.
[20] KULLAK-UBLIK G A,STIEGER B,MEIER P J.Enterohepatic bile salt transporters in normal physiology and liver disease[J].Gastroenterology,2004,126(1):322-342.
