双硫腙接枝聚氨酯泡塑吸附材料的制备及其除汞性能的研究
2014-12-23康莹刘建
康莹,刘建
(长安大学 环境科学与工程学院,陕西 西安 710054)
汞是环境中具有强烈生理毒性的重金属元素之一,具有高毒、难降解和生物富集的特点,不同价态的无机汞在进入环境后,自然条件下通过微生物活动或光化学作用,会转化为毒性更强的甲基汞,且易于通过饮用水和食物链等途径进入人体,造成心血管、肾脏、胃肠、中枢神经系统的损伤[1-2]。污染水体中的汞主要来自工业废水的排放以及汞矿床的扩散等[3]。
水体中的无机汞主要以Hg2+形式存在,目前针对含汞污染水体采取的处理方法主要有常规混凝沉淀法、化学沉淀法、离子交换法[4]、膜分离技术[5]、溶剂萃取法及吸附法等。常规混凝沉淀法[6]对溶解态汞的去除能力有限,在较高的Hg2+浓度情况下,难以保证出水水质;化学沉淀法(如硫化汞沉淀法[7])易造成水体二次污染;离子交换法成本较高。吸附法由于具有工艺简单,效果稳定,适用于大流量低浓度污染物的去除[8]等优点,而成为最有潜力的汞污染控制方法,吸附剂种类很多,其中,高成本的活性炭吸附剂激发了人们对低成本吸附材料的探索,包括飞灰、树皮等用于去除水体中Hg2+的研究已见报道。
依据软硬酸碱规则,在水溶液中,Hg2+可与软碱类配体发生配位作用形成稳定配合物。利用该性质,可开发一种固载有软碱类配体的吸附材料,Hg2+与该配体形成稳定螯合物而固定在该吸附材料上,从而达到去除水溶液中Hg2+的目的。含有N和S 配位离子的双硫腙是软碱,具有螯合Hg2+的能力[9],将双硫腙固载在能从废水中分离的载体上,对水溶液中的重金属离子进行螯合,再通过载体与溶液的固液分离,达到去除重金属离子的目的。本文以聚氨酯泡塑为载体,利用其主链上含有的氨基甲酸酯基团链节,按照Mannich 反应[10],通过甲醛甲基化,接枝螯合基团双硫腙,便可得到一种安全、廉价又具有去除重金属离子能力的新型材料,并考察其去除废水中Hg2+的性能和机理。
1 实验部分
1.1 试剂与仪器
聚氨酯泡塑(PU Foam)、双硫腙(H2D2)、甲醛、氢氧化钠、盐酸、碘化钾、醋酸钠、苯、孔雀石绿、冰醋酸、硝酸汞、硝酸均为分析纯;实验用水为蒸馏水。
721 型分光光度计;DK-98-1 型电热恒温水浴锅;JJ-1 精密增力电动搅拌器;pHS-3C 精密pH 计;101-1 电热鼓风干燥箱;BT224S 电子天平;HY-2 调速多用振荡器。
1.2 实验原理
1.2.1 螯合PU Foam 制备过程 PU Foam 主链上含有氨基甲酸酯基团链节,其氨基上氢具有反应活性,在甲醛存在下,可与H2D2(碱性胺)发生三元缩合反应,即Mannich 反应,得到β-氨基化合物。
①PU Foam 与甲醛反应使酰胺基部分羟甲基化:
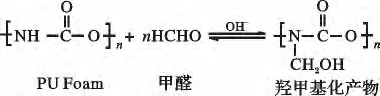
②羟甲基化产物与双硫腙接枝反应如下:
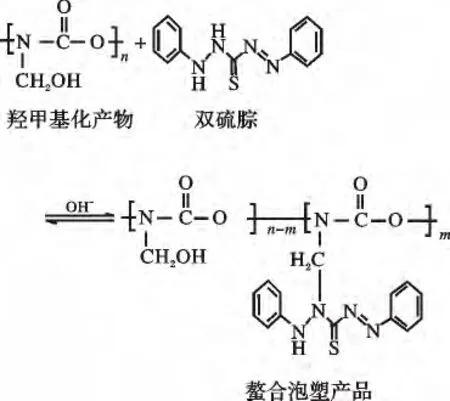
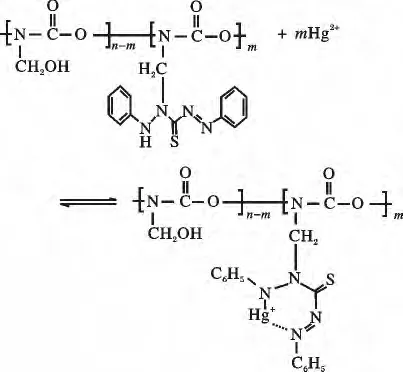
1.2.2 螯合泡塑对汞离子螯合吸附过程双硫腙接枝在PU Foam 上仍具有螯合能力,根据软硬酸碱规则,可和Hg2+形成稳定螯合物而使之固定在泡塑上,从而达到去除水中Hg2+的效果,过程机理如下:
1.3 实验方法
1.3.1 螯合PU Foam 制备方法称取1 g PU Foam
放入三口瓶中,加入100 mL 蒸馏水并调节pH 值,加入一定量甲醛溶液,缓慢滴加50 mL(pH 同上)含一定质量双硫腙的溶液,在一定温度下反应一段时间,即得双硫腙接枝聚氨酯泡塑。
1.3.2 螯合PU Foam 吸附Hg2+测定方法吸附汞实验采用常规静态法。在250 mL 锥形瓶中加入50 mL 一定浓度的含Hg2+溶液及一定质量的螯合PU Foam,进行振荡吸附,吸附余液用分光光度法测定残余汞的吸光度,计算吸附率。
1.4 分析方法
1.4.1 接枝率的测定方法溶液中双硫腙浓度由分光光度法测定。对某一确定浓度双硫腙溶液,以蒸馏水作参比,在分光光度计上改变波长380 ~600 nm,每隔10 nm 测定一次吸光度。以波长为横坐标,吸光度为纵坐标,绘制双硫腙吸光度曲线,并找出最大吸收波长,见图1。
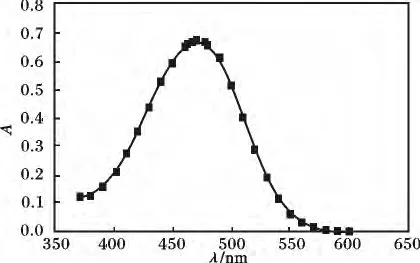
图1 双硫腙吸光度曲线Fig.1 Absorbance curve of H2D2
由图1 可知,双硫腙的最大吸收波长出现在λ=472 nm 处。
双硫腙标准曲线绘制,分别配制2,4,6,8,10 mg/L 双硫腙溶液,在λ =472 nm 下测定其吸光度,得回归方程:y=0.073x +0.020,R2=0.995。其中y 为吸光度,x 为双硫腙浓度。接枝率(η)的计算:
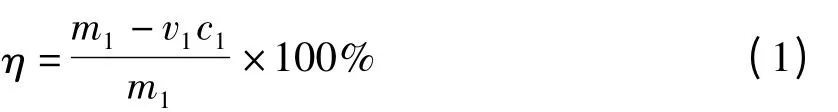
式中 η——接枝率,%;
m1——双硫腙初始量,mg;
v1——双硫腙溶液体积,mL;
c1——由吸光度A 经回归方程计算出的反应余液的双硫腙浓度,mg/L。
1.4.2 Hg2+去除率的测定方法溶液中汞含量由苯萃取光度法[11]测定,吸收波长λ =630 nm;标准曲线方程为:y =0.062x +0.009,R2=0.999。去除率的计算公式:

式中 E——Hg2+去除率,%;
v2——含Hg2+溶液体积,mL;
c2——Hg2+溶液初始浓度,mg/L;
m2——由吸光度A 经回归方程计算出的v2反应余液中Hg2+的含量,mg。
2 结果与讨论
2.1 螯合PU Foam 吸附材料的合成
该吸附材料处理含Hg2+废水时,理论上双硫腙接枝率越高,吸附效果越好,所以后续实验通过比较接枝率大小确定最佳合成条件。
2.1.1 pH 对接枝率的影响固定以下实验条件不变:聚氨酯泡塑1 g,双硫腙0.1 g,甲醛3.5 mL,反应温度30 ℃,反应时间2.5 h。调节反应体系pH值并测定接枝率。由于pH <10 时,双硫腙溶液极不稳定易析出,故本实验pH 值限定在10 ~14。结果见表1。
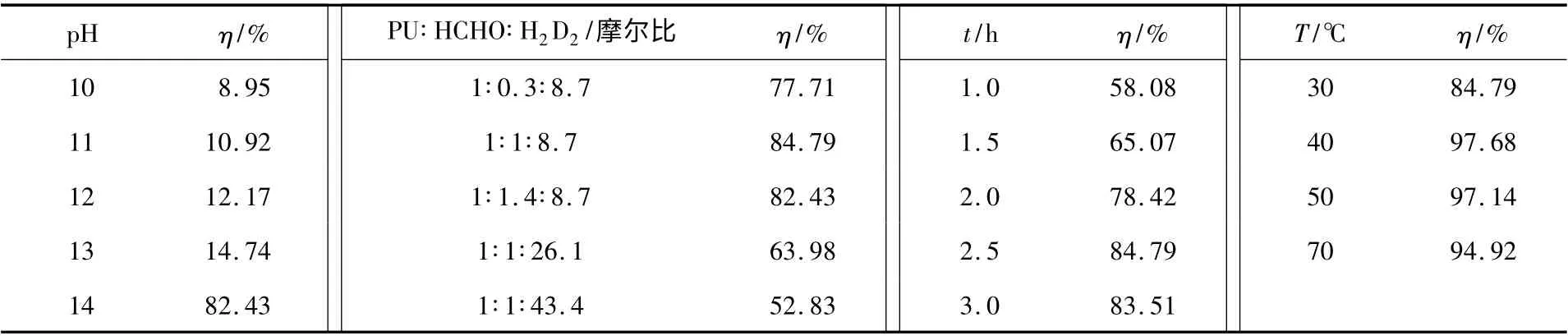
表1 不同pH、时间、物料比、温度条件下合成产物的接枝率Table 1 The grafting rate under different pH value,time,ratio of materials,temperature condition
由表1 可知,当pH 在10 ~13 范围内,接枝率不高,不超过15%;当pH >13 接近14 时,接枝率上升至82.43%;当体系碱度大于pH =14 时,考虑到溶液稳定性问题,没有再进行考察。所以,可把pH=14 作为双硫腙接枝聚氨酯泡塑的最佳条件。
2.1.2 反应时间、物料比、温度的确定固定其它反应条件不变,pH =14 条件下,分别改变体系的反应时间、物料比、反应温度,测定所得产物的接枝率,见表1。
由表1 可知,合成双硫腙接枝聚氨酯泡塑吸附材料的最佳条件为:pH =14,物料比为1∶1∶8.7,反应温度30 ℃,反应时间2.5 h。
2.2 螯合泡塑吸附Hg2+性能实验
2.2.1 pH 对去除率的影响固定以下实验条件:50 mL 8 mg/L Hg2+溶液中放入0.5 g 螯合泡塑,t=4 h,T =15 ℃,在不同pH 值条件下测定汞去除率,结果见图2。
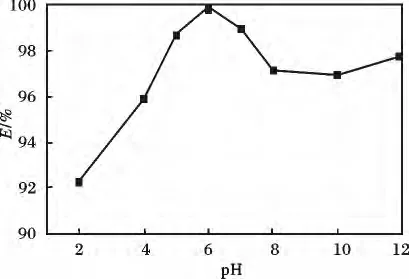
图2 pH 对去除率的影响Fig.2 Effect of pH on removal rate
由图2 可知,去除率随pH 值的上升先增加后降低,最佳pH 为6。
2.2.2 反应时间对去除率的影响其它条件不变,pH=6,在反应不同时间下测定吸光度,并计算汞去除率,见图3。
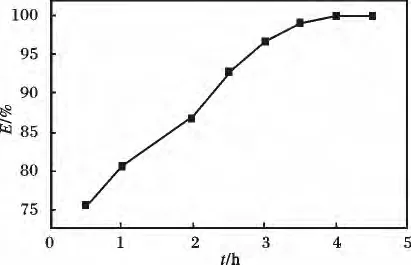
图3 时间对去除率的影响Fig.3 Effect of time on removal rate
由图3 可知,随吸附时间的延长,Hg2+去除率呈上升趋势,当吸附时间为0.5 h 时,去除率达到75.60%,说明此段时间内吸附速率较快。随着溶液中Hg2+浓度的降低,吸附速率逐渐变慢,当吸附时间为4 h 时,去除率达99.99%,此后随吸附时间的增加,去除率保持稳定,因此,确定吸附时间为4 h。由于该吸附过程属于螯合配位反应,应需要一定的活化能,所以反应时间较长。
2.2.3 固液比对去除率的影响 pH=6,反应时间4 h,考察不同螯合泡塑用量下的去除率,见图4。
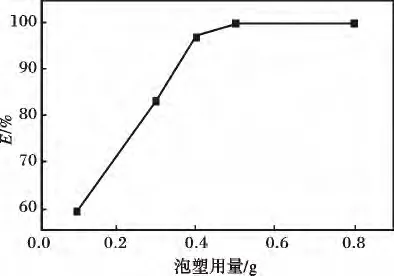
图4 固液比对去除率的影响Fig.4 Effect of PU foam amount on removal rate
由图4 可知,去除率随泡塑量的增加而增大,当泡塑量≥0.5 g 时,去除率趋于平稳,为99.99%,故选择每50 mL 溶液时泡塑质量0.5 g,即固液比为1∶100。结果表明,该螯合泡塑对溶液中的Hg2+具有较高的去除效率。
2.2. 4 温度对去除率的影响 50 mL 20 mg/L Hg2+溶液中放入0.5 g 螯合泡塑,pH =6,t =4 h,不同温度条件下的去除率,见图5。
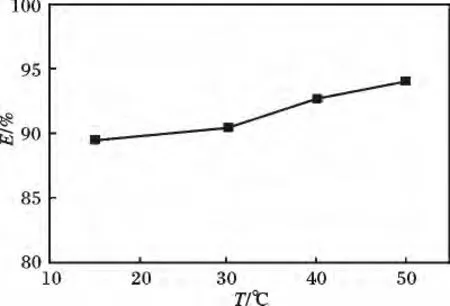
图5 温度对去除率的影响Fig.5 Effect of temperature on removal rate
由图5 可知,该螯合泡塑对Hg2+的去除率随温度升高而缓慢增大,考虑到实验操作及去除率增幅不大等方面,取室温为反应温度。
2.2.5 共存离子对去除率的影响选择汞回收废液中常见离子为共存离子,并与Hg2+在不同浓度比率下共存,考察共存离子对吸附率的影响,结果见表2。
常见共存阳离子K+、Na+、Ca2+、Mg2+及阴离子Cl-、SO42-、NO3-对Hg2+的去除基本没有影响,因为这些离子与吸附材料上的螯合基团没有配位作用。而Zn2+、Fe2+、Cu2+对Hg2+的去除有轻微干扰,这是因为Zn2+、Fe2+、Cu2+属于软硬交界碱,可与吸附材料上的螯合基团进行配位,与Hg2+形成竞争。
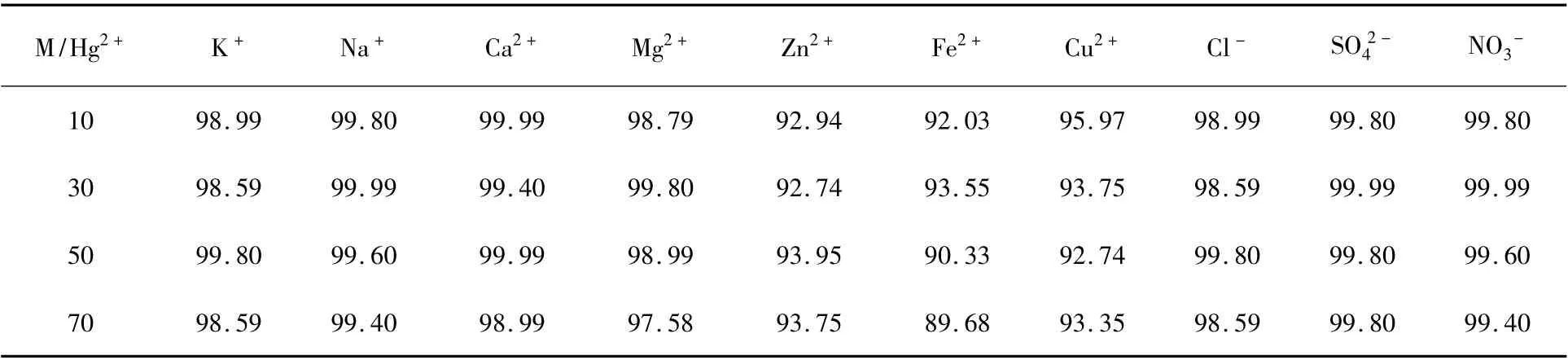
表2 共存离子(M)对去除率的影响Table 2 Effect of coexisting ion on removal rate %
2.3 吸附等温线和饱和吸附量
分别在50 mL,初始浓度为20,30,40,50,60 mg/L的Hg2+溶液中放入0.5 g 螯合泡塑,在pH=6,t=4 h,T=15 ℃条件下振荡至吸附平衡,测定各自的平衡浓度,计算相应的平衡吸附量和Hg2+去除率。见图6。
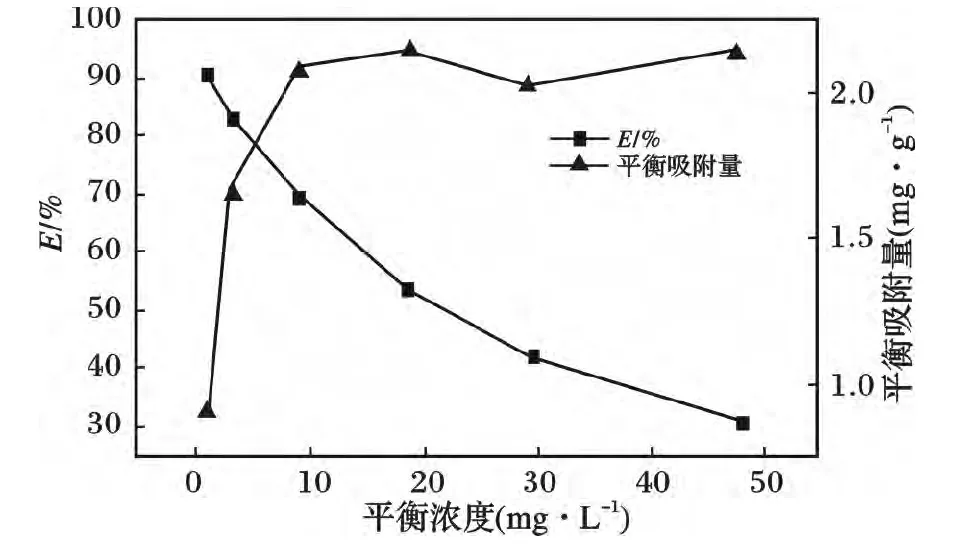
图6 Hg2+吸附等温线Fig.6 Sorption isotherms of mercury
3 结论
(1)以聚氨酯泡塑为骨架,通过Mannich 反应,将双硫腙部分接枝在聚氨酯泡塑分子链上,获得具有螯合Hg2+能力的新型螯合泡塑吸附材料。
(2)实验表明,该螯合泡塑除Hg2+效果明显,对8 mg/L 含Hg2+废液,在pH=6,固液比为1∶100,温度15 ℃条件下反应4 h,汞去除率可高达99.99%。吸附过程属于Langmuir 单分子层吸附,饱和吸附量为2.17 mg/g,可对水中痕量Hg2+进行深度吸附处理。该螯合泡塑合成工艺简单,成本低廉,有望实际应用到含汞废水的处理中。
[1] Mark C,Houston M D.Role of mercury toxicity in hyper-tension,cardiovascular disease,and stroke[J]. J Clin Hyp,2011,13:621-627.
[2] Thomas Y,Chan K.Inorganic mercury poisoning associated with skinlightening cosmetic products[J]. Clin Toxicol,2011,49:886-891.
[3] 江津津,曾庆孝,阮征,等. 水产品中汞与甲基汞风险评估的研究进展[J]. 食品工业科技,2007,28(11):244-246.
[4] Chiarle S,Ratto M,Rovatti M.Mercury removal from water by ion exchange resins adsorption[J]. Water Res,2000,34(11):2971-2978.
[5] Chakrabarty K,Saha P,Ghoshal A K. Separation of mercury from its aqueous solution through supported liquid membrane using environmentally benign diluent[J].Membrane Sci,2010,350(1/2):395-401.
[6] 张景成,沈志恒,李圭白.混凝法去除水中重金属的机理探讨[J].哈尔滨建筑大学学报,1996,29(5):55-58.
[7] 胡海洋.重金属废水治理技术概况及发展方向[J].中国资源综合利用,2008,26(2):22-25.
[8] Fu F L,Wang Q. Removal of heavy metal ions from wastewaters:A review[J]. J Environ Manage,2011,92:407-418.
[9] Liu J,Wu R L.Preparation of grafting triethylenetetramine chelating flocculant and its performance of removing lead[C]//International Conference on Bioinformatics and Biomedical Engineering.Wuhan:IEEE Press,2012.
[10]姚旭,王景存,付志峰,等.Mannich 反应在聚氨酯中的应用[J].聚氨酯工业,2008,23(6):1-4.
[11]国家环保总局《水和废水监测分析方法》编委会.水和废水监测分析方法[M].北京:中国环境科学出版社,2002:379-384.
[12]Bellot J C,Condoret J S.Modelling of liquid chromatograpHy equilibria[J].Process Biorchem,1993,28(2):365-376.
