长白山药用真菌鸡爪苓菌丝体全长cDNA文库的初步构建
2014-12-22廖鏖栾换东李太元李艳茹许广波延边大学农学院吉林延吉133002
廖鏖,栾换东,李太元,李艳茹,许广波(延边大学农学院,吉林延吉133002)
鸡爪苓是我国长白山区特有的野生猪苓(Polyponus umbellatus(Pers.)Fr)种属,其菌核体形细长,分枝较多,表面多褶皱,形如鸡爪[1-4]。XING 等[5]通过对产自不同地区猪苓菌核的nrDNA ITS和28S rRNA(LSU)序列进行比对分析后,提出鸡爪苓与陕西等地所产猪苓的种内遗传背景不同,应列为单独类群。猪苓菌核是由大量菌丝体相互缠绕组成的休眠体,也是其药用部位,具有利尿渗湿、免疫调节、抗肿瘤的作用[6-9]。目前,国内针对猪苓的研究主要集中于化学活性物质的分离纯化、药理活性的测定和遗传分类等方面,有关猪苓分子生物学方面的研究较少,刘开辉等[10]通过rDNA,ITS(1,2)序列分析研究了不同地区猪苓的亲缘关系,宋超等[11]克隆猪苓拟核cDNA,得到溶血素全长cDNA。
cDNA文库即生物在某个发育时期内所转录的全部mRNA经反转录形成的cDNA片段与载体连接而形成的包含全部mRNA信息的cDNA克隆集合[12],主要包括全长cDNA文库、均一化cDNA文库和消减cDNA文库。全长cDNA文库的构建、测序和功能注释是了解生物体结构和功能的重要方法[13]。笔者采用SMART技术,MMLV-RT反转录酶作用微量总RNA,快速构建了鸡爪苓菌丝体全长cDNA文库,为研究鸡爪苓生长分化的分子机制提供理论基础。
1 材料与方法
1.1 材料 鸡爪苓菌丝体由采自长白山区野生鸡爪苓菌核经组织分离后得到,菌株经纯化后保存于延边大学微生物学与免疫学教学实验中心。
Trizol reagent购于Invitrogen公司,SMARTTMcDNA Library Construction Kit User Manual,Advantage 2 PCR Kit购于clontech公司,MaxPlaxTMLambda Packaging Extracts购于Epicentre公司。
1.2 方法
1.2.1 鸡爪苓菌丝体总RNA的提取。取经纯培养7、14、21、28 d的鸡爪苓菌丝体,用液氮研磨成粉末(3次),加入1 ml Trizol,按照Trizol reagent说明书提取鸡爪苓菌丝体的总RNA,-80℃保存备用。
1.2.2 SMART法合成cDNA。加入总RNA、SMARTⅣ Oligonucleotide、CDS Ⅲ/3’PCR Primer,轻轻混匀后 72 ℃水浴 2 min,冰浴 2 min。再加入 5 × First-Strand Buffer、DTT、dNTP Mix、SMARTScribe MMLV RT,42 ℃水浴1 h,合成 First-Strand cDNA。取2 μl First-Strand cDNA至PCR管,加入去离子水、10 × Advantage 2 PCR buffer、50 × dNTP Mix、5'PCR Primer、CDSⅢ/3'PCR Primer和50×Advantage 2 Polymerase Mix。轻轻混匀后进行LD-PCR,反应条件:95℃ 1 min、95℃ 15 s、68℃ 6 min,22个循环,合成ds cDNA,4℃保存备用。
1.2.3 cDNA的纯化与酶切。将PCR产物用Proteinase K消化,酚仿抽提浓缩,用SfiⅠ酶切。采用CHROMA SPIN-400柱进行分级分离,收集单滴组分于16个离心管中,1%琼脂糖凝胶电泳检测分级分离结果,收集大于500 bp的基因片段组分,用醋酸钠、糖原和95%乙醇浓缩,溶解于7 μl去离子水中,-20℃保存备用。
1.2.4 λTripIEx2 载体的连接。分别取0.5、1.0 μl cDNA 与1 μl λTripIEx混合,加入T4连接酶,16℃过夜。混合2管连接产物,包装蛋白MaxPlaxTMLambda Packaging Extracts包装连接产物,加入600 μl噬菌体稀释缓冲液,25 μl氯仿,振荡混匀,去沉淀,即为原始文库。
1.2.5 原始文库的检测。将原始文库稀释10倍后,取1、10 μl与200 μl XL1-Blue的菌悬液混合,37 ℃孵育15 min,再加入IPTG和X-Gal各50 μl,移至3 ml顶层琼脂培养基,均匀倾倒于LB/MgSO4平板,37℃培养,检测噬菌斑蓝白斑数。
1.2.6 文库的扩增及检测。取10 μl原始文库与500 μl XL1-Blue的菌悬液混匀,37℃孵育15 min,移至3 ml顶层琼脂培养基,均匀倾倒于LB/MgSO4平板,37℃培养10 h,每个平板加10 ml噬菌体稀释缓冲液,4℃过夜,室温振荡1 h后收集缓冲液,分装至50 ml离心管,加入10 ml氯仿,7 000 r/min离心10 min,取上清,即为已扩增鸡爪苓菌丝体cDNA文库,保存备用。参照“1.2.5”滴定扩增的文库(不加IPTG和X-Gal)。随机选取23个噬菌斑,加入400 μl噬菌体稀释缓冲液,4℃过夜。取1 μl模板进行PCR鉴定。PCR反应条件:94 ℃ 2 min,94 ℃ 30 s,55 ℃ 30 s,72 ℃ 1 min,72 ℃ 10 min;30个循环。
1.2.7 EST分析。取5 μl鸡爪苓菌丝体全长cDNA文库,转入质粒pTriplEx2载体。随机选取20个单个菌落,采用菌落PCR检测转入成功率。根据PCR结果,选择6个片段较长的cDNA进行EST分析。
2 结果与分析
2.1 鸡爪苓菌丝体总RNA的提取 参照Trizol reagent试剂盒说明书,提取鸡爪苓菌丝体总RNA(图1)。结果显示,菌丝体培养时间不同,总RNA的产率不同。7、14 d鸡爪苓菌丝体总 RNA 的产量较高,分别为144.156、220.104 μg,28S与18S条带清晰,比例约为1.5∶1.0。鸡爪苓菌丝体培养21和28 d 产量较低,分别为71.638、3.580 μg,28S 与 18S 条带清晰,比例约为 1.5∶1.0。
2.2 鸡爪苓菌丝体的cDNA合成 用MMLV Reverse Transcriptase将鸡爪苓菌丝体总RNA反转录合成cDNA第一链,通过LD-PCR合成双链cDNA。电泳检测,cDNA弥散于500~2 500 bp(图2),符合cDNA文库建库标准。
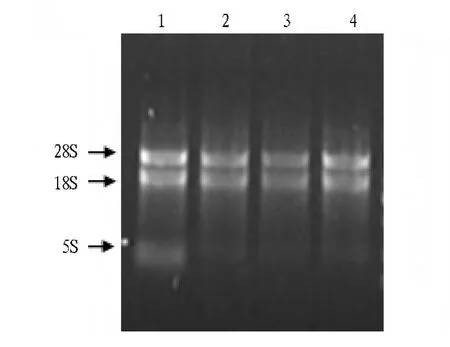
图1 Trizol法提取不同时间段鸡爪苓菌丝体总RNA

表1 不同时间段鸡爪苓菌丝体总RNA的提取

图2 LD-PCR合成产物双链cDNA

图3 鸡爪苓菌丝体cDNA的分级分离
2.3 cDNA片段的分级分离 鸡爪苓菌丝体cDNA经SfiI酶切后,用CHROMA SPIN-400柱进行分级分离,结果显示在第7管开始出现cDNA(图3),收集第7~10个离心管内cDNA,纯化浓缩。
2.4 文库的滴度与插入片段的PCR检测 原始文库的滴度为1.66×106pfu/ml,蓝白斑筛选重组率为96.97%,扩增文库的滴度为3.88×109pfu/ml,达到文库构建标准。随机选取23个噬菌斑的PCR检测,PCR产物主要位于500~1 000 bp(图4),符合EST测序的需要。

图4 cDNA文库插入片段的PCR产物
2.5 EST序列的分析 挑选5个单克隆,命名为cbsjzl1-5,(GenBank accession number:KM406240-KM406244),进行测序。5个单克隆均含有ORF和UTR,其中4个ESTs存在高相似度的序列,并有相对应的蛋白质超家族,参与跨膜转运、信号转导、细胞的发育及分化等功能。
3 结论与讨论
cDNA文库是生物体某一时刻表达基因的集合,是获取新基因的重要手段,已广泛应用于不同生长阶段基因表达变化的研究、某特定发育期基因表达情况及获取组织特异性基因等方面[14-15]。影响cDNA文库质量的因素较多,mRNA的完整性、cDNA小片段及合适的载体都会对cDNA文库的代表性造成影响。该试验中,采取Trizol法可高效快速提取鸡爪苓菌丝体总RNA,降低mRNA的降解。通过CHROMA SPIN-400层析柱将cDNA分级分离,并选择合适的cDNA片段。选择λTripIEx作为载体,可提高某些低丰度基因的筛选率[16]。该试验成功构建了鸡爪苓菌丝体全长cDNA文库,可进行大规模的EST序列分析,为研究长白山区鸡爪苓的遗传特异性、探索鸡爪苓生长分化的分子机制提供理论基础。
[1]许广波,李艳茹,李太元,等.两个猪苓菌株生长速度及酯酶同工酶比较研究[J].微生物学通报,2006,33(3):57 -59.
[2]许广波,李太元,李艳茹.药用真菌猪苓研究热点的进展[J].延边大学农学学报,2012,34(3):262 -265.
[3]许广波,金敏,梁运江,等.长白山鸡爪苓子实体的组织分离培养及其酯酶同工酶分析[J].延边大学农学学报,2013,35(4):284 -288.
[4]李艳茹,王健,于海茹,等.不同氮源对长白山鸡爪苓菌丝体生长及几种胞外酶活性的影响[J].延边大学农学学报,2011,33(1):1 -5.
[5]XING X K,MA X T,HART M M,et al.Genetic Diversity and Evolution of Chinese Traditional Medicinal Fungus Polyporus umbellatus(Polyporales,Basidiomycota)[J].PLOS ONE,2013,8(3):1 -10.
[6]戚淑威,赵琪,程远辉,等.猪苓的研究进展[J].云南农业科技,2011(5):5-7.
[7]ZHOU W W,GUO S X.Studies on the chemical constituents of the Sclerotia of Polyporus umbellatus[J].Acta Pharmaceutica Sinica,2007,42:249-253.
[8]SUN Y X,WANG S H,LI J B.Purification,structure and immunbiological activity of a new water-soluble polysaccharide from the mycelium of Polyporus albicans(Imaz.)Tenz[J].Bioresource Technology,2008,99:900-904.
[9]WI YOUNG LEE,YOUNGKI PARK,JIN -KWON AHN.Cytotoxic activity of ergosta-4,6,8(14),22- tetraen-3-one from the Sclerotia of Polyporus umbellarus[J].Bull Korean Chem Soc,2005,26:1464 -1466.
[10]刘开辉,邓百万,陈文强,等.比较DNA序列分析不同猪苓菌种的亲缘关系[J].食用菌学报,2009,16(3):11 -13.
[11]宋超,郭顺星.药用真菌猪苓溶血素基因克隆和序列分析[J].菌物学报,2013,32(4):690 -697.
[12]朱利军,长孙东亭,罗素兰.cDNA文库在药用海洋生物研究中的应用[J].中国海洋杂志,2009,28(1):53 -58.
[13]晏惹君,黄兴奇,程在全.cDNA文库构建策略及其分析研究进展[J].云南农业大学学报,2006,21(1):1 -6.
[14]PONGSOMBOON S,WONGPANYA R,TANG S,et al.Abundantly expressed transcripts in the lymphoid organ of the black tiger shrimp,Penaeus monodon,and their implication in immune function[J].Fish Shellfish Immunol,2008,25:485 -493.
[15]叶波平,管悦,许媛媛,等.木榄幼苗叶片cDNA文库的构建及其表达序列标签分析[J].热带亚热带植物学报,2010,18(2):140 -150.
[16]姚冬生,管敏,赵龙,等.产黄曲霉毒素解毒酶真菌(E-20)cDNA文库的构建[J].广东药学院学报,2004,20(1):45 -48.
