垂枝樱花外植体灭菌及不定芽的诱导研究
2014-12-22王红梅李园莉李洪光董晓辉
王红梅,李园莉,李洪光,董晓辉
(1.江苏农林职业技术学院,江苏句容212400;2.嘉汉城市生态苗木(苏州)有限公司,江苏苏州215028)
樱花泛指啬薇科(Rosaceae),李亚科(Prunoidea),樱属(Cerasus)观赏植物,共120余种,是世界著名的木本花卉,樱花主要分布于亚洲的中国、日本和朝鲜。我国古老的西南部高山地区为樱属植物的分布中心、原始种保存中心和特有中心,蕴藏着近30种野生樱花类群,其中很多具有较高的观赏价值[1]。
我国现有樱花45种,主要有冬樱花、樱花、福建山樱花、云南早樱、垂枝樱花等[2]。其中,垂枝樱花(Cerasus subhirtella Miq.var.pendula Tanaka.),树皮灰褐色,冬芽卵形,鳞片先端有疏毛,叶片卵形至卵状长圆形,叶边有锯齿或缺刻状锯齿,叶柄、托叶和锯齿常有腺体,伞房状或短总状花序,花瓣白色或粉红色,先端圆钝、微缺或深裂,花期4月,果期6月。产于浙江、安徽、江西、四川、台湾省等地,原种产于日本[3]。
观赏樱花的引种栽培自20世纪70年代引起人们的重视,世界各地广泛栽培樱花,尤其在日本被奉为国花[2]。随着园林化城市的建设,樱花苗木供不应求,传统的繁殖方法繁殖速度慢,不能满足市场的需求,影响了花农的经济效益和樱花的种植面积[3-4],而组织培养具有用材少、见效快、可以周年生产等优良特点,成为优良品种快速繁殖的有效途径。
为进一步开发利用我国的樱花资源,扩大种植范围,形成规模和影响,笔者初步探讨垂枝樱花的外植体灭菌及不定芽诱导的相关技术,旨在为垂枝樱花的组织培养提供相关技术支持。
1 材料与方法
1.1 材料 供试材料为樱花品种“垂枝樱花”,3~9月分别选取当年生带腋芽茎段,来源于江苏句容天王镇嘉润苗圃。
1.2 方法
1.2.1 材料采集与预处理。在晴朗天气条件下,截取垂枝樱花健壮无病害嫩枝中上部作为外植体,去掉叶片留叶柄。选择生长健壮、无病虫害的春梢枝段为材料,对所采材料及时接种,防止失水萎蔫或污染霉烂。
将采集的樱花材料进行修整,去掉不需要的部分,剪切成2~3 cm小段,每段至少保留1~2个腋芽,然后将材料放在洗衣粉中浸泡15 min,用流水反复冲洗1 h。
1.2.2 材料表面灭菌。对材料进行预处理后,转入超净工作台进行消毒处理。把外植体剪成1~2 cm长的茎尖或带有一个腋芽的茎段,用70%乙醇处理30 s,然后用0.1%的HgCl2消毒处理 4、5、6、7、8、10、12 min,处理期间不断摇晃,使材料充分达到灭菌效果,再用无菌水冲洗3~4遍。接种前部分切去茎段的两端,将消毒好的材料剪切成单芽,保留茎段长约1 cm左右,直立式接种,将外植体基部插入培养基,每瓶接种3个材料,每个处理接种20瓶,重复3次,20 d后分别统计污染率、褐变率、成活率等指标[5-6]。
1.2.3 外植体不同采集时间的影响。选取3~9月,晴天中午采集当年生健壮的外植体,接种于相同的启动培养基1/2MS+6-BA 0.5 mg/L+NAA 0.1 mg/L 上进行培养,接种20 d后,统计成活率及生长状况。
1.2.4 不定芽诱导培养。选择3个试验因素,分别为基本培养基(MS、1/2MS、1/4MS)、6-BA(0.1、0.5、1.0 mg/L)、NAA(0.02、0.05、0.10 mg/L),采用 L9(34)正交设计,共 9 种配方,每种培养基里均附加蔗糖30 g/L,琼脂6.5 g/L,pH调至5.8。每种处理接种30瓶,每瓶2棵,重复3次,30 d后统计分化数和分化率[6]。
2 结果与分析
2.1 不同灭菌时间的影响 对垂枝樱花不同灭菌时间的比较见表1。表1表明,在对外植体表面乙醇灭菌时间均为30 s的情况下,HgCl2灭菌时间过低会导致污染率上升,相反,时间控制在8~12 min,褐变率和污染率较低,存活率最高达到68.3%。此外,灭菌时间也随采集外植体母株的生长状态及芽的生长状况而调整。芽较嫩时,灭菌时间相对缩短,否则灭菌时间过长会导致褐变甚至直接杀死材料,但灭菌时间过短会使污染率大大上升,污染率过高将致使成活率接近0[6]。
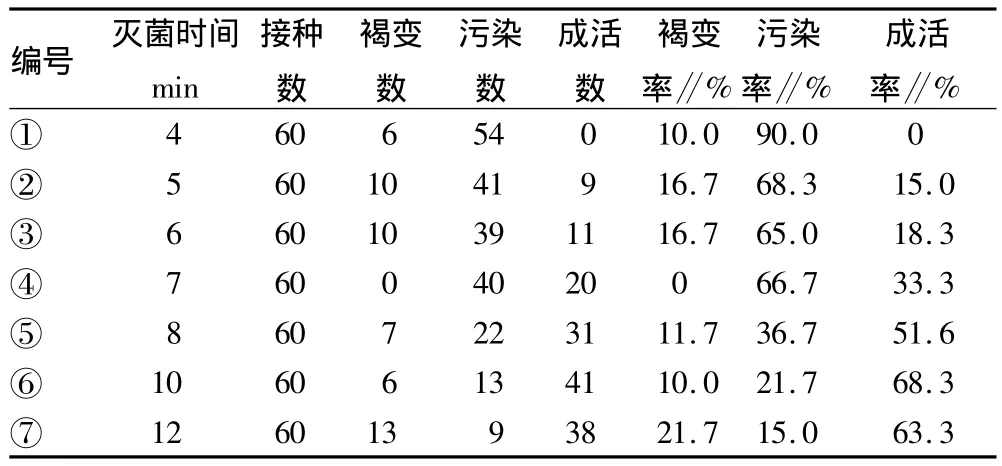
表1 垂直樱花表面灭菌效果比较
2.2 外植体不同采集时间的影响 图1表明,外植体采集时间以3~5月份的萌芽率较高,6~8月份较低,9月又有所升高。4月份采集外植体的成活率最高,达到84%,这是因为3月份垂枝樱花期过后,正处于快速的营养生长期,不定芽的诱导较易。而6月份后,由于气温不断升高,枝条的木质化加速,影响了不定芽的诱导。9月份属于树木的秋季生长期,又有所增加,但萌芽率远不如春季。而10月份后到翌年2月份,由于落叶及花芽的形成,基本不适合采集茎段外植体。因此,以茎段为外植体进行组织培养适宜的材料采集时间为每年3~5月份。
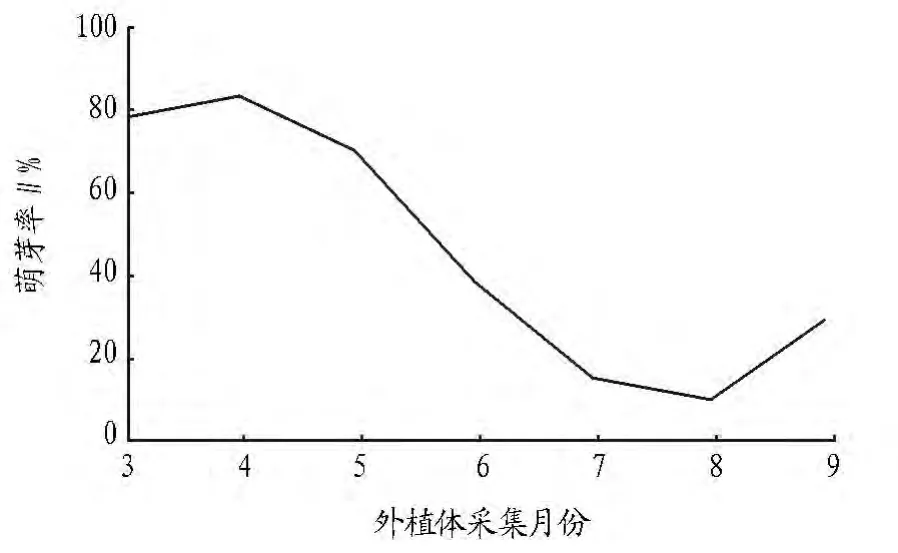
图1 外植体采集时间与萌芽率的关系
2.3 不定芽诱导结果分析 表2表明,基本培养基以大量元素减半的1/2MS基本培养基的分化率最高;随着6-BA浓度的增加,分化率呈先增后减的趋势;NAA浓度为0.02 mg/L与0.05 mg/L的分化率差别不大,而0.10 mg/L的分化率最高。从R值可知,3种因素对试验结果的影响为基本培养基>NAA>6-BA。所试验的配方中以启动培养基为1/2MS+6-BA 0.5 mg/L+NAA 0.10 mg/L 较适宜[6-7]。但考虑到启动培养中仅选择了3个因素的3个水平进行试验,各水平间是否存在差异,必须进行方差分析。
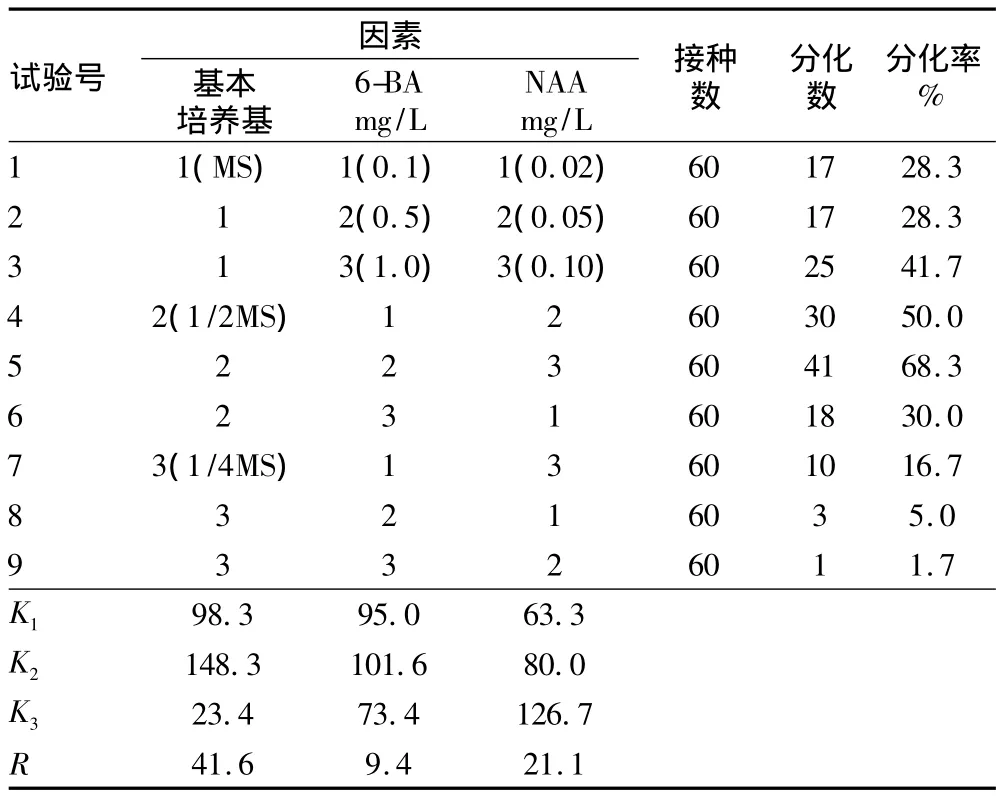
表2 不同培养基对启动培养的影响
方差分析结果表明,基本培养基的F=90.976,P=0.011<0.05,NAA 的 F=21.086,P=0.045 <0.05,表明这 2 个因素对分化率的影响都达到显著水平。因此,需对这2个因素进行多重比较。使用SPSS19.0中Duncan法进行多重比较,结果表明,3种基本培养基之间均达到显著差异;NAA的第1个和第2个水平间差异不显著,而与第3个水平间存在显著差异。再结合极差分析结果,初步得到适宜垂枝樱花不定芽诱导的培养基为 1/2MS+6-BA0.5 mg/L+NAA 0.10 mg/L。由于6-BA的各水平间差异不显著,所以在进一步试验中可加大6-BA各水平的差异,以便寻找分化率更高、生长效果更好的诱导培养基。
3 讨论
木本植物组织培养中,初次培养的褐变死亡是普遍存在的问题,在樱花培养中也如此,材料年龄、取材部位,材料大小、培养条件以及外植体受伤害程度等均能对褐变产生影响,目前尚无彻底的解决办法[8]。
研究表明,选择适当的外植体以及控制表面灭菌时间是克服材料褐变的最主要手段,取材长度适当加大,尽可能减小伤口面积,并缩短切口暴露在空气中的时间,选择合适的消毒剂和消毒时间,如乙醇虽消毒效果较好,但易对材料造成伤害,导致褐变,HgCl2对外植体伤害较轻,且消毒时间越长,消毒效果越好[9]。
在组培过程中,污染问题也是影响外植体死亡的最重要因素之一,在组培生产过程中,污染主要来源4个方面:①植物材料污染;②培养基污染;③接种过程发生污染;④培养过程发生污染。针对污染发生的来源,加强控制以降低污染,认真对待表面灭菌过程,降低污染率,对真菌引起的污染材料,不能再转接,对细菌引起的污染可转入生根,但要单独转接,防止与其他材料发生交叉感染[10]。
在不定芽诱导的培养中,腋芽分化的发生也受到多种因素的影响,除受培养基成分、培养条件等影响外,还受生长素浓度的影响。该试验中仅对基本培养基和2种生长素的浓度进行了试验,分化率有待进一步提高。所以,在进一步研究中可分别对基本培养基的种类、培养条件以及附加成分进行试验,以达到较好的分化效果[6]。
[1]段晓梅.樱花繁殖综述[J].思茅师范高等专科学院校报,2002,18(3):8-20.
[2]曹光球.观赏樱花繁殖技术研究进展[J].西南林学院学报,2007,27(6):5 -8.
[3]冷天波,李乐辉,柴德勇,等.樱花组织培养育苗技术[J].河南林业科技,2011,31(3):10 -14.
[4]汪结明,李瑞雪,魏万亮,等.垂枝樱花的观赏特性及其园林应用研究[J].中国园艺文摘,2011(15):61 -63.
[5]王玉珍,徐进,罗景兰,等.草樱花组培快繁技术的研究[J].山东农业科学,2004(6):47 -60.
[6]王红梅.4种台湾青枣组培技术研究[J].西部林业科学,2008(4):65-70.
[7]朱广廉.植物组织培养中外植体灭菌[J].植物生理学通讯,1996,32(6):444-449.
[8]王文房,李修岭.樱花花柄的组织培养[J].安徽农业科学,2006,34(22):5839 -5841.
[9]徐楠.福建山樱花组织培养技术研究[D].福州:福建农业大学,2008.
[10]邹娜,曹光球,林思祖.观赏樱花繁殖技术研究进展[J].西南林学院学报,2007,27(6):42 -46.
