辣根中烯丙基硫代葡萄糖苷提取工艺的优化
2014-12-20陈湘宁王宗义郭振龙
刘 佳 丁 轲 陈湘宁, 王宗义, 许 丽, 郭振龙
(1.北京农学院食品科学与工程学院,北京 102206;2.食品质量与安全北京实验室,北京 102206;3.农产品有害微生物及农残安全检测与控制北京市重点实验室,北京 102206)
辣根,别名西洋山嵛菜、山葵萝卜、马萝卜、青芥,为十字花科辣根属多年生草本植物[1]。辣根中营养素丰富,并且富含硫代葡萄糖苷,具有很好的保健功能[2,3]。硫代葡萄糖苷(glucosinolate,GS)是一类广泛存在于双子叶植物中的含硫阴离子亲水性次生代谢产物,具有防癌、抗菌等功效[4-6]。近年来的研究[7-9]表明硫苷分解产物异硫氰酸酯对哺乳动物的肾癌、前列腺癌、膀胱癌、结肠癌、直肠癌和肺癌等疾病都有一定的防御作用,有关植物中天然硫苷成分的研究也逐渐增多。烯丙基硫代葡萄糖苷的降解产物异硫氰酸烯丙酯在抑菌杀虫方面有很大作用[10,11],但研究大多针对总硫苷的提取[12-15],涉及烯丙基硫代葡萄糖苷提取工艺的研究较少,所以对烯丙基硫代葡萄糖苷提取工艺的研究也应进一步深入。中国的辣根资源丰富且没有被充分利用,因此采用合适的提取方法提取辣根烯丙基硫代葡萄糖苷具有非常重要的理论意义及实用价值。
本研究通过建立一套有效的烯丙基硫代葡萄糖苷的高效液相色谱检测方法,采用回流法和超声辅助法分别提取辣根烯丙基硫代葡萄糖苷。通过对提取方法的比较研究,旨在找到最佳的提取工艺,从而提高烯丙基硫苷的提取率,为进一步研究烯丙基硫代葡萄糖苷转化烯丙基异硫氰酸酯奠定基础。
1 材料与方法
1.1 材料与仪器
辣根粉:射阳县天德食品有限公司;
氯化钡、四甲基溴化铵:色谱纯,国药集团化学试剂有限公司;
无水乙醇:分析纯,北京化工厂;
甲醇:色谱纯,美国Fisher公司;
黑芥子硫苷酸钾(sinigrin):纯度≥99.0%,德国 Sigma公司;
电子天平:BSA223S型,赛多利斯科学仪器北京有限公司;
台式低速离心机:L530型,湖南赫西仪器装备有限公司;
旋转蒸发器:RE-5203型,上海亚荣生化仪器厂;
循环水真空泵:SHZ-Ⅲ型,上海亚荣生化仪器厂;
集热式恒温加热磁力搅拌器:DF-101S型,郑州长城科工贸有限公司;
超声循环提取机:CTXNW-2B型,北京弘祥隆生物技术开发有限公司;
电冰箱:BCD-215DF型,青岛海尔股份有限公司;
真空冷冻干燥机:Alpha 1-2LD plus型,德国Christ公司;
电热恒温鼓风干燥箱:PHG-9246A型,上海精宏试验设备有限公司;
超纯水系统:AWL-1002-U型,美国艾科浦国际公司;
电热恒温水浴锅:HWS24型,上海一恒科学仪器有限公司;
高效液相色谱仪:LC-20AD型,日本Shimadzu公司。
1.2 试验方法
1.2.1 烯丙基硫代葡萄糖苷分析方法的建立
(1)液相色谱条件:检测器:PDA检测器,检测波长:226 nm,色谱柱:COSMOSIL Packed Column 5C18-MS-Ⅱ(4.6ID ×250 mm),流动相:5 mmol/L四甲基溴化铵水溶液∶甲醇=19∶1(V∶V)[16],梯度洗脱条件见表 1,流速:0.8 mL/min,柱温:40 ℃,进样量:5 μL。
(2)标准曲线的绘制:准确称取4 mg Sinigrin标准品配制成2 mg/mL的标准液,将浓度分别稀释到1.50,1.00,0.50,0.10,0.05,0.01 mg/mL。高效液相色谱法测定其峰面积,平行3次,以浓度(x)为横坐标,峰面积(y)为纵坐标绘制标准曲线(见图1),所得回归方程为:y=1 895.3x+82.033,R2=0.998 7。
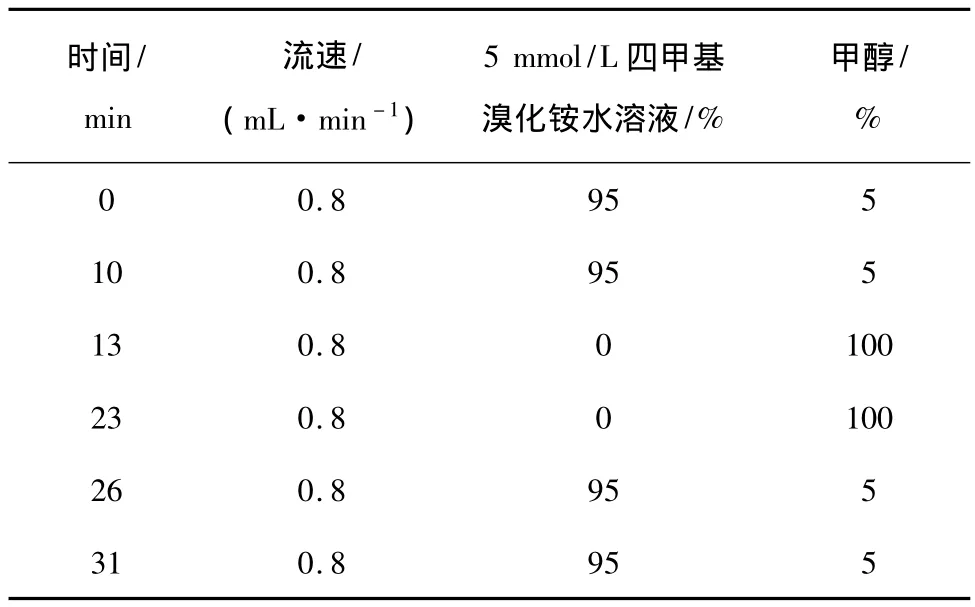
表1 梯度洗脱条件表Table 1 The conditions of gradient elution
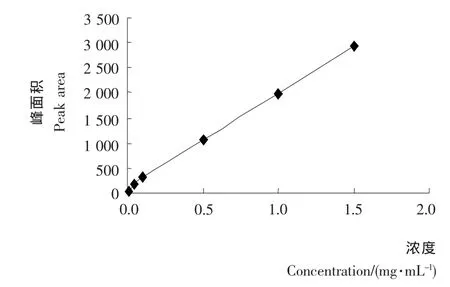
图1 烯丙基硫代葡萄糖糖苷标准曲线Figure 1 The standard curve of allyl glucosinolates
(3)样品中烯丙基硫代葡萄糖苷的测定:称取烯丙基硫苷粗品50 mg,用超纯水超声溶解并定容至10 mL容量瓶中,临用前用微滤膜(0.45 μm)过滤后,进样至HPLC中并测定其峰面积,根据标准曲线进一步换算出烯丙基硫代葡萄糖苷的浓度。由图2可知,用该HPLC条件测烯丙基硫代葡萄糖苷是可行的,目标峰和杂质峰能够完全分开,不会重合在一起。样品中的目标峰和烯丙基硫代葡萄糖苷标品峰能够基本重合,用该HPLC条件测定样品中烯丙基硫代葡萄糖苷的含量是可行的。
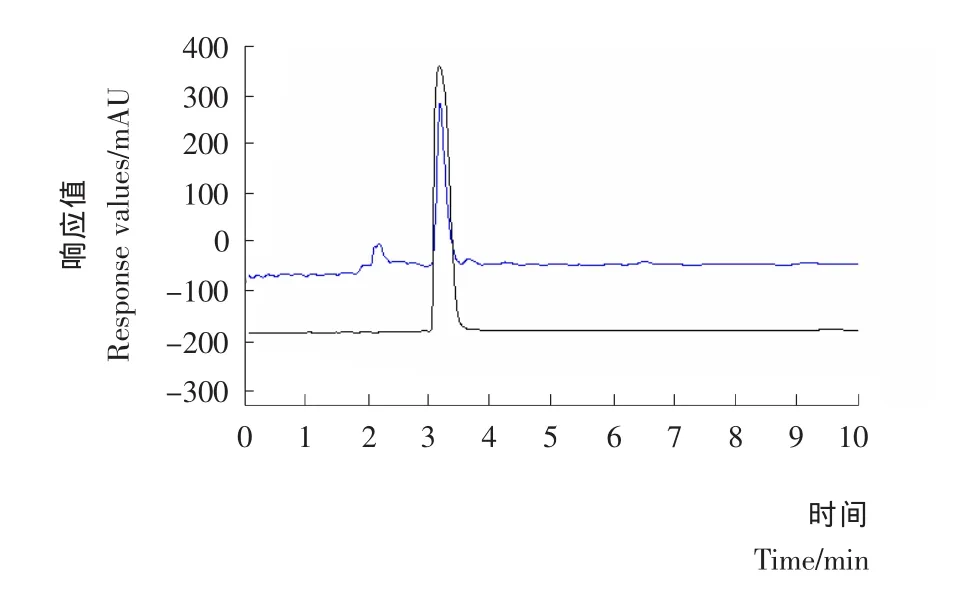
图2 烯丙基硫代葡萄糖苷色谱图Figure 2 The chromatogram of allyl glucosinolates
1.2.2 提取工艺流程
辣根粉→过20目筛→110℃干燥4 h→溶剂回流提取(或超声辅助提取)→抽滤→滤液加入0.4 mol/L乙酸钡(按提取液体积的10%)→静置30 min→8 000 r/min离心10 min→上清液50℃浓缩至约20 mL→真空冷冻干燥(10 Pa、-50℃)→烯丙基硫苷粗提物[17]
1.2.3 溶剂回流提取烯丙基硫代葡萄糖苷的工艺优化
(1)单因素试验设计:本试验设计的各因素的固定参数为:乙醇浓度80%、提取温度60℃、提取时间3 h、料液比1∶20(m∶V),在其他条件保持一定的情况下,以烯丙基硫代葡萄糖苷提取率为评价指标,分别选取乙醇浓度(50%,60%,70%,80%,90%)、提取温度(40,50,60,70,80 ℃)、提取时间(1,2,3,4,5 h)和料液比(1∶5,1∶10,1∶15,1∶20,1∶25(m∶V))进行单因素试验。
(2)正交试验设计:在单因素试验的基础上,采用正交试验设计方法对辣根中烯丙基硫代葡萄糖苷的溶剂回流法提取工艺进行优化,以乙醇浓度、提取温度、提取时间和料液比为自变量[18,19],以烯丙基硫代葡萄糖苷的提取率为指标,设计四因素四水平的正交试验,以进一步优化溶剂回流提取烯丙基硫代葡萄糖苷的工艺条件。
1.2.4 超声波辅助提取烯丙基硫代葡萄糖苷的工艺优化
(1)单因素试验:由于超声波提取装置的容量限制,将料液比固定为1∶20(m∶V)。本试验其它因素的固定参数设计为:乙醇浓度80%、超声功率400 W、提取温度40℃、超声时间40 min,在其他条件保持一定的情况下,以烯丙基硫代葡萄糖苷提取率为评价指标,分别选取乙醇浓度(50%,60%,70%,80%,90%)、超声功率(200,300,400,500,600 W)、提取温度(20,30,40,50,60 ℃)和超声时间(20,30,40,50,60 min)进行单因素试验。
(2)正交试验设计:为了综合考虑多因素相互作用对超声波提取烯丙基硫代葡萄糖苷的影响[20],采用正交方法对辣根中烯丙基硫代葡萄糖苷的超声辅助法提取工艺进行优化。在单因素试验的基础上,以乙醇浓度、超声功率、提取温度、超声时间为自变量,以烯丙基硫代葡萄糖苷的提取率为指标,设计四因素三水平的正交试验,以进一步优化超声波辅助提取烯丙基硫代葡萄糖苷的工艺条件。
1.2.5 验证对比实验 通过数据分析获得最佳提取工艺条件后,按照优化条件进行提取并测定烯丙基硫代葡萄糖苷的提取率,验证预测值的准确性。最后将溶剂回流提取法和超声辅助提取法在最优工艺条件下得到的烯丙基硫代葡萄糖苷进行比较,选出最佳的提取方法。
2 结果与分析
2.1 溶剂回流提取烯丙基硫代葡萄糖苷最优工艺的确定
根据单因素试验结果确定的正交试验因素及水平取值见表2,试验设计及结果见表3。
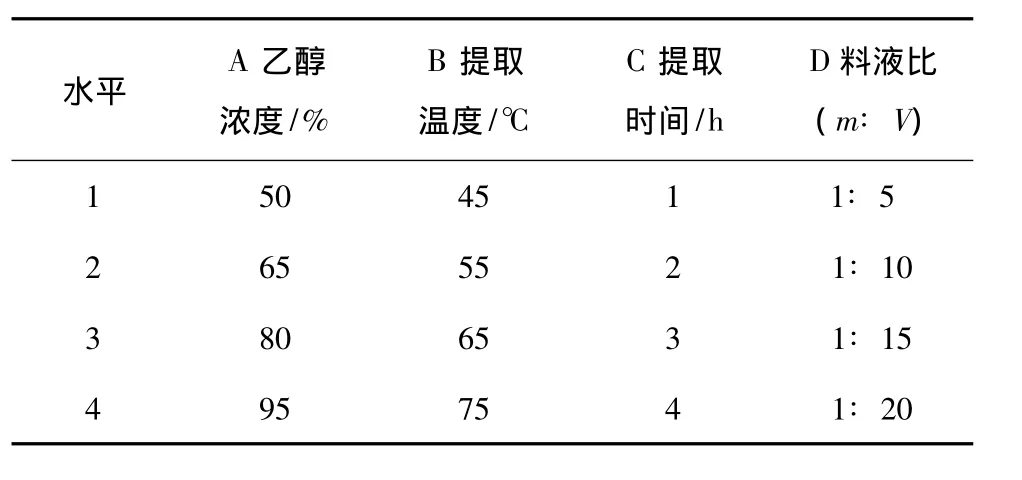
表2 正交试验因素水平表Table 2 The level of orthogonal experiment factor
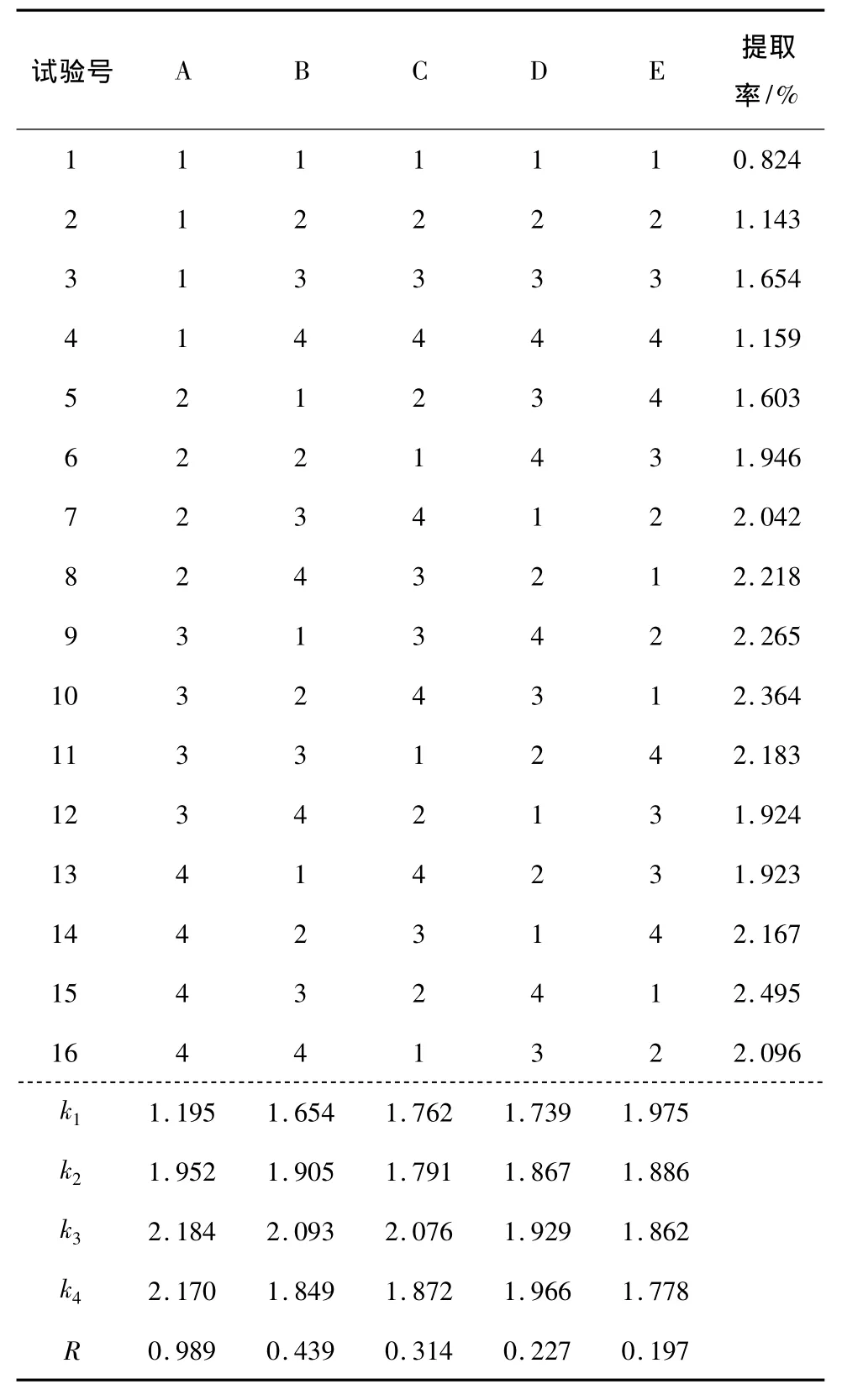
表3 L16(45)正交试验结果直观分析表Table 3 The design of orthogonal experiment L16(45)and results of intuitive analysis
2.1.1 直观分析 由表3可知,在本试验中乙醇浓度对烯丙基硫代葡萄糖苷提取效果的影响最大,提取温度、提取时间、料液比条件在设定的试验范围内对提取效果也均有影响。4因素对提取率影响的主次顺序为:乙醇浓度>提取温度>提取时间>料液比,最佳因素组合为A3B3C3D4。
2.1.2 方差分析 对溶剂回流法正交试验结果进行方法分析,结果见表4。由表5可知,A因素(乙醇浓度)的F值极显著,说明A因素对烯丙基硫代葡萄糖苷提取率有极显著的影响。采用q值检验法对A因素各水平进行多重比较,多重比较的结果为A3、A4、A2之间差异不显著,但都与A1有显著差异,与直观分析结果相符,选定A3为最优条件。最终结合直观分析结果选定最佳工艺组合A3B3C3D4,即溶剂回流法提取辣根粉中烯丙基硫代葡萄糖苷的最优工艺条件为:乙醇浓度80%,提取温度65℃,提取时间3 h,料液比1∶20(m∶V)。
表4 方差分析表Table 4 Analysis of variance
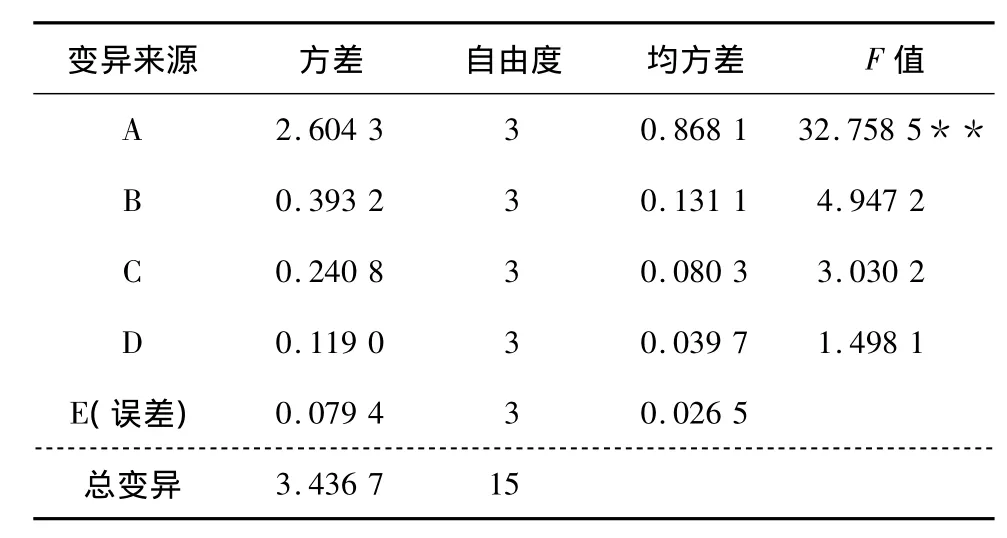
表4 方差分析表Table 4 Analysis of variance
F0.05(3.3)=9.28;F0.01(3.3)=29.46。
变异来源 方差 自由度 均方差 F值A 2.604 3 3 0.868 1 32.758 5 3.436 7 15 **B 0.393 2 3 0.131 1 4.947 2 C 0.240 8 3 0.080 3 3.030 2 D 0.119 0 3 0.039 7 1.498 1 E(误差) 0.079 4 3 0.026 5总变异
2.2 超声辅助提取烯丙基硫代葡萄糖苷最优工艺的确定
根据单因素试验结果确定的正交试验因素及水平取值见表5,试验设计及结果见表6。
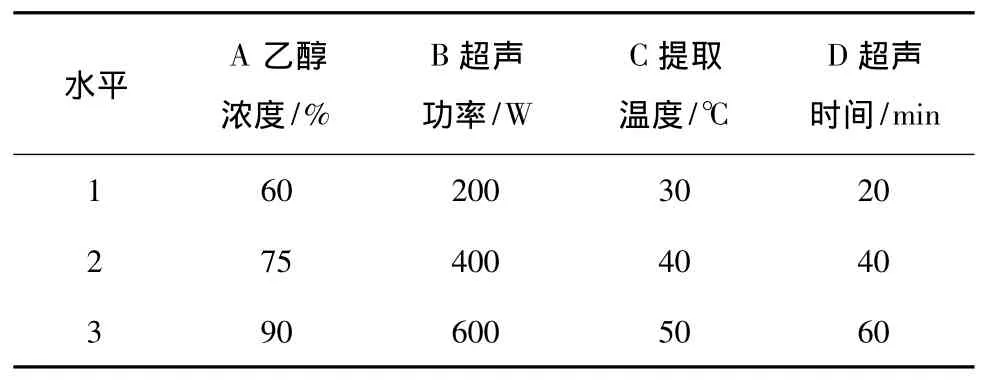
表5 正交试验因素水平表Table 5 The level of orthogonal experiment factor
2.2.1 直观分析 由表6可知,在本试验中乙醇浓度对烯丙基硫代葡萄糖苷硫代葡萄糖苷提取效果的影响最大,水平十分显著,超声功率、提取温度、超声时间条件在设定的试验范围内对提取效果也有一定影响。4因素对提取率影响的主次顺序为:乙醇浓度>提取温度>超声功率>超声时间,最佳因素组合为A2B2C2D2。
2.2.2 方差分析 由直观分析可以得出D因素(超声时间)对提取效果的影响相对较小,将其作为误差列,对上述数据进行F检验,结果见表7。由表7可知,A因素(乙醇浓度)和C因素(提取温度)的F值显著,说明A因素和C因素对烯丙基硫代葡萄糖苷提取率有显著影响,与直观分析结果相符。最终结合直观分析选定最佳工艺组合A2B2C2D2,即超声法提取辣根粉中硫代葡萄糖苷的最优工艺为:料液比1∶20(m∶V),乙醇浓度75%,超声功率400 W,提取温度40℃,超声时间40 min。
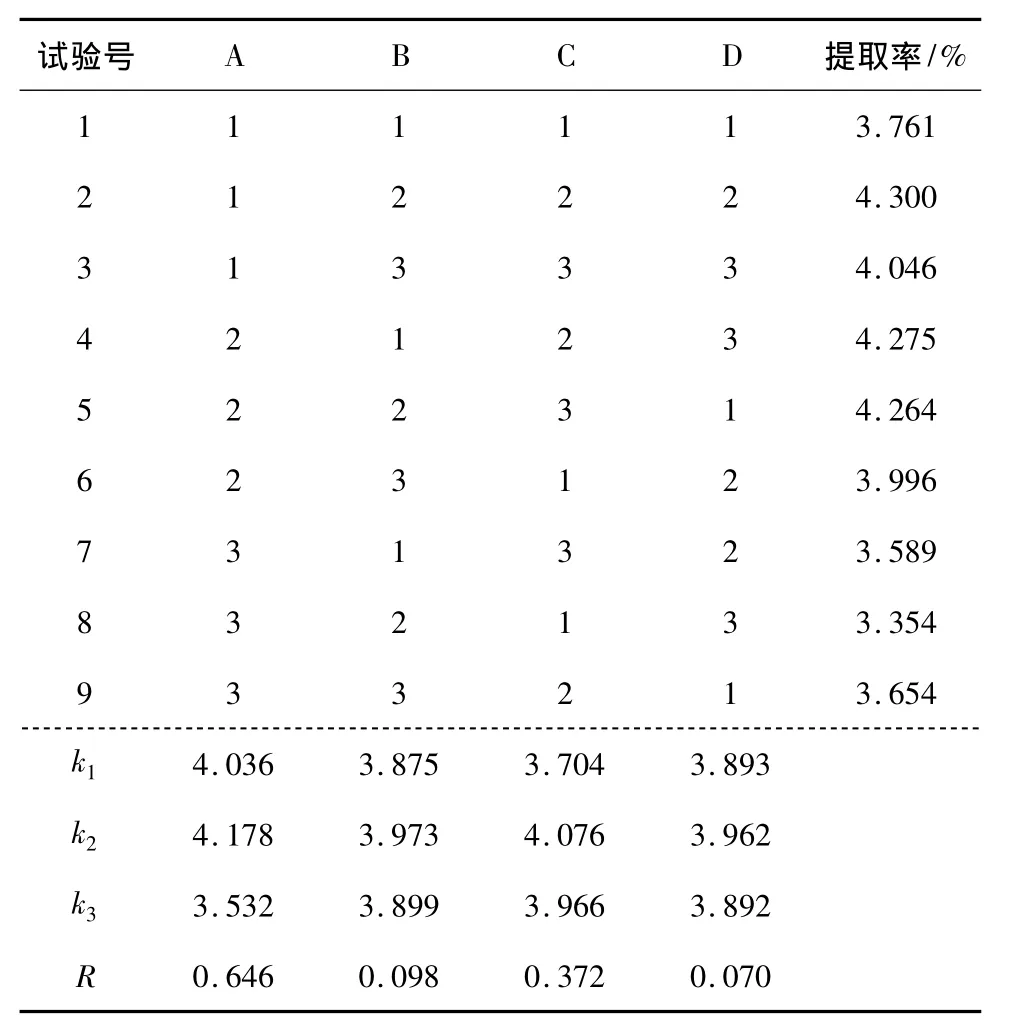
表6 L9(34)正交试验设计及结果分析表Table 6 The design of orthogonal experiment L9(34)and results analysis
表7 方差分析表Table 7 Analysis of variance
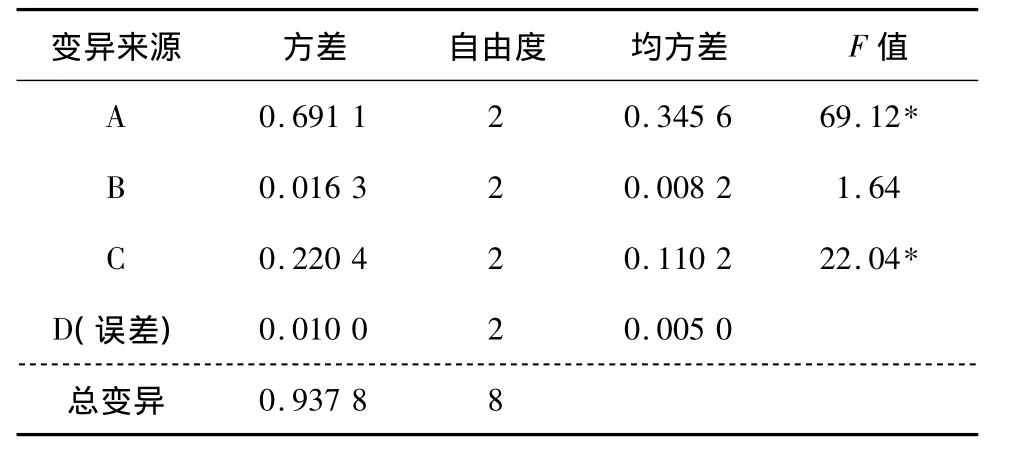
表7 方差分析表Table 7 Analysis of variance
F0.05(2.2)=19;F0.01(2.2)=99。
变异来源 方差 自由度 均方差 F值A 0.691 1 2 0.345 6 69.12* B 0.016 3 2 0.008 2 1.64 C 0.220 4 2 0.110 2 22.04*D(误差) 0.010 0 2 0.005 0总变异0.937 8 8
2.3 最优提取工艺验证及对比
分别在溶剂回流法最优工艺:乙醇浓度80%,提取温度65℃,提取时间3 h,料液比1∶20(m∶V)和超声波辅助法最优工艺:料液比1∶20(m∶V),乙醇浓度75%,超声功率400 W,提取温度40℃,超声时间40 min下进行验证实验,结果见表8。
由表8可知,超声波辅助法提取烯丙基硫代葡萄糖苷的提取率明显高于溶剂回流法的提取率,并且超声辅助提取法在时间缩短、温度降低的情况下使烯丙基硫代葡萄糖苷的提取率将近提高了1.72倍。因此,本试验选取超声法为辣根中烯丙基硫代葡萄糖苷的最佳提取工艺,最佳条件为料液比1∶20(m∶V),乙醇浓度75%,超声功率400 W,提取温度40℃,超声时间40 min。
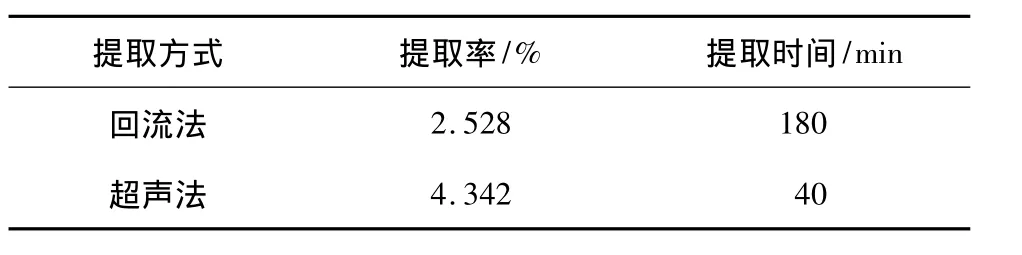
表8 两种方法提取试验结果Table 8 The extraction results of two methods
3 结论
本研究分别对溶剂回流法和超声辅助法提取辣根中烯丙基硫代葡萄糖苷的两种工艺进行优化,得到溶剂回流法提取最佳工艺条件为:乙醇浓度80%,提取温度65℃,提取时间3 h,料液比1∶20(m∶V),此条件下试验得到硫代葡萄糖苷提取率为2.528%;得到的超声提取法最佳工艺条件为:料液比1∶20(m∶V),乙醇浓度75%,超声功率400 W,提取温度40℃,超声时间40 min,此条件下试验得到的硫代葡萄糖苷提取率为4.342%。超声波辅助提取烯丙基硫代葡萄糖苷的提取率是溶剂回流提取的1.72倍,时间缩短至2/9。相比传统的溶剂回流法提取,不仅显著缩短了提取时间,而且大大提高了提取效率,节省了成本,适合工业化生产,具有推广应用潜力。
此外,本研究建立了一套烯丙基硫代葡萄糖苷的高效液相检测方法,可用于烯丙基硫代葡萄糖苷的定量分析,为单个硫苷物质的检测提供依据,为今后对烯丙基硫代葡萄糖苷及其水解产物异硫氰酸烯丙酯的研究及应用提供试验基础。但本试验只对辣根中的烯丙基硫代葡萄糖苷的提取工艺进行研究,对烯丙基硫代葡萄糖苷的进一步纯化、稳定性研究以及十字花科其他含有烯丙基硫代葡萄糖苷的植物的研究还有待深入。
1 丁海凤.喜冷的特菜——辣根[J].北京农业,2002(3):10.
2 Mithen R F,Dekker M,Verkerk R,et al.The nutritional significance,biosynthesis and bioavailability of glucosinolates in human foods[J].Journal of the Science of Food and Agriculture,2000,80(7):967~984.
3 周锦兰,俞开潮.油菜籽中主要硫苷的提纯与抗肿瘤活性[J].应用化学,2006,22(10):1 075 ~1 078.
4 Bones A M,Rossiter J T.The myrosinase-glucosinolate system,its organization and biochemistry[J].Physiologia Plantarum,1996,97(1):194~208.
5 周锦兰,胡健华.硫代葡萄糖苷的结构及降解特性[J].武汉工业学院学报,2003,22(1):58 ~61.
6 卜路霞,李建颖,石军,等.天然硫甙化合物的结构、降解及其生物活性[J].天津农学院学报,2010,17(3):38~41.
7 何榕.对辣根中硫代葡萄糖甙的纯化与鉴定及水解条件的研究[D].天津:天津商业大学,2007.
8 袁丽风,郭伟强,王志刚.油菜籽中4-戊烯基硫代葡萄糖苷的提取,分离及结构鉴定[J].分析化学,2004,32(11):1 513~1 516.
9 李晨,薛峰,缪文华,等.硫甙葡萄糖苷降解研究进展[J].食品科学,2010,31(9):313 ~317.
10 陈虹霞,王成章.辣根的化学成分及其生物活性研究进展[J].生物质化学工程,2008,42(1):53 ~57.
11 卜路霞,李建颖,石军,等.天然硫甙化合物的结构,降解及其生物活性[J].天津农学院学报,2010,17(3):38 ~41.
12 Eagles J,Fenwick G R,Heaney R K.Gas chromatography chemical ionization mass spectrometry of glucosinolate derivatives[J].Biological Mass Spectrometry,1981,8(6):278~282.
13 李鲜,陈昆松,张明方,等.十字花科植物中硫代葡萄糖苷的研究进展[J].园艺学报,2006,33(3):675~679.
14 谭世语,周铭,罗建富.菜籽粕脱毒液中硫代葡萄糖苷提取工艺的研究[J].天然产物研究与开发,2009(21):881~884.
15 陈新娟,朱祝军,钱琼秋,等.硫代葡萄糖苷的提取,分离和鉴定[J].中国食品学报,2007,7(3):43~48.
16 刘月萍.黑芥子酶提取分离,性质及固定化研究[D].杭州:浙江工商大学,2007.
17 钱丽丽,刘江丽,李扬,等.西兰花中硫代葡萄糖苷的提取及抑菌试验初报[J].中国农学通报,2008,24(2):335~338.
18 涂宗财,郭逍遥,刘成梅,等.芥菜中硫代葡萄糖苷提取工艺条件的优化[J].食品与生物技术学报,2008,26(6):9~12.
19 陈新娟.中国芸薹属蔬菜硫代葡萄糖苷及其影响因子研究[D].杭州:浙江大学,2006.
20 罗秋水,黄月胜,熊建华,等.超声波辅助法提取苦荞麦饭中芦丁工艺的优化[J].食品与机械,2012,28(6):107~109.
