N-乙酰半胱氨酸对衰老小鼠抗氧化机能和肠道菌群的影响
2014-12-20邵莅宇盛永帅徐建雄
包 健 蔡 旋 邵莅宇 盛永帅 徐建雄
(上海交通大学农业与生物学院,上海兽医生物技术重点实验室,上海 200240)
在正常的人和动物肠道中有一层微生物的存在,这个并未引起不正常或致病的微生物层就是正常微生物群,它们对其宿主非但无害而且是必要的。随着微生态学的发展,人们发现衰老与肠道菌群之间有着密切的联系[1]。正常菌群与宿主、环境之间处于协调的、动态的平衡,正常菌群刺激机体免疫系统,增强机体免疫力,清除体内有毒物质,具有抗衰老作用[2],而衰老机体内肠道菌群会相应发生改变[3]。近来研究发现,肠道菌群结构的改变与肠道菌和上皮细胞间的黏附密切相关[4]。三叶因子家族(trefoil factor family,TFF)是动物上皮细胞表达的一种小分子蛋白质,在进化上具有高度的保守性[5]。三叶因子3(TFF3)是正常的胃肠黏膜结构保护和损伤修复不可缺少的物质[6],并且与肠道菌群的黏附作用有关[7]。黏液素(mucin,MUC)是一个大分子糖蛋白家族,具有复杂的结构,它在上皮细胞表面形成一层选择性分子屏障,并参与信号传导[8]。MUC可以分为2个亚家族[9]:分泌型和跨膜型,黏液素3(MUC3)是典型跨膜型MUC,可以作为细胞表面受体或效应器,传导信号。研究表明肠道菌群与MUC3基因表达也有一定的关系[10]。
哺乳动物肠道内细菌组成非常复杂。近年来,肠道菌群对机体健康和疾病的影响越来越受到人们的关注[11-12],研究证明抗氧化剂对动物肠道菌群具有一定的调节作用[13]。N-乙酰半胱氨酸(NAC)是一种有效的抗氧化剂,能够抑制自由基生成,调节细胞的代谢,预防DNA的损伤[14],在临床和试验中都得到了广泛的应用。由于在现代条件下,绝大多数的微生物还无法培养,给菌群的研究带来了障碍[15]。随着分子生物学技术发展,不依赖微生物培养的分子生物技术如变性梯度凝胶电泳(DGGE)为研究胃肠道微生态提供了简便的方法[16-17]。DGGE技术近年来逐渐被应用于检测人类[18-20]、牛、猪和鸡等动物胃肠道主要细菌类群的多态性,其结果更加全面准确地反映了复杂肠道微生物的结构和多样性。
本试验采用D-半乳糖诱致衰老模型小鼠,通过饮水给小鼠服NAC,观察NAC对衰老小鼠肠道菌群的影响,通过DGGE技术比较肠道细菌的结构和多样性,并通过荧光定量PCR测定黏附相关基因的表达,探索NAC抑制小鼠衰老与肠道菌群改变间关系及其可能机理。
1 材料与方法
1.1 试验动物与分组
昆明种雄性小白鼠36只,体重(28±2)g,由上海交通大学实验动物中心提供。将小白鼠随机分成3组,每组12只,分2笼饲养,每笼6只,3组分别为对照组、衰老组、NAC组。每天按500 mg/kg的剂量通过颈背部皮下给衰老组和NAC组小鼠注射D-半乳糖,每天给对照组注射相同剂量的生理盐水。每2周给小鼠称重并根据小鼠的重量来调整注射的剂量。所有试验动物均饲喂新鲜饲粮和饮用经过高温灭菌的蒸馏水,只在NAC组小鼠的饮用水中添加0.05%NAC。所有试验动物都饲养于上海交通大学农业与生物学院试验动物房内,温度保持在23~28℃,相对湿度为50%~60%,动物房保持光照、黑暗各12 h,自由采食和饮水,连续饲养56 d。
1.2 主要试剂和仪器
D-半乳糖购自上海生物工程有限公司,NAC购自美国sigma公司,谷胱甘肽过氧物化酶(GSH-Px)、过氧化氢酶(CAT)和丙二醛(MDA)试剂盒均购自南京建成生物工程研究所。Taq酶、DNA转录酶购自大连宝生物工程有限公司,DNA聚合酶购自北京全式金生物技术有限公司,丙烯酰胺、甲叉双丙烯酰胺购自美国Sigma公司,去离子甲酰胺购自上海生物化学试剂工程公司,其他试剂均为国产分析纯。
紫外可见分光光度计购自尤尼科上海仪器有限公司,生物冷冻离心机及普通PCR仪购自德国Eppendoff公司,实时荧光定量PCR仪及DGGE电泳系统购自美国Bio-Rad公司。
1.3 样品采集
饲养56 d之后通过颈椎脱臼法将所有小鼠处死并迅速打开腹腔,结扎回肠两端,在回肠末端剪一小口,将内容物挤入已灭过菌的离心管中,肠壁组织经灭菌磷酸盐缓冲液(PBS)冲洗后分装于离心管中,样品放于-80℃冰箱中冻存待测。
1.4 测定指标和方法
1.4.1 衰老指标
将小鼠的回肠壁组织从-80℃冰箱取出,用PBS溶解,然后在 10 000×g,4℃ 条件下离心10 min,取上清液,GSH-Px、CAT活性和 MDA 含量3个指标均通过试剂盒测定,操作方法严格按照试剂盒说明书要求进行操作。
1.4.2 回肠细菌总 DNA
将回肠内容物从-80℃冰箱中取出,参照文献[21]的方法进行回肠菌群总DNA的提取,具体步骤如下:样品于冰上解冻后4℃,9 000×g离心5 min,弃上清液。加入1 mL TN150(10 mmol/L Tris-HCl,150 mmol/L NaCl,pH 8)悬浮沉淀,称取0.3 g粒径为100μm 和0.1 g粒径为500μm 已灭过菌的锆珠,加入150μL Tris饱和酚,在珠磨仪上4 600×g匀浆2 min破碎样品,冰上冷却2 min,重复 3 次。经 Tris饱和酚/氯仿/异戊醇(25∶24∶1)反复抽提,直至水相和有机相间的界面清晰为止,然后用2倍体积冰乙醇和1/10体积5 mol/L NaCl在-20℃条件下沉淀2 h,10 000×g离心10 min,去上清,用 70%乙醇洗涤沉淀 3次,晾干,用100μL无菌双蒸水溶解DNA沉淀,将提取出的DNA用紫外可见分光光度计测定吸光度(OD)值,计算A260/280,并用琼脂糖凝胶电泳检测所提取总DNA的质量。
1.4.3 PCR-DGGE
PCR反应参照文献[22],PCR反应体系为50μL,组成如下:2.5 μL 模板 DNA,10 μmol/L上游引物 1μL(5'-CGCCCGCCGCGCGCGGCGGGCGGGGGGGGCACGGGGGGCCTACGGG AGGCAGCAG-3'),10μmol/L下游引物 1μL(5'- ATTACCGCGGCTGCTGG - 3'),5 μL dNTPS,0.5 μL TransTaqTMDNA 聚合酶,5 μL 无菌双蒸去离子水的GC,Mg2+。PCR反应条件为:94℃预变性4 min;94℃变性1 min,58℃退火30 s,72℃延伸 2 min,共 30个循环;72℃延伸10 min,4℃保存。PCR产物用1.0%琼脂糖凝胶电泳检测片段大小和浓度。
采用Bio-Rad Dcode进行DGGE。凝胶梯度为35%~65%,变性方向与电泳方向一致。100%变性溶液含7 mol/L尿素和40%去离子甲酰胺。使用1×TAE缓冲液,60 V 60℃电泳10 h。电泳结束后用溴化乙锭(EB)浸泡10 min染色,通过Bio-Rad GS800 Calibrated Densitometer扫描成像,通过Qantity One软件进行相似性和多样性分析[23-24]。
1.4.4 TFF3、MUC3 基因表达水平
采用SYBR GreenⅠ实时荧光定量PCR测定小鼠回肠中TFF3、MUC3基因表达水平。以甘油醛-3-磷酸脱氢酶(GAPDH)为参考基因,引物依据文献[25-27]设计(表1)。先将小鼠回肠壁组织从-80℃冰箱中取出,提取总RNA,然后通过测定并计算A260/280检测总RNA的纯度。检验之后进行荧光定量PCR,反应体系为20μL,组成如下:2 μL cDNA,10 μmol/L 上 游 引 物 0.4 μL,10 μmol/L下游引物 0.4 μL,7.2 μL ddH2O 和10μL SYBR Premix Ex Taq。反应条件为:95℃预变性30 s;95℃变性5 s,58℃退火30 s,72℃延伸32 s,共40个循环。采用定量PCR上的ABI SDS软件通达Ct值来测定目的基因的表达。目的基因表达水平=2-ΔΔCt,ΔΔCt=(Ct目的基因-Ct参考基因)试验组-(Ct目的基因-Ct参考基因)对照组。
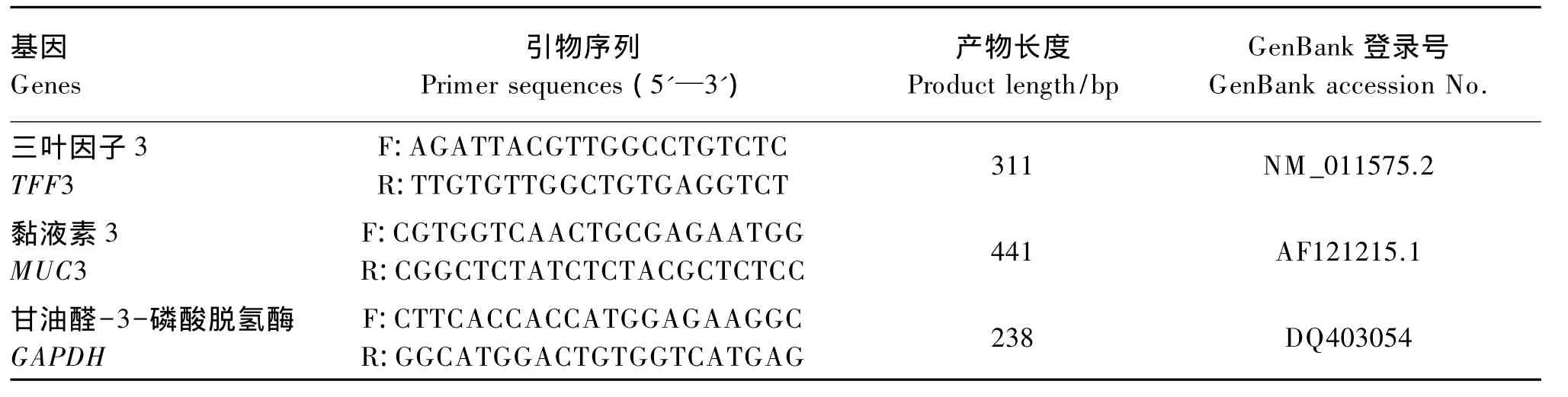
表1 引物序列Table 1 The primer sequences
1.5 数据分析
所有试验重复3次以上,所有数据采用SPSS 17.0软件进行单因素方差分析,用Duncan氏法进行多重比较,以P<0.05为差异显著性标准,结果用平均值±标准差表示。
2 结果与分析
2.1 NAC对小鼠回肠壁组织衰老指标的影响
从表2中可以看出,衰老组小鼠回肠壁中GSHPx活性显著低于对照组(P<0.05),CAT活性低于对照组,但差异不显著(P>0.05),MDA含量显著高于对照组(P<0.05),说明小鼠造模成功。NAC组小鼠回肠壁中GSH-Px和CAT活性高于衰老组,但差异不显著(P>0.05),MDA含量低于衰老组,但差异不显著(P>0.05),说明 NAC能提高衰老小鼠抗氧化机能。

表2 NAC对小鼠回肠壁组织GSH-Px、CAT活性和MDA含量的影响Table 2 Effects of NAC on activities of GSH-Px,CAT and MDA content in ileum tissue of mice
2.2 小鼠回肠细菌总DNA
将提取完的小鼠回肠细菌总DNA用紫外可见分光光度计在A260/280条件下测定其OD值,对照组、衰老组和NAC组的测定结果都在1.7~1.9之间,琼脂糖凝胶电泳显示提取的总DNA符合试验要求,可以进行后续PCR反应。
2.3 小鼠回肠菌群结构
小鼠回肠内容物DNA PCR扩增的琼脂糖凝胶电泳结果如图1所示,所有样本的PCR产物在目标位置都能见到清晰的条带,产物的大小约为178 bp,说明PCR成功扩增出了试验所需片段。

图1 PCR产物的琼脂糖凝胶电泳结果Fig.1 Agarose gel electrophoresis results of PCR products
将成功扩增出的PCR片段进行DGGE凝胶电泳,小鼠回肠细菌的16S rDNA V3区的DGGE图谱如图2所示,图2中不同位置的条带代表不同的优势细菌,亮度反映出细菌相对量的多少。从图2中可以看出对照组和衰老组的菌群结构是有很大差异的,对照组有很多条带并且很明亮,说明正常肠道菌群结构丰富,衰老组条带与对照组比较有明显差异,说明衰老组中优势菌群有所改变,图2中标明了明显的差异条带,衰老组的条带1、3和4明显比对照组相应条带要暗,条带2明显比对照组要亮,说明衰老会影响小鼠回肠的菌群结构。从图2中可以看到NAC组菌群结构和衰老组比较差异较大,NAC组条带3比衰老组要暗,条带4比衰老组亮,说明NAC能影响衰老小鼠回肠的菌群结构。从图中发现NAC组条带分布与对照组接近,说明NAC对衰老小鼠肠道菌群有一定的调节作用。
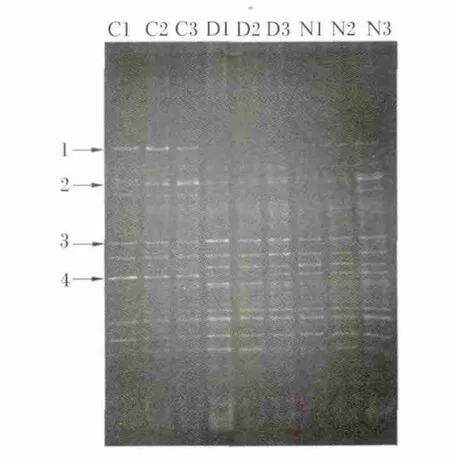
图2 DGGE凝胶电泳图谱Fig.2 The graph of DGGE gel electrophoresis
将DGGE凝胶电泳图谱用Qantity One(Bio-Rad)软件进行非权重配对法(UPGMA)相似性聚类分析,得到的结果如图3所示,更进一步证明了DGGE图谱准确性。从图3中可以看出对照组、衰老组和NAC组的试验平行性都比较好,不同组之间差异明显,从图中看出衰老组与对照组进化关系较远,NAC组与对照组进化关系较近,也说明3组小鼠的回肠菌群结构确实有差异。

图3 UPGMA相似性聚类分析Fig.3 Similarity clustering analysis of UPGMA
用Qantity One(Bio-Rad)软件对DGGE图谱进行多样性分析,分析所得的丰富度(S)、多样性(H)及均匀性(E)的结果见表3,从表3中可知,衰老组小鼠肠道菌群丰富度显著低于对照组(P<0.05),NAC组丰富度低于对照组,但差异不显著(P>0.05)。NAC组小鼠肠道菌群丰富度相对衰老组有所升高,但差异不显著(P>0.05)。衰老组小鼠肠道菌群的多样性和均匀性低于对照组,但差异不显著(P>0.05),NAC组小鼠肠道菌群的多样性和均匀性相比衰老组有所升高,但差异不显著(P>0.05)。这说明NAC能增加衰老小鼠肠道菌群多样性。

表3 DGGE图谱多样性分析结果Table 3 Diversity analysis results of DGGE graph
经测序后,用Blast工具与GenBank数据库中已有序列进行比对,结果如表4所示。肠道中的菌群与数据库中的已知菌群序列有很高的相似性,都在99%以上。从表4和图2中可知,相对于对照组,衰老组小鼠肠道乳酸杆菌、双歧杆菌和肠球菌数量有所减少,大肠杆菌数量有所增加。NAC组小鼠肠道乳酸杆菌、双歧杆菌和肠球菌数量比衰老组有所增加,大肠杆菌数量比衰老组有所减少。相比对照组,NAC组小鼠肠道乳酸杆菌、双歧杆菌和大肠球菌数量有所减少,大肠杆菌数量有所增加。这说明NAC确实能改变衰老小鼠肠道菌群的结构。

表4 DGGE图谱代表条带序列比对Table 4 Sequence comparison of representative bands of DGGE graph
2.4 NAC对小鼠回肠壁组织 MUC3、TFF3基因表达水平的影响
通过荧光定量PCR测定小鼠回肠壁组织中MUC3和TFF3基因表达水平,测定结果如表5所示,从表5中可以看出衰老组小鼠MUC3基因表达水平显著低于对照组(P<0.05),NAC组小鼠MUC3基因表达水平显著高于衰老组(P<0.05),略高于对照组,但差异不显著(P>0.05)。衰老组小鼠TFF3基因表达水平显著低于对照组(P<0.05),NAC组小鼠TFF3基因表达水平显著高于衰老组(P<0.05),显著低于对照组(P<0.05)。这说明NAC调节小鼠肠道菌群的结构的机理可能与MUC3、TFF3基因有关。
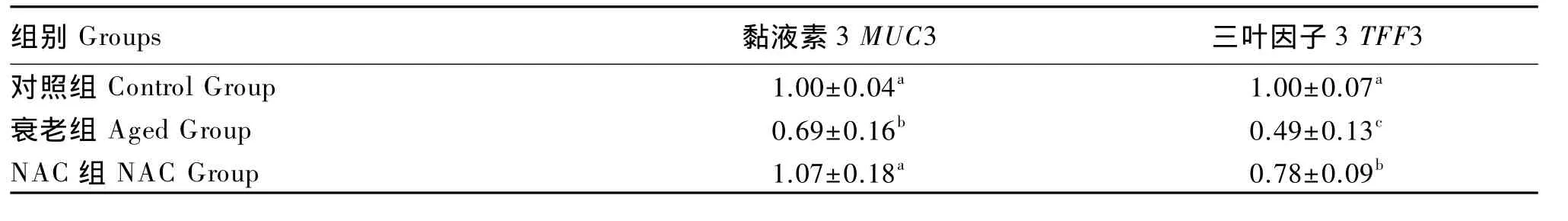
表5 NAC对小鼠回肠壁组织MUC3、TFF3基因表达水平的影响Table 5 Effects of NAC on gene expression levels of MUC3 and TFF3 in ileum tissue of mice
3 讨 论
肠道菌群是由种类繁多的大量微生物组成的复杂的生态系统,与宿主的生长、发育、物质代谢和衰老有着密切的关系。正常机体内肠道菌群对机体有重要作用,能清除有害物质,抵抗衰老。肠道菌群间互相保持着共生或拮抗关系,它们与宿主的健康、疾病有着极其密切的联系[28]。
Harman[29]提出了衰老的自由基理论,他认为衰老的过程归咎于细胞和组织长期暴露于自由基的累积性损伤,体内代谢过程产生的过剩自由基攻击生物大分子(如DNA、蛋白质、氨基酸、脂类)引发的氧化损伤是导致机体老化及许多的老年性疾病的主要因素[30]。NAC为谷胱甘肽的前体,是一种含有巯基的抗氧化剂[31],能通过促进细胞内谷胱甘肽的生物合成而减少氧化损伤[32]。有研究表明NAC可阻断细胞凋亡过程,并可以作为自由基的清除剂,干扰自由基的形成,从而抵抗衰老,如活性氧中间体(ROI)参与凋亡信号的转导,NAC能将其清除[33],NAC还可以干扰凋亡出现后下游的信号[34]。本试验结果表明,NAC能提高衰老小鼠抗氧化机能,与以往的报道一致。
大量研究结果表明,TFF3与肠道疾病间具有重要的关系,如TFF3分泌不足可能是导致早产儿和窒息儿更容易发生肠道黏膜损害的原因之一[35];TFF3可降低血浆二胺氧化酶(DAO)活性,抑制肠道组织中肿瘤坏死因子 α(TNFα)的mRNA及蛋白质的表达,减轻脂多糖(LPS)所致幼鼠肠损伤,发挥保护作用[36];TFF3通过腹腔和皮下注射可以减轻肠道的炎症反应,降低氧自由基损害[37];TFF3还可以减轻三硝基苯磺酸(TNBS)诱导的小鼠炎症性肠病及肠黏膜炎症病理性损伤并能促进损伤的修复等[38]。肠道菌群对MUC的分泌具有刺激作用,如乳酸杆菌、双歧杆菌等可诱导肠上皮细胞MUC3分泌,减少致病性大肠杆菌、产气荚膜梭菌等致病菌对肠上皮细胞的黏附[39]。肠道致病菌侵入肠上皮细胞可通过破坏减少杯状细胞的数量,从而减少MUC的分泌量。本试验结果显示NAC能增加衰老小鼠肠道中的乳酸杆菌、双歧杆菌等菌群,从而可提高MUC3分泌来降低肠道致病菌。因此,NAC调节肠道菌群的机理可能与TFF3和MUC3基因表达有关,对于NAC影响肠道菌群的深层机理还有待进一步的研究。
4 结论
NAC能提高衰老小鼠抗氧化机能并且对肠道菌群有一定的调节作用。NAC通过抗氧化作用调节肠道菌群的机理可能与TFF3和MUC3基因表达有关。
[1] 刘敏.纳米中药0506对D-半乳糖所致衰老小鼠肠道菌群的调节作用[D].硕士学位论文.佳木斯:佳木斯大学,2006.
[2] 刘君星,王琳,薛艳华,等.四君子汤对衰老小鼠肠道菌群的影响[J].中国老年学杂志,2006,26(12):1683-1684.
[3] WOODMANSEY E J.Intestinal bacteria and ageing[J].Journal of Applied Microbiology,2007,102(5):1178-1186.
[4] 王斌.高黏附性能乳杆菌的筛选及其对肠上皮细胞黏附机制的初步研究[D].博士学位论文.重庆:第三军医大学,2005.
[5] 杜廷义,张勇,张云.三叶因子:从实验室研究到临床医学[J].动物学研究,2010,31(1):17-26.
[6] 邢锐.重组人TFF2在乳酸链球菌中表达及其对实验性肠道损伤的保护作用[D].博士学位论文.广州:第一军医大学,2006.
[7] 邓荣.TFF3在断奶腹泻仔猪肠道中的分布表达及对肠黏膜上皮细胞的作用[D].硕士学位论文.武汉:华中农业大学,2012.
[8] 纪元,朱雄增.黏液素基因家族及其在胰腺肿瘤诊断中的作用[J].中华病理学杂志,2006,35(2):113-116.
[9] MONIAUX N,ESCANDE F,PORCHET N,et al.Structural organization and classification of the human mucin genes[J].Frontiers in Bioscience,2001,6:D1192-D1206.
[10] 李晓芳,刘洋,文姝,等.小鼠肠道优势菌群失衡肠黏液sIgA、黏液素的变化[J].中国微生态学杂志,2010,22(6):485-488.
[11] MACKIE R I,WHITE B A,ISAACSON R E.Gastrointestinal microbiology[M].New York:Chapman &Hall,1997:658.
[12] BARNES E M,MEAD G C,BARNUM D A,et al.The intestinal flora of the chicken in the period 2 to 6 weeks of age,with particular reference to the anaerobic bacteria[J].British Poultry Science,1972,13(3):311-326.
[13] 许丛丛,陈小连,朱丽慧,等.复合抗氧化剂对早期断奶仔猪肠道主要菌群的影响[J].饲料研究,2012(4):4-7.
[14] DE FLORA S,IZZOTTI A,D’AGOSTINI F,et al.Mechanism of nacetylcysteine in the prevention of DNA damage and cancer,with special reference to smoking-related end-points[J].Carcinogenesis,2001,22(7):999-1013.
[15] 卢龙娣,江胜滔,林跃鑫.鸡肠道菌群总DNA三种提取方法的比较[J].中国微生态学杂志,2009,21(7):588-590.
[16] HOOPER L V,WONG M H,THELIN A,et al.Molecular analysis of commensal host-microbial relationships in the intestine[J].Science,2001,291(5505):881-884.
[17] ZOETENDAL E G,COLLIER C T,KOIKE S,et al.Molecular ecological analysis of the gastrointestinal microbiota:a review [J].The Journal of Nutrition,2004,134(2):465-472.
[18] ZOETENDAL E G,AKKERMANS A D L,DEVOS W M.Temperature gradient gel electrophoresis analysis of 16S rRNA from human fecal samples reveals stable and host-specific communities of active bacteria[J].Applied and Environmental Microbiology,1998,64(10):3854-3859.
[19] TANNOCK G W,MUNRO K,HARMSEN H J M,et al.Analysis of the fecal microflora of human subjects consuming a probiotic product containing Lactobacillus rhamnosus DR20[J].Applied and Environmental Microbiology,2000,66(6):2578-2588.
[20] SEKSIK P,RIGOTTIER-GOIS L,GRAMET G,et al.Alterations of the dominant faecal bacterial groups in patients with Crohn’s disease of the colon[J].Gut,2003,52(2):237-242.
[21] LI M,GONG J H,COTTRILL M,et al.Evaluation of QIAamp DNA Stool Mini Kit for ecological studies of gut microbiota[J].Journal of Microbiological Methods,2003,54(1):13-20.
[22] WALTER J,HERTEL1C,TANNOCK G W,et al.Detection of lactobacillus,pediococcus,leuconostoc,and weissella species in human feces by using group-specific PCR primers and denaturing gradient gel electrophoresis[J].Applied and Environmental Microbiology,2001,67(6):2578-2585.
[23] YU Z,MORRISON M.Comparisons of different hypervariable regions of rrs genes for use in fingerprinting of microbial communities by PCR-denaturing gradient gel electrophoresis[J].Applied and Environmental Microbiology,2004,70(8):4800-4806.
[24] MCCRACKEN V J,SIMPSON J M,MACKIE R I,et al.Molecular ecological analysis of dietary and antibiotic-induced alterations of the mouse intestinal microbiota[J].The Journal of Nutrition,2001,131(6):1862-1870.
[25] KAWASHIMA T,OKAMOTO K,MURAGUCHI T,et al.Downregulation of trefoil factor 3 gene expression in the colon of the senescence-accelerated mouse(SAM)-P6 revealed by oligonucleotide microarray analysis[J].Biomedical Research,2010,31(3):169-175.
[26] HOEBLER C,GAUDIER E,DE COPPET P,et al.MUC genes are differently expressed during onset and maintenance of inflammation in dextran sodium sulfate-treated mice[J].Digestive Diseases and Sciences,2006,51(2):381-389.
[27] SETHI J,SANCHEZ-ALAVEZ M,TABAREAN I V.Loss of histaminergic modulation of thermoregulation and energy homeostasis in obese mice[J].Neuroscience,2012,217:84-95.
[28] 闻玉梅.现代医学微生物学[M].上海:上海医科大学出版社,1999:197-1121.
[29] HARMAN D.Aging:a theory based on free radical and radiation chemistry[J].Journal of Gerontology,1956,11(3):298-300.
[30] 郭剑利,赵熙和.从自由基学说看水果蔬菜的抗衰老作用[J].卫生研究,1999,28(3):190-192.
[31] 李毅敏,赵树仪.N-乙酰半胱氨酸的研究进展[J].天津药学,2003,15(2):50-53.
[32] 周克,付荣泉,丁继光,等.N-乙酰半胱氨酸对大鼠肝纤维化肝中氧化及抗氧化的影响[J].医学临床研究,2011,28(2):263-265.
[33] WELTIN D,AUPEIX K,ILTIS C,et al.N-acetylcysteine protects lymphocytes from nitrogen mustard-induced apoptosis[J].Biochemical Pharmacology,1996,51(9):1123-1129.
[34] STAAL F J,ROEDERER M,HERZENBERG L A.Intracellular thiols regulate activation of nuclear factor κB and transcription of human immunodeficiency virus[J].Proceedings of the National Academy of Sciences of the United States of America,1990,87(24):9943-9947.
[35] 田鸾英.早产儿脑损伤的患病率和危险因素[J].实用儿科临床杂志,2011,26(2):128-130.
[36] 李军,许玲芬,孙梅,等.肠三叶因子在内毒素致幼鼠肠损伤中的作用及意义[J].中国当代儿科杂志,2006,8(5):425-428.
[37] 陈丽萍,张丙宏,麦根荣,等.肠三叶因子对新生鼠坏死性小肠结肠炎模型TNF-α、IL-8及MDA的影响及意义[J].武汉大学学报:医学版,2003,24(3):232-234.
[38] 滕旭.肠三叶因子对小鼠炎症性肠病保护作用机制的研究[D].博士学位论文.沈阳:中国医科大学,2009.
[39] MACPHERSON A J,UHR T.Induction of protective IgA by intestinal dendritic cells carrying commensal bacteria[J].Science,2004,303(5664):1662-1665.
