人参皂苷糖苷水解酶高产菌株CGMCC No.4316发酵工艺*
2014-12-16孙晓雨吕国忠谢明杰赵志慧孙晓东苏丹
孙晓雨,吕国忠,谢明杰,赵志慧,孙晓东,苏丹
1(辽宁师范大学生命科学学院,辽宁大连,116029)2(大连民族学院环境与资源学院,辽宁大连,116600)
人参皂苷为人参及其制品的主要活性成分,因其分子结构中糖基侧链的不同而显示不同的药理特性和药物活性[1],将人参皂苷有效成分开发成临床药物及保健品已成当今医药市场的一大热点,然而由于天然产物大多含量低、可吸收性差、价格昂贵,过度开发及滥用对自然资源和人文环境造成无法挽救的破坏和损失。因此,利用药材本身的次生代谢产物开展有效成分高产率人参皂苷定向转化技术研究具有极大的优势和潜力。如何将含量较高的人参皂苷转化成含量极低的人参皂苷,即将医药价值低的皂苷转化为稀有皂苷,是人参皂苷转化研究的热门课题[2]。例如将人参皂苷Rb1、Rb2、Rc、Re等转化成人参皂苷Rd、F1、Rh1、Rh2、compound Y、compound K 等。人参皂苷 Rd能促进 T细胞增殖,提高天然杀伤细胞(NK)的活性[3];人参皂苷 Rh2具有明显的抑肿瘤作用[4]。针对活性较低的人参皂苷的糖基,进行有目的的修饰和水解,是生产高活性人参皂苷的有效方法[5]。目前,相关领域多采用传统化学法[6]、微生物发酵法、酶法[7]等分离制备人参皂苷。其中,化学方法存在选择性低、提取效率低、环境危害大等诸多缺陷,化学合成至今尚未成功。相比之下,微生物方法具有资源丰富、反应条件温和、底物特异性强等优势成为制备稀有皂苷的最佳途径。从人参根内分离获得的专利菌株CGMCC No.4316(灰绿梨头霉Absidia glauca)具有将人参皂苷Rb1专一转化成稀有人参皂苷Rd的活性,转化过程彻底且无其他副产物生成。本文对其产人参皂苷β-葡萄糖苷酶的培养基组分配比和培养条件进行了研究,探索合适的工业生产条件,以期为实现人参皂苷Rd的规模化生产奠定基础。
1 材料与方法
1.1 材料
菌种灰绿犁头霉Absidia glauca CGMCC No.4316系本实验室分离、筛选和保存的专利菌株;人参皂苷单体化合物标准品Rb1、Rd购自吉林大学基础医学院;薄层层析板Silica Gel-60F254为德国MERCK公司产品;人参皂苷粉由辽宁本溪恒仁阳光保健品有限公司提供;其他试剂均为分析纯。
1.2 培养基
斜面培养基:PDA培养基。
种子发酵培养基(g/L):葡萄糖 2.0,MgSO4·7H2O 0.5,CaCl21,黄豆饼粉10。
液体产酶培养基(g/L):麸皮20,蛋白胨1.0,KH2PO41.0,自然 pH,121 ℃灭菌 30 min。
1.3 实验方法
1.3.1 发酵方法
将冰箱4℃下保藏的菌株 CGMCC No.4316经PDA斜面培养活化后,接入种子发酵培养液,在转速(200 ±5)r/min、(30 ±0.5)℃下恒温摇瓶培养18 h。然后转入液体发酵培养基,250 mL摇瓶中加入45 mL液体培养基,接种量为3%(菌悬液中孢子含量为106个孢子/mL),于30℃、160 r/min培养72 h,加入2%(m/v)人参根皂苷粉(人参皂苷含量75%),继续转化36 h,发酵结束。上述发酵条件设置3个重复,结果取平均值。
1.3.2 酶液和生物量的制备
待上述发酵液在8 000 r/min下离心10 min,收集上清液,即为粗酶液。取沉淀收集菌丝体,经真空抽提后于100℃电热恒温烘至恒重后称量菌丝体干重,确定生物量[8]。
1.3.3 酶活力的测定
取1 mg/mol(以0.02 mol/L,pH 5.0,HAc-cNaAc缓冲液配制而成)人参皂苷Rb1底物与酶液各0.1 mL于1 mL EP管中,40℃下反应24 h后加入0.2 mL水饱和正丁醇萃取溶剂,取上层10 μL作薄层色谱分析(TLC)。展开剂为氯仿∶甲醇∶水(70∶30∶5),展开约6 cm,挥干溶剂,喷洒10%硫酸-乙醇加热显色,根据斑点颜色深浅确定酶反应进度,利用Band-scan工具软件,对TLC图谱进行产物含量分析并计算酶活力。
酶活力定义:一定温度下,人参皂苷Rb1底物等体积反应24 h后,每小时转化生成0.1 mg人参皂苷Rd所需的酶量,定义为1个酶活力单位。
1.3.4 单因素试验设计
保持培养基其他组分不变,分别改变其中的碳源、氮源、金属离子、pH、发酵温度、发酵时间、瓶装量、摇瓶转数、底物投料量等培养条件,经过72 h摇床培养后测定相应酶活力和生物量,筛选出影响人参皂苷水解酶活力的关键因素。
1.3.5 响应面设计
采用Design Expert软件设计试验,运用BBD中心组合实验设计原理,依据多项模拟方程拟合试验对影响CGMCC No.4316产β-葡萄糖苷酶的关键因素作进一步研究,分析优化发酵最佳产酶条件。
2 结果与分析
2.1 培养基组分配比优化
2.1.1 不同碳源对产酶量的影响
以原始产酶培养基为基础,分别以3.0%葡萄糖、果糖、蔗糖,麦麸皮和淀粉作为碳源,按照1.3.1发酵方法进行培养,相同浓度下测定酶活,确定最佳碳源。结果显示,麦麸皮相对于其他碳源转化效果好(见图1)。
2.1.2 不同氮源对产酶量的影响
以原始产酶培养基为基础,分别以 3.0%NaNO3、(NH4)2SO4、蛋白胨、花生粉、酵母粉、豆粕粉作为氮源,相同浓度下测定酶活,确定最佳氮源。由图2可知,豆粕粉明显优于其他碳源,底物转化彻底,酶活力最高,达到90.4 U/mL。
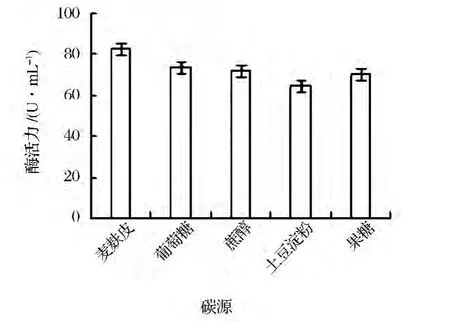
图1 碳源对产酶量的影响Fig.1 Effect of carbon source on enzyme production

图2 氮源对产酶量的影响Fig.2 Effect of nitrogen source on enzyme production
2.1.3 金属离子对产酶量的影响
在液体发酵产酶培养基中,分别以 K+、Mn+、Zn2+、Fe3+、Mg2+、Hg+、Cu2+、Ag+、Ca2+形式加入,加入量均为0.1%。以不加金属离子为空白对照,按照上述发酵方法测定酶活。结果显示,Cu2+对该菌产酶有明显的抑制作用,Ca2+则可以一定程度激活该菌生长和代谢,从而提高产酶能力,其他金属离子对产酶结果无明显影响。
2.2 培养条件优化
2.2.1 pH 对产酶量的影响
分别用1 mol/L HCl和1 mol/L NaOH调节酸碱度,测定不同初始 pH(3.0、4.0、5.0、6.0、7.0、8.0、9.0)对β-葡萄糖苷酶酶活力的影响,试验结果(图3)表明,初始pH 3.0时产酶量和生物量均处于最低水平,pH 5.0,酶活力最高,达到85 U/mL以上,菌丝体产量则达到最大值11.867 mg/mL。
2.2.2 发酵时间对产酶量的影响

图3 pH对产酶量和生物量的影响Fig.3 Effect of pH on enzyme production and biomass
按照上述培养基配比及培养条件,测定不同转化时间(24、48、72、84、96、120 及130 h)产酶情况,试验结果(图4)表明,随着时间推移,产酶量和生物量均呈现先升后降的趋势,在72 h两者数值均达到高峰,继续培养,增加幅度缓慢,随之产量下降,确定72 h为发酵产酶的最佳时间。
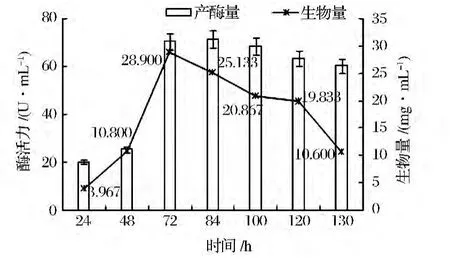
图4 发酵时间对产酶量和生物量的影响Fig.4 Effect offermentation time on enzyme production and biomass
2.2.3 发酵温度对产酶量的影响
按照上述培养基配比及培养条件,考察不同发酵温度(25、30、35、40、45 ℃)对底物的转化情况。试验结果表明,在25~35℃随温度增加,其产酶量增加,生长代谢加速,但超过40℃,菌体出现衰老自溶现象,酶逐渐失活。因此,确定最佳发酵温度为30℃。
2.2.4 瓶装量对产酶量的影响
250 mL 三角瓶中分别装入25、45、65、85、105 mL上述培养基成分,测定酶活力以确定最佳装瓶体积。试验结果(图5)表明,摇瓶的通气效果和装瓶体积呈反比,菌丝体产量随着装瓶量的增加而增加,但达到45 mL后,增加幅度不显著,但以45~65 mL瓶装量时产酶量较高。因此,最适瓶装量为45 mL/250 mL摇瓶。
2.2.5 摇瓶转数对产酶量的影响
按照上述筛选获得的最佳发酵条件,将培养基分装置于 100、140、160、180、200、220 r/min 下均转72 h,考察通气量对产酶量的影响(图6)。试验结果表明,转数低于160 r/min菌体长势缓滞;转数高于200 r/min,菌丝体由于剪切增值,致使产酶量大幅度降低,因此,选择最终转数为180 r/min。
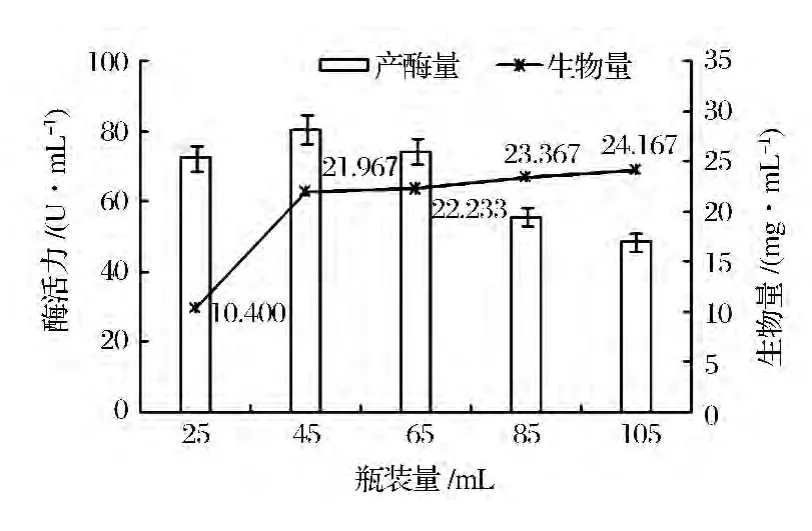
图5 瓶装量对产酶量和生物量的影响Fig.5 Effect ofmedium volume on enzyme production and biomass
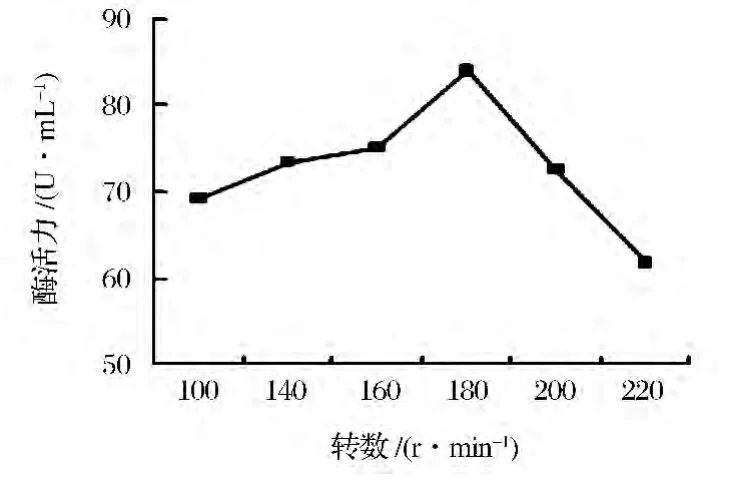
图6 摇瓶转数对产酶量的影响图Fig.6Effect of shaking speed on enzyme production
2.2.6 底物投料量对产酶量的影响
在以上最佳培养基配比和培养条件的基础上,加入底物人参根皂苷粉1%、2%、3%、4%、5%、6%,考察不同投料量对转化产酶量的影响。试验结果表明,底物人参根皂苷粉末浓度10~20 mg/mL时,酶活力达84 U/mL以上,但随着底物量增加,产酶量有所降低(图7)。

图7 底物投料量对产酶量的影响Fig.7 Effect of substrate concentration on enzyme production
2.3 响应面设计优化工艺
2.3.1 二次回归拟合及方差分析[9]
根据上述单因子试验结果,以培养基中对产β-葡萄糖苷酶活力影响较大的麦麸皮、蛋白胨和投料量3个因素为自变量,酶活力为响应值,设计3因素3水平的响应面分析试验。因素水平选取及编码见表1,试验设计方案及结果见表2。
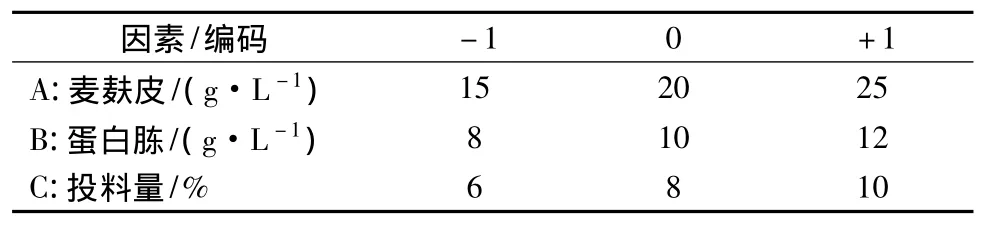
表1 因素水平设计与编码Table 1 factor level design and coding

表2 试验设计方案及结果Table 2 design scheme and test results
2.3.2 响应面试验结果分析
运用 D esign Expert 8.0软件对上述试验数据进行二次多项回归拟合,选择对响应值有显著影响的各项建立二次多元回归方程:Y=91.85+1.14A+0.19B+0.57C-1.23AB+0.16AC-1.47BC-7.73A2-5.48B2+0.23C2。
经方差显著性检验分析可知,该模型回归极显著(F=11.59,P=0.002 0),此方程校正总决定系数 R2=0.937 1,R2Adj=0.8563,说明各部分试验自变量与响应值之间线性关系显著,因此,该模型预测性与拟合性良好,可以作为CGMCC No.4316产β-葡萄糖苷酶试验的理论推测。由F值判断因子的有效率为麦麸皮(A)>投料量(C)>蛋白胨(B)。其中麦麸皮和蛋白胨的相互作用影响极差明显,优化结果见响应面曲线图(图8)和等高线图(图9)。通过响应面设计的最优组合为:麦麸皮 20.47 g/L、蛋白胨 9.74 g/L、投料量10%,酶活力可达92.793 U/mL。在响应面优化实验值下进行3次平行试验,验证结果显示,预测值与实际值几乎吻合。因此,该模型能够理想地预测CGMCC No.4316菌株的发酵产酶情况。
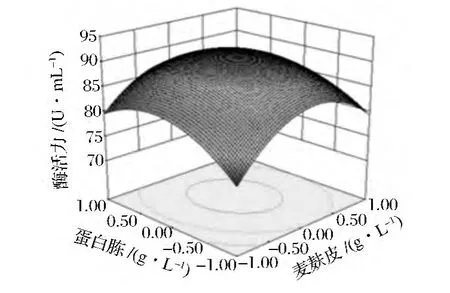
图8 各因素交叉作用对产酶量影响响应面曲线图Fig.8 Response surface plots showing the cross effects of factors on enzyme production

图9 各因素交叉作用对产酶量影响等高线图Fig.9 Line chart on highershowing the cross effects of factors on enzyme production
3 讨论
人参皂苷Rd是二醇型人参皂苷Rb1在人体肠道内的主要代谢产物之一,具有广泛的生物活性和生理作用。Rd的天然产量低,需从人参、三七、西洋参等药用植物的根、茎、叶中提取以满足医疗和科研的需要。该单体化合物的化学结构复杂,采用传统加热法、酸碱水解法可以使主要人参皂苷糖苷配基水解生成Rd[10],但因其反应条件剧烈,水解过程易发生脱水、差向异构、羟基化等副作用,目标产物很难形成。迄今为止,生物转化方法显示出立体选择区域较强、副产物单一等优势,这就使得生物转化制备稀有人参皂苷备受青睐。
近期的研究表明,能够水解人参皂苷的酶多数来自于细菌(如 Caulobacter leidyia[11])、霉菌(如 Absidia[12])、植物(如 Panax ginseng[13])。不同来源的真菌具有相似的酶解途径和水解特性[14],但各菌产酶能力及酶蛋白活性却各不相同,Son等[15]利用Thermus caldophilus可产生将主要人参皂苷Rb1转化成Rd的中间产物β-葡萄糖苷酶,但由于其抑制作用,反应时间延长30倍;Karikura等[16]研究表明肠道酶能将Rb1代谢为Rd,但在胃酸作用下Rb1不能彻底转化;Fu[17]从西洋参中分离出的大型药食兼用菌作为发酵菌株,为制备稀有人参皂苷Rd、Rb2、compound K提供参考,但由于其转化过程中转化产物不专一,底物对酶具有抑制作用。本文利用的灰绿犁头霉是从人参根内分离获得接合菌,在长期稳定的共生环境中可产生某种激素成分,促进人参生产或者增加人参的抗病能力。此外,由于该菌拥有转化底物及产物的专一性,有望应用于发酵罐进行大规模工厂化生产医疗保健领域的Rd单体制备。
本研究利用人参根内分离鉴定的CGMCC No.4316菌株对Rb1进行发酵产酶条件研究,通过TLC薄层图谱对照,计算机辅助优化分析模型,单因素设计试验进行发酵条件优化,初步选出对人参皂苷糖苷酶活力有较大影响的关键因素作响应面分析[18],在此基础上综合测定麦麸皮、蛋白胨及投料量对产酶量的进一步影响。借助Design Expert 8.0软件建立相关因素的数学模型,进而利用响应面回归分析获得二次多项式拟合方程[19],由校正系数及极差比较得出最优因子成分配比,获得了 CGMCC No.4316菌株转化Rb1生成Rd的最佳发酵工艺条件。研究结果表明,以麦麸皮20.47 g/L为碳源,蛋白胨9.74 g/L 为氮源,初始 pH 6.0,瓶装量 45 mL/250 mL,摇瓶转数180 r/min,投料量10%,30℃发酵72 h,其酶活力达到 92.78 U/mL。周伟[20]研究发现产酶培养基的组成和配比对天然药物产量的提高以及产物单一性具有决定性作用。本研究从碳、氮搭配合适,pH、温度调配恰当,转数和装瓶量适宜,原料经济合理几个方面着手,通过多种途径及不同原料配伍试验,可以在最短时间内迅速形成大量菌体,大幅度提高人参皂苷糖苷酶的活力,从而为获得大量、高纯度的人参皂苷Rd起到了一定的指导作用。此外,对于该内生菌产生的酶活性、酶性质以酶催化作用等问题,还有待深入探讨和研究。
[1]李泰平.人参皂苷药理活性的研究进展[J].生物学教学,2003,28(4):34-37.
[2]LI XZ,PIAO HS.A method for determination of ginsenoside Rh2pharmacological activity[J].Journal of Medical Science Yanbian University,2009,32(2):153-156.
[3]吴秀丽,王艳,赵文倩,等.真菌对人生皂苷Rg3的转化[J].微生物学报,2008,48(9):1 181-1 185.
[4]赵越,苏适.人参皂苷 Rh2抗肿瘤作用的研究[J].微生物杂志,2003,23(2):61-63.
[5]周超群,史训龙,李继扬,等.人参皂苷Rd高产突变株sp229-7的生长特性和生物转化[J].复旦学报(医学版),2010,37(1):59-62.
[6]赵立亚,鱼红闪,金风燮.酶法生产稀有人参皂甙及其产物成分的分析[J].大连轻工学院学报,2002,21(2):112-115.
[7]LI J,SHAO Z H,XIE J T,et al.The effects of ginsenoside Rb1on JNK in oxidative injury in cardiomyocytes[J].Archives of Pharmacal Research,2012,35(7):1 259-1 267.
[8]路秀玲,赵树欣.红曲霉固态发酵中生物量的测定方法[J].食品与发酵工业,2000,27(6):45-48.
[9]李市场,张鹏鹏,杨娜,等.黏红酵母产油脂培养基的响应面优化[J].中国粮油学报,2013,28(2):63-68.
[10]Kim M K,Lee J W,Lee K Y,et al.Microbial conversion of major ginsenoside Rb1 to pharmaceutically active minor ginsenoside Rd[J].J Microbiol,2005,43(5):456-461.
[11]Cheng L Q,Kim M K,Lee Y J,et al.Conversion of major ginsenoside Rb1to ginsenoside F2 by caulobacter leidyia[J].Biotechnology Letters,2006,28(14):1 121-1 127.
[12]YU HS,ZHANG CZ,SUN F,et al.Purification and characterization of new special ginseosidase hyzholyzing multi-glycisides of protopanaxadiol ginsenosides,ginsenisides type I[J].Chemical & Pharmaceutical Bulletin,2007,55(2):231-235.
[13]ZHANG C Z,YU H S,BAO Y M,et al.Purification and characterization of ginsenoside-a-arabinofuranase hydrolyzing glucoside Rc into Rd from the fresh root of Panax Ginseng[J].Process Biochemistry,2002,37(7):793-798.
[14]CHEN G T,YANG M,SONG Y,et al.Microbial transformation of ginsenoside Rb1by Acremonium strictum[J].Applied Microbiology and Biotechnology,2008,77(6):1 345-1 350.
[15]Son J W,Kim H J,Oh D K.Ginsenoside Rd production from the major ginsenoside Rb1by β-glucosidase from Thermus caldophilus[J].Biotechnol Letters,2008,30(4):713-716.
[16]Karikura M,Miyase T,Tanizawa H,et al.Studies on the absorption,distribution,excretion and metabolism of ginseng saponins. VII. Comparison of the decomposition modes of ginsenoside-Rbland-Rb2in the digestive tract of rats[J].Chem Pharm Bull,1991,39(9):2 357-2 361.
[17]付建国.人参皂苷微生物转化的研究[D].长春:吉林农业大学,2004.
[18]胡升,梅乐和,姚善泾.响应面法优化纳豆激酶液体发酵[J].食品与发酵工业,2003,29(1):13-17.
[19]Chen QH,He GQ,Mokhtar AM Ali.Optimization of medium composition for the production of elastase by Bacillus sp.with response surface methodology[J].Enzyme and Microbial Technology,2002,30(5):667-672.
[20]周伟.稀有人参皂甙Compound-CK的制备和活性研究[D].上海:复旦大学,2008.
