复合酶解降低山药黏液质黏度的工艺
2014-12-16张娇娇许学勤
张娇娇,许学勤
(江南大学食品学院,江苏无锡,214122)
山药(Rhizoma dioscoreae)为薯蓣科薯蓣属蔓生植物的块茎,其营养成分及生物活性成分较多[1],具有较高的食用和药用价值。但新鲜山药水分含量大,皮薄肉嫩,容易发生机械损伤,既不耐储藏也不方便运输,限制了它的流通。多年来,人们围绕山药制粉进行了大量的研究,已经报道的山药粉的制备方法主要有热风干燥[2-3]、冷冻干燥[4-5]等,但在制备过程中,往往涉及大量水溶性黏液质的流失。山药黏液质中含有大量蛋白质和多糖,具有较强的持水力[6],研究发现其对血管紧张肽转化酶[7]、DPPH·、O2-·及OH·均有较强的抑制作用[8-9],并有降血压[10]等活性。
为了利用山药黏液质,金金[11]曾将打浆后的鲜山药进行离心分离,分别利用上清液黏液质和沉淀物制粉。但由于黏液质黏度大,无法先浓缩再干燥,只能采用高成本的直接喷雾干燥法制粉。因此,有必要探索适当降低黏液质黏度的方法,以便能在喷雾干燥前,对分离的山药黏液质进行浓缩,降低干燥成本。顾林[12]、王常青[13]等人曾报道了山药加工过程中的打浆时间、温度及pH都会使浆体的黏度发生变化,并认为该变化主要是由于黏液质中的多糖、蛋白质分子变化所致。Takao[14]等人对山药黏液质的酶解试验结果也表明,其中的蛋白质及多糖是影响黏液质黏度的重要因素。
本研究采用多种水解酶对山药黏液质进行酶解,以黏度为指标从中筛选出效果较明显的酶进行复配酶解试验,以期最大程度降低黏液质的黏度,从而使山药黏液质在干燥前能够得到适当浓缩,以降低成本。
1 材料与方法
1.1 材料与仪器
山药,购于超市。
纤维素酶、甘露聚糖酶、果胶酶、中性蛋白酶、酸性蛋白酶等购于锐阳生物科技有限公司。
AB104-N型电子分析天平,梅特勒-托利多仪器(上海)有限公司;4K15高速冷冻离心机,美国SIGMA Sartorius公司;LVDV-Ⅱ+P型旋转黏度计,美国Brookfield公司;DS-1高速组织捣碎机,上海标本模型厂制造;DKZ-450型电热恒温振荡水槽,上海森信试验仪器有限公司。
1.2 实验方法
1.2.1 山药黏液质的制备
选择新鲜、无病斑的普通山药,洗净、去皮、切片,然后将山药片用高速组织捣碎机(速度12 000 r/min)处理30 s,成为山药浆。在4℃、10 000 g离心20 min[11],分离沉淀物和所需的黏液质上清液。
1.2.2 酶解
按试验设计比例加酶混合均匀,于50℃振荡水中反应。酶解结束后将反应液在冰水浴中冷却15 min,终止酶解反应。冷却的酶解液在4℃、10 000 g离心15min,得到除酶的离心上清液。
1.2.3 温度对黏液质稳定性的影响
分别将山药黏液质置于 40、50、60、70、80、90、100℃恒温水槽中保温30 min,急冷至4℃,在此温度下,以10 000 g离心15 min,测定上清液的黏度、蛋白质和多糖含量及抗氧化活性,与未经热处理的黏液质进行比较。
1.2.4 酶种类的选择
分别用纤维素酶、果胶酶、甘露聚糖酶、糖化酶、中性蛋白酶、酸性蛋白酶,对打浆后离心得到的黏液质进行酶解,加酶量为黏液质质量的0.4%,在各酶适宜温度条件下酶解反应70 min,反应结束后冷却、离心,然后测定上清液的黏度,根据酶解液黏度的降低程度确定进一步试验用酶的种类。
1.2.5 复合酶解的单因素试验
酶解温度∶按纤维素酶:甘露聚糖酶=3∶1的复合酶,加酶量 0.4%,分别于30、40、50、60、70 ℃酶解 70 min。
复合酶配比:分别按纤维素酶∶甘露聚糖酶=4∶1、3∶1、2∶1、1∶1、1∶2、1∶3、1∶4添加复合酶 0.4%,50℃酶解70 min。
加酶量:分别按 0.1%、0.2%、0.4%、0.6%、0.8%、1.0%的加酶量,加入纤维素酶∶甘露聚糖酶=3∶1的复合酶,50 ℃反应 70 min。
酶解时间:按纤维素酶∶甘露聚糖酶=3∶1的复合酶配比、酶解温度50℃、加酶量0.4%,取不同的反应时间 0、20、40、60、80、100、120 min。
1.2.6 复合酶解的正交试验
在复合酶解单因素实验的基础上,以黏液质黏度为考察指标,选择复合酶配比、酶用量、反应时间3个因素进行3水平正交实验。
1.2.7 测定方法
1.2.7.1 黏度
采用LVDV-Ⅱ+P型旋转黏度计。选择SC4-18号转子测定,测温25℃,转子转速80 r/min。
1.2.7.2 总糖
采用苯酚-硫酸快速测定方法。吸取1 mL样品液,依次加入1 mL 6%的苯酚,摇匀,迅速加入5 mL浓H2SO4,摇匀;空白以1 mL蒸馏水代替样品液;室温下放置20 min后,在490 nm处测定样液的吸光值,通过标准曲线,计算出黏液质中总糖含量。
1.2.7.3 蛋白质的测定
紫外分光光度快速测定法[15]。
1.2.7.4 DPPH·除率的测定
参照江波等人的方法[16]。利用DPPH无水乙醇溶液在517 nm处有紫色团的特征吸收峰,测定加入抗氧化剂后,在517 nm处吸光值的下降表示其对DPPH·的清除能力。
1.2.7.5 总还原力的测定
参照李利华[17]及江波等人[16]的研究方法。
1.2.7.6 清除超氧阴离子能力的测定
参照王震宙[18]等人的试验方法。
1.2.8 数据处理
利用Origin作图像处理,文中数据均以3次测定数据的平均值以及标准偏差的形式表示。
2 结果与讨论
2.1 温度对黏液质的影响
将山药黏液质置于不同温度的恒温水槽中保温30 min,考察温度对黏液质黏度及蛋白质、多糖含量的影响,结果见图1和图2。
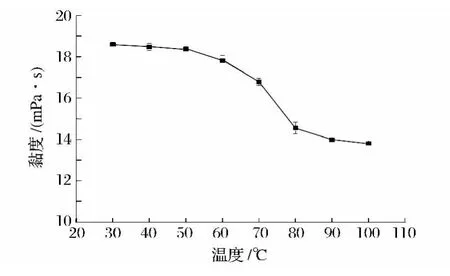
图1 温度对黏液质黏度的影响Fig.1 Effect of temperature on viscosity of mucilage
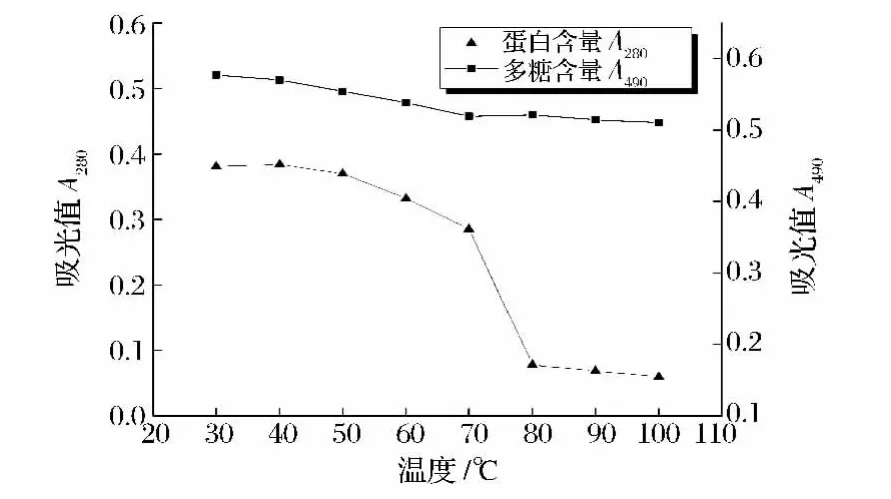
图2 温度对黏液质成分的影响Fig.2 Effect of temperature on contents of mucilage
由图1、图2可知,山药黏液质的黏度、蛋白质和多糖含量均随温度的上升而下降,而多糖含量随温度以一种缓慢的趋势下降,三者的含量在30~50℃的下降速度均较缓慢。这一现象可以解释为,随着温度增加,聚合物分子热运动加剧,分子间缔合的氢键发生断裂,从而使黏度下降,而多糖和蛋白质含量的降低,可能与黏液中悬浮的非水溶性(或热变性形成的聚合物)部分沉淀有关。在50~100℃,由于蛋白质发生热变性,蛋白质含量急剧下降,多糖含量也缓慢下降,多糖-蛋白质的结构受到破坏,黏度下降速度加快。因此,山药黏液质的黏度与蛋白质、多糖含量呈正相关的关系。
图3显示,在30~50℃,山药黏液质的还原力及对DPPH·、O2-·的清除率变化趋势平缓,说明在此温度范围内,黏液质的性质较稳定,温度对其活性影响较小;而在50~100℃过程中,其抗氧化活性下降速率加剧,与黏度、蛋白质含量的变化趋势相似,说明随着温度升高,黏液质中多糖-蛋白质结构受到破坏,活性也随之降低。因此,从保持黏液质活性角度来说,加工处理过程的温度不宜高于50℃。
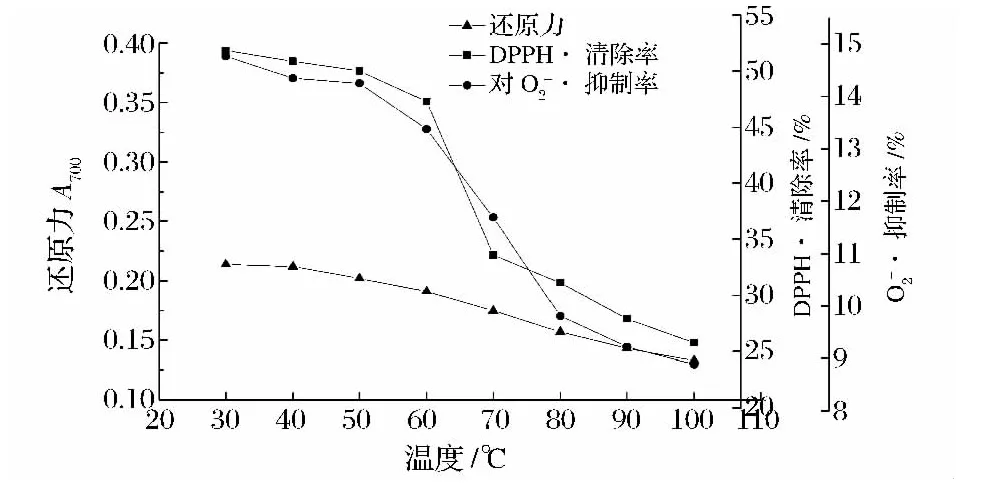
图3 温度对黏液质抗氧化活性的影响Fig.3 Effect of temperature on antioxidant activity of mucilage
2.2 酶种类的选择
根据山药黏液质固形物中蛋白质占25.02%和总糖占 67.79% 这一特点,以及王常青[13]、Takao[14]等人的试验结论,选用多种以这2类物质为底物的水解酶对黏液质进行酶解,其对黏液质黏度的影响如图4所示。

图4 酶种类对山药黏液质黏度的影响Fig.4 Effect of kinds of enzymes on viscosity of yam mucilage
由图4可知,所选酶中,以纤维素酶和甘露聚糖酶的酶解对黏液质黏度影响最大。黏液质经纤维素酶、甘露聚糖酶酶解后,黏度由28.16 mPa·s分别下降到19.51、20.17 mPa·s。甘露聚糖酶酶解能使黏液质黏度明显下降,主要原因是这种酶作用的底物甘露聚糖是山药黏液质多糖中的主要成分;而纤维酶是一种多酶制,除能水解葡聚糖中β-1,4糖苷键的多酶制剂外,对黏液质中的木聚糖、可溶性纤维素等也有降解作用,使多糖分子量降低,从而降低体系黏度。所以,选择纤维素酶、甘露聚糖酶两种酶进行复配酶解试验,以进一步降低黏液质的黏度。
2.3 复合酶解的单因素试验
2.3.1 酶解温度对黏液质黏度的影响
固定加酶量0.4%,纤维素酶与甘露聚糖酶配比为3∶1,反应时间70 min,考察酶解温度对黏液质黏度的影响,结果如图5所示。
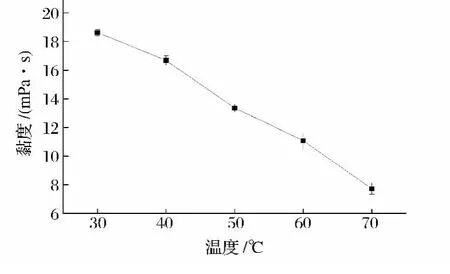
图5 反应温度对山药黏液质黏度的影响Fig.5 Effect of hydrolysis temperature on viscosity of yam mucilage
由图5可见,在30~70℃黏液质黏度呈持续下降趋势,而没有表现出一般温度对酶反应影响的最适温度行为。原因是,在60℃以前,酶活力随温度(朝最适温度方向)上升而增强,对黏液质的降解程度也增大,从而使黏度也随之逐渐下降;而温度上升到60℃时,样品中开始出现少量絮状物,到达70℃时,则有大量白色絮状沉淀,离心后样品液澄清透明,黏度产生不可逆性下降[13],黏液质中蛋白质变性絮凝。因此,结合温度对黏液质影响结果(图2和图3)的讨论,选择试验温度为50℃。
2.3.2 复合酶配比对黏液质黏度的影响
固定加酶量0.4%,反应时间70 min,酶解温度50℃,考察纤维素酶与甘露聚糖酶不同配比对黏液质黏度的影响,结果如图6所示。

图6 纤维素酶/甘露聚糖酶对山药黏液质黏度的影响Fig.6 Effect of Celluse/Mannase on viscosity of yam mucilage
由图6可看出,酶解液黏度随纤维素酶-甘露聚糖酶复合配比表现出一种先下降再升高的趋势,纤维素酶-甘露聚糖酶配比为3∶1时,黏度下降最明显,由26.81 mPa·s降至14.69 mPa·s。过此配比点后,随着甘露聚糖酶在复合酶中比例的增加,黏度下降程度逐渐减少。出现这种趋势的可能原因是,加入的甘露聚糖酶为专一性酶,仅对甘露聚糖β-1,4糖苷键作用,添加量易达到饱和状态;而纤维素酶可降解多种糖分结构,其添加比例的减少,会影响对某些成分的降解,从而影响黏度下降。因此,优化试验时,纤维素酶-甘露聚糖酶复合酶配比条件可围绕3∶1选择。
2.3.3 加酶量对粘液质黏度的影响
固定纤维素酶与甘露聚糖酶配比为3∶1,反应70 min,酶解温度50℃,以不同复合酶添加量进行试验,得到的结果如图7所示。
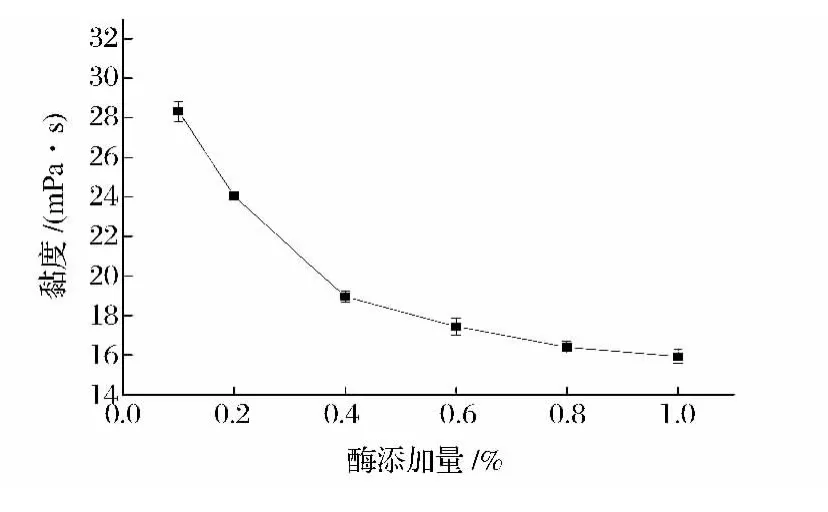
图7 酶添加量对山药粘液质黏度的影响Fig.7 Effect of the amount of enzyme on viscosity of yam mucilage
由图7可知,随着加酶量的增加,山药黏液质黏度呈现前面下降较快,后面下降趋缓的模式。这种黏度下降快慢模式的变化,出现在0.4% ~0.6%。因此,将加酶量控制在一定范围内,可能提高酶解过程酶的效力。从经济效益和酶解效果角度考虑,选择加酶量0.4%、0.5%、0.6%作为正交试验的3水平。
2.3.4 反应时间对黏液质黏度的影响
固定加酶量0.4%,纤维素酶与甘露聚糖酶配比为3∶1,酶解温度50℃,考察酶解反应时间对黏液质黏度的影响,结果如图8所示。
由图8可知,酶解时间对山药黏液质的黏度影响也呈现非线性的下降模式,前期黏度下降较快,后期黏度下降速度趋缓,在80 min处出现转折。这是因为刚开始酶解时,底物浓度高,酶催化底物反应速度也快,但底物浓度随着酶解的进行而下降,从而使得酶反应速度也下降。因此,正交试验的酶解时间可选择80 min左右。
2.4 复合酶解的正交试验
表1为采用L9(34)正交表设计的实验因素水平表,实验结果如表2所示。
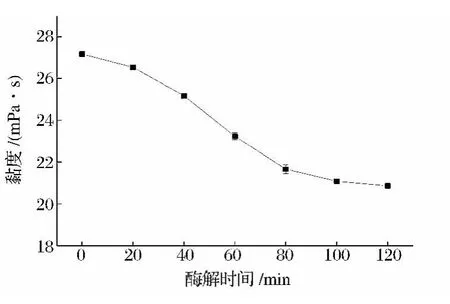
图8 反应时间对山药黏液质黏度的影响Fig.8 Effect of hydrolysis time on viscosity of yam mucilage

表1 正交实验因素水平表Table 1 Factors and levels of the orthogonal array design

表2 正交实验结果Table 2 Results of the L9(34)orthogonal array design
由表2可以看出,影响黏度的主次因素为B>C>A。表3的方差分析也表明,酶添加量对黏度影响较为显著。根据实验结果分析,选择的最优因素水平为:A2B3C3,即复合酶配比为2∶1,酶添加量为0.6%,反应时间90 min。按照1.2.4的方法,根据1.2.6实验得到的酶解优化条件,对山药黏液质进行酶解,3次重复实验结果表明,山药黏液质黏度由酶解前的26.09 mPa·s,降至 9.18 mPa·s,降低了 64.81%,效果显著。
从总的效果来看,酶解使山药黏液质黏度降低的效果明显,有利于喷雾干燥前的预浓缩。
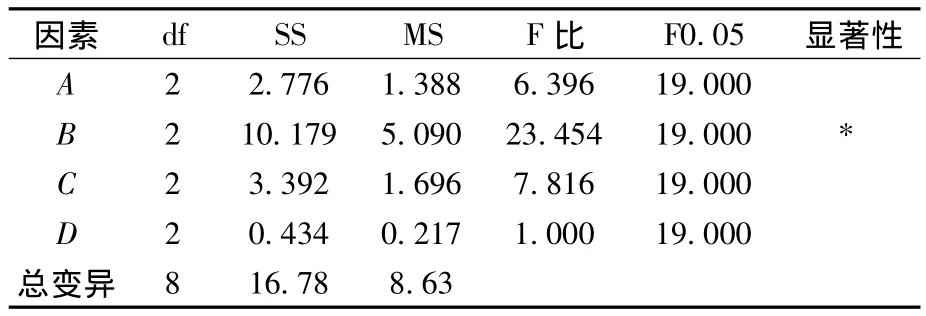
表3 正交实验方差分析Table 3 Variance analisis of orthogonal array design
3 结论
山药黏液质黏度及生物活性与温度有较大关系,超过60℃,黏液质黏度会因出现明显浑浊沉淀物而下降,同时抗氧化活性也随之大大下降。由纤维素酶和甘露聚糖酶以2∶1配成的复合酶,在酶添加量0.6%、反应90 min、50℃的优化条件下,对山药黏液质时行酶解,可使山药黏液质的黏度降低近65%。主要原因是所选的纤维素酶、甘露聚糖酶可作用于粘液质中多糖的糖苷键,将链长而复杂的多糖降解,降低其分子量,从而降低黏度[19]。该方法具有促成实现黏液质先预浓缩再喷雾干燥工艺的潜力。
[1] Chien-Chunhuang,Po-Yuanchiang,et al.Chemical compositions and enzyme activity changes occurring in yam(Dioscorea alata L.)tubers during growth[J].LWT,2007,40(9):1 498-1 506.
[2] 蔡骏.山药精粉的研制[J].粮食与饲料工业,1998(2):47-49.
[3] 李强,叶青.山药粉加工工艺的研究[J].农产品加工学刊,2011(12):66-69.
[4] 许光映,胡晓军,邓晓燕.全薯山药粉工艺的研究[J].农产品加工学刊,2011(9):76-79.
[5] 徐成海,张世伟,胡天玉.山药真空冷冻干燥的实验研究[J].真空科学与技术,1996(6):449-452.
[6] An-I Yeh,Tzu-Yin Chan.Effect of water content and mucilage on physico-chemical characteristics of Yam(Discorea alata Purpurea)starch [J].Journal of Food Engineering,2009,95(1):106-114.
[7] Lee M H,Lin Y H,Hsu F L,et al.The mucilage of yam(Dioscorea batatas Decne)tuber exhibited angiotensin converting enzyme inhibitory activities[J].Bot Bull Acad Sin,2003,44:267-273.
[8] Shyr-Yi Lin,HLYL.Antioxidant activities of mucilages from different Taiwanese yam cultivars[J].Bot Bull Acad Sin,2005,46:183-188.
[9] Wen-Chi Hou,FHML.Yam(Dioscorea batatas)tuber mucilage exhibited antioxidant activities in Vitro [J].Planta Med,2002,68(12):1 072-1 076.
[10] Takeshi Nagai.Functional Properties of Dioscorin,a Soluble Viscous Protein from Japanese Yam(Dioscorea opposita Thunb.)Tuber Mucilage Tororo[J].Z Naturforsch,2006(61):792-798.
[11] 金金,许学勤.山药制粉加工技术的研究[D].无锡:江南大学,2011.
[12] 顾林,姜军.山药加工中黏度特性研究[J].中国粮油学报,2007,22(3):134-136.
[13] 王常青,史小川.长山药粘液质的黏度与热稳定性的研究[J].食品工业科技,1995(3):9-12.
[14] Takao Myoda,Yosuke Matsuda,etal.Identification of Soluble Proteins and Interaction with Mannan in Mucilage of Dioscorea opposita Thunb.(Chinese Yam Tuber)[J].Food Science Technology Research,2006,12(4):299-302.
[15] 焦利敏,廖学品,石碧.紫外分光光度法下直接测定蛋白质溶液的浓度[J].化学研究与应用,2007,19(5):562-565.
[16] 李艳红,江波.鹰嘴豆蛋白Alcalase水解工艺及其体外抗氧化活性的研究[J].浙江大学学报,2007,33(4):392-399.
[17] 李利华.鱼腥草多糖体外抗氧化活性研究[J].安徽农业科学,2012,40(6):3 286-3 288.
[18] 王震宙.山药多糖的提取、分离、功能性及其食品工艺研究[D].南昌:南昌大学,2005.
[19] 姜莹,周雅婷.明胶分子量与黏度的关系[J].明胶科学与技术,2010,30(3):132-135.
