Thielavia terrestris产纤维素酶液态发酵条件的优化*
2014-12-16余培铠刘刚栗荷天王娟
余培铠,刘刚,栗荷天,王娟
(深圳大学生命科学学院,深圳市微生物基因工程重点实验室,广东深圳,518060)
寻找快速、高效、稳定的纤维素酶是目前生物质能源利用领域的一个重要课题。迄今为止纤维素酶已在食品、饲料、医药、纺织、洗涤剂和造纸等工业领域已经得到广泛应用[1],但纤维素酶大规模生产及应用的难题仍未得到很好解决。一方面,纤维素酶的产量及酶的比活力低一直制约着纤维素酶的实际应用;另一方面,现有的纤维素酶产品大多来源于木霉、青霉、曲霉等中温菌,在实际利用过程中存在酶的温度稳定性较差和纤维素降解率低这两大制约因素。耐热真菌具有适应高温环境,培养过程不易受常温微生物的污染等优点。其产生的纤维素酶具有较好的热稳定性,较高温度下能保持较高的降解速度,因此能更好地适应工业中的高温工作环境,具有广泛的应用前景[2-4]。
本文对1株嗜热子囊真菌Thielavia terrestris进行产酶条件优化。该菌中含有种类丰富的糖苷水解酶,具有水解生物质中多种主要多糖的能力,可产生大量的纤维素降解酶类,其所产酶的最适温度多在60~80℃,温度耐受性良好[5-6]。
1 材料与方法
1.1 材料
1.1.1 菌种
Thielavia terrestris(ATCC38088),购自美国菌种保藏中心。
1.1.2 培养基
(1)种子培养基:马铃薯 200 g,葡萄糖 20 g,加水至1 000 mL。
(2)无碳基础培养基:(NH4)2SO44 g,KH2PO42 g,MgSO4·7H2O 0.5 g,蛋白胨 10 g,牛肉膏 5 g,加水至1 000 mL。
(3)无氮基础培养基:CMC-Na 10 g,KH2PO41 g,MgSO4·7H2O 1 g,NaCl 5 g,加水至 1 000 mL。
(4)产酶发酵培养基:CMC-Na 10 g,(NH4)2SO44 g,KH2PO42 g,MgSO4·7H2O 0.5 g,蛋白胨10 g,牛肉膏5 g,加水至1 000 mL,pH 自然(约5.5)。
1.1.3 试剂
3,5-二硝基水杨酸(DNS)、无水亚硫酸钠、结晶酚、0.05%柠檬酸钠缓冲液、定量滤纸等。
1.2 实验方法
1.2.1 种子活化
将低温保存的原始菌种接种到固体PDA平板,37℃培养7 d。
1.2.2 种子扩培
用无菌水洗下成熟平板上的孢子,调整孢子浓度为107个/mL,取1 mL接入40 mL种子培养基(250 mL锥形瓶)中,200 r/min、40℃恒温振荡36~48 h,制备成种子液。
1.2.3 产酶发酵培养
按2%接种量吸取800 μL种子培养液到含有40 mL产酶培养基的250 mL锥形瓶中,摇床200 r/min、40℃恒温培养4 d。
1.2.4 粗酶液提取
用移液器从培养4 d的产酶培养基中吸取2 mL酶液于1.5 mL离心管,5 000 r/min离心15 min,用柠檬酸钠缓冲液(0.05 mol/L,pH 4.8)进行适当稀释。于4℃下保存备用。
1.2.5 滤纸酶活力(FPase)的测定[7-8]
加1.5 mL柠檬酸钠缓冲液(0.05 mol/L,pH 4.8)于试管中,加入滤纸条50 mg(新华定量滤纸,约1 cm×6 cm),再加入0.5 mL经适当稀释的酶液,50℃水浴保温1 h,按DNS法测定还原糖。每个样品设置对照(同等条件不加滤纸)。酶活定义:在上述条件下,以水解反应中1 min催化底物水解形成1 μmoL还原糖所需酶量为1个酶活力单位(U)。
1.2.6 碳氮源对菌株产酶能力的影响
将种子原液以2%接种量分别接种到含有1%不同碳源(CMC-Na、Avicel、滤纸、稻草粉、麦麸、淀粉、葡萄糖、)的无碳基础培养基和含有1%的不同氮源(牛肉膏、蛋白胨、黄豆粉、氯化铵、酵母提取物、硫酸铵)的无氮基础培养基中,培养4 d,测定其FPase酶活,检测碳氮源对产酶的影响。
1.2.7 培养条件对菌株产酶能力的影响
分别以1%、2%、4%、6%、8%的不同接种量接种于CMC-Na产酶发酵培养基,考察接种量对菌株产酶能力的影响;以2%的接种量接种至产酶发酵培养基中,调节培养基 pH 分别为 3.0、3.5、4.0、4.5、5.0、5.5、6.0,检测培养起始pH值对菌株产酶的影响;以2%的接种量接种产酶发酵培养基,设置不同培养温度37、40、45、50、55℃,考察培养温度对菌株产酶的影响;菌株在上述条件下恒温摇床培养4 d,分别测定其FPase酶活。以2%的接种量接种到CMC-Na产酶发酵培养基培养,每隔8h取样进行酶活及菌丝干重的测定,观察菌株在培养过程中的产酶规律及菌丝生长情况。
1.2.8 优化条件正交设计
根据单因素实验结果,选取对产酶活性影响较大的3个主要因素(碳源、氮源、初始pH),采用正交实验优化发酵培养基条件。
1.2.9 粗酶液最适作用条件及温度稳定性的测定
设置不同pH及反应温度,分别测定粗酶液在不同pH(3.0~9.0)及不同温度(30~80℃)下的催化活性。
将一定粗酶液分别于不同温度(60、70、80℃)下,分别恒温孵育 0、10、20、30、40、50、60 min 后测定剩余酶活。
2 结果与分析
2.1 产酶培养条件的优化
2.1.1 不同碳源对产酶的影响
在不同碳源诱导下菌株的产酶活性具有明显差异(如图1所示)。以麦麸为唯一碳源时滤纸酶活(FPase)最高;其次为 Avicel、稻草粉、CMC-Na、滤纸、淀粉。麦麸含有多种复杂成分,可能作为各种诱导因子,从而对产纤维素酶起到较好的诱导效应。以葡萄糖为碳源时酶活最低,分析其原因主要为菌体不需产生纤维素酶即可直接吸收利用葡萄糖,另外,过量的葡萄糖会对纤维素酶的合成产生抑制,即分解代谢物阻遏效应。

图1 碳源对菌株产纤维素酶的影响Fig.1 Effect of different carbon sources on cellulase production
2.1.2 不同氮源对产酶的影响
不同氮源对产酶诱导的结果表明,以黄豆饼粉为唯一氮源时酶活最高(见图2)。黄豆饼粉不仅提供氮元素,还含有钙、镁、钾、磷、铁等矿物质,部分金属离子可作为纤维素酶的活性基成分或激活剂[14]。其次酶活从高到低的氮源依次为氯化铵、硫酸铵、蛋白胨、酵母提取物、牛肉膏。

图2 不同氮源对菌株产纤维素酶的影响Fig.2 Effect of different nitrogen sources on cellulase production
2.2 产酶培养条件的优化
当培养基起始pH为4.0时,菌株发酵液酶活达到最高(图3)。菌株产纤维素酶的最适温度为45℃,在40~50℃酶活对温度的改变表现出较强的适应性,温度达到55℃以上时,菌体生长十分缓慢,酶活也随之急剧下降(图3-B)。接种量对酶活影响的试验结果表明,当接种量为6%时酶活到达最高(图3-C)。菌株生长及产酶受到接种量的影响。接种量不足,不能充分利用发酵培养基;接种量过多,菌体衰老快,也不利于产酶[10]。不同摇床转速的实验结果表明,酶活在转速为200 r/min时为最高。
产酶活性及菌丝生长随时间变化结果表明,酶活在48 h即可达到最高(图3-D)。72 h内酶活均比较稳定,72 h以后酶活力下降较快,可能由于营养耗尽造成菌体衰老死亡,代谢物积累抑制了菌株产酶;菌丝生长在40~48 h内达到顶峰,在这期间菌液颜色变化明显,呈乳白色,此时细胞快速增长,产酶活性最高;随后由于发酵液黏稠度渐渐升高,传质性变差,不利于透气等导致菌体逐渐衰老死亡。

图3 不同培养条件对菌株产酶能力的影响Fig.3 Effect of different culture conditions on cellulase production
2.3 发酵条件正交试验
正交试验L9(33)设计(见表1)。
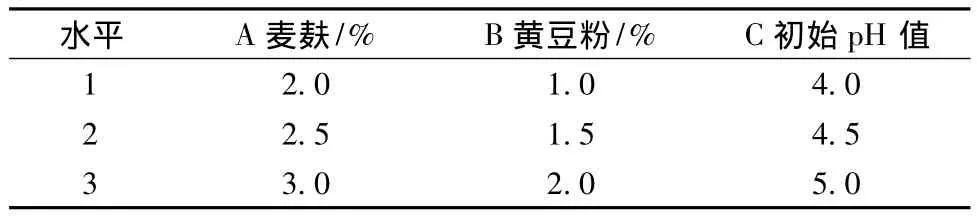
表1 正交试验设计Table 1 The design of orthogonal experiment
发酵过程中3因素对滤纸酶活力的影响能力依次是B>A >C,即氮源对酶活影响最大,其次是碳源,pH在4.0~5.0范围内波动对酶活影响最小。故选择酶活力最高的培养条件为A2B3C1,即麦麸2.5%,黄豆饼粉2.0%,pH 4.0。
采用优化前和优化后的培养基和培养条件同时进行产酶实验,优化后所得滤纸酶活得到了显著提高,可达1.39 U/mL,较优化前的0.96 U/mL约提高了44.8%。方差分析显示,其中氮源对发酵产酶活性影响显著(P<0.05)(见表3)。

表2 正交试验结果Table 2 Orthogonal test results

表3 方差分析Table 3 Variance analysis of the Orthogonal Experiment of T.terrestris fermentation
2.4 粗酶的最适作用条件及温度稳定性

图4 粗酶液的催化性质Fig.4 The Catalytic Properties of crude enzyme
粗酶液在不同pH(3.0~9.0)及不同温度(30~80℃)下的催化活性不同。结果表明,粗酶液最适作用pH值为6.0,最适作用温度为60℃。
在不同的温度条件下恒温孵育一段时间后,测定其粗酶的FPase活性(图4)。在60、70、80℃分别孵育60 min,粗酶液酶活分别为原始酶活的82%、76%、63%左右。由此可见,该菌株粗酶液中的纤维素酶在60~80℃下具有较好的热稳定性。
3 结论
T.terrestris可合成并分泌种类丰富的木质纤维素降解酶类[11],其所产酶具有较强的热稳定性。本文对T.terrestris(ATCC38088)菌株产酶条件进行了优化,确定了其最佳培养条件。在单因素实验中,麸皮能显著提高滤纸酶活力,可能由于它含有促进微生物生长和产酶的因子,且能吸收水分保持湿润,故可用麦麸作为该菌株产纤维素酶的最佳诱导物。黄豆饼粉含有丰富的营养成分,能使菌体迅速生长,酶活力高于其他氮源,故可作为最佳氮源。优化过程中,除了接种量外,接种液的状态对酶活也会产生明显的影响,这可能是由于菌体的生长形态(丝状或球状)的不同导致。
优化前采用CMC-Na产酶发酵培养基,优化后确定以2.5%的麦麸、2.0%的黄豆饼粉,初始pH值为4.0为最佳产酶条件,测得滤纸酶活较优化前提高了44.8%,达到了1.39 U/mL。同时该菌株所产酶在60~80℃仍保持较好的热稳定性,如果通过进一步的研究和改造,该菌将成为有应用潜力的工业菌株。
[1] 汤斌,陈阿娜,张庆庆.纤维素酶产生菌的筛选鉴定和产酶条件优化[J].食品与发酵工业,2007,33(6):6-8.
[2] 魏艳红,熊鹰,袁永泽.纤维素酶产生菌HS-F9的筛选鉴定和产酶条件优化[J].应用与环境生物学报,2010,16(2):274-278.
[3] Wood TM,Maccpae SI.In bioconversion of cellulose substance into energy,chemicals and microbial protein[M].Ghose T K ed.Indian Institute of Technology,New Delhi,India,1978:111-141.
[4] Bruins M.E,Janssen A.E,Boom R.M.The IT I1ozymes and their applications:a review of recent literature and patentsr[J].Appl Biochem Biotechno1,2001,90(2):155-186.
[5] 赵春青,李多川.嗜热子囊菌两个中国新记录种[J].菌物研究,2005,3(1):27-29.
[6] Berka RM,Grigoriev IV,Otillar R,et al.Comparative genomic analysis of the thermophilic biomass-degrading fungi Myceliophthora thermophila and Thielavia terrestris[J].Nat Biotechnol,2011,29(10):922-927.
[7] Ghose T.Measurement of Cellulase Activities[J].Pure Appl Chem,1987,58(2):257-268.
[8] 陆晨,陈介南,王义强.纤维素酶的滤纸酶活和CMC酶活的测定[J].印染助剂,2002,5(19):51-53.
[9] 张洪鑫,陈小泉,蒋玲玲.金属离子对纤维素酶内切酶和外切酶活性的影响[J].纤维素科学与技术,2011,19(4):6-13.
[10] 阚国仕,陈春,陈红漫.绿色木霉95 106固态发酵生产纤维素酶条件优化研究[J].中国酿造,2011,12(23):130-133.
[11] James A.Langston,Kimberly Brown,Feng Xu.Cloning,expression,and characterization of a cellobiose dehydrogenase from Thielavia terrestris induced under cellulose growth conditions[J].Biochimica et Biophysica Acta,1824(2012)802-812.
