3种杀菌方式对蛋清液功能特性及蛋白结构的影响*
2014-12-16范金波侯宇王瑞环周素珍吕长鑫冯叙桥
范金波,侯宇,王瑞环,周素珍,吕长鑫,冯叙桥
1(渤海大学食品科学研究院辽宁省食品安全重点实验室,辽宁锦州,121013)
2(中国农业大学食品科学与营养工程学院,北京,100083)
高密度CO2(DPCD)、高压脉冲电场(PEF)都是非热食品加工的重要方法,它们都能杀死致病菌、腐败微生物以及钝化酶类物质,因而能保藏食品。与传统热杀菌方法相比,由于排除了热引起的食品成分及风味物质的变化,因而能较好地保存食品原有的营养价值和风味、口感等[1]。国外对于这2种非热杀菌研究较多,尤其是高压脉冲电场方面,而我国对此的研究起步晚,且大多研究都只是针对非热杀菌处理对食品中的微生物和酶的影响方面,对非热杀菌处理对食品功能性质的影响研究较少。蛋清液具有良好的起泡、乳化等功能性质,在食品工业中占据重要地位,而热处理以及非热杀菌处理对蛋清液这些功能性质及蛋白结构的影响研究尚不够深入,本研究评价了DPCD、PEF和热处理对蛋清蛋白的溶解性、起泡性、乳化性等功能性质以及表面疏水性和蛋白质聚集等结构特征的影响,以期对这3种杀菌方法在蛋液杀菌中的应用奠定理论基础。
1 材料与方法
1.1 材料与仪器
所有鸡蛋均来自北农大集团前一天所产鸡蛋。牛血清蛋白购自北京鼎国生物技术有限责任公司;8-苯胺基-1-萘磺酸(ANS)N-乙基顺丁烯二酰亚胺(NEM)均购于Sigma公司。
WBN-5/50二氧化碳高密度灭菌机,温州贝诺机械有限公司;S10手提式高速分散器,宁波新芝生物科技股份有限公司;JSM-6510LV扫描电子显微镜,日本电子株式会社;RF-5301 PC荧光分光光度计,日本岛津Shimadzu公司;UV-2102 PC型紫外可见分光光度计,美国UNIC尤尼柯公司;DK-8B恒温水浴锅,上海市精宏实验设备有限公司;ALC-2100.2型电子天平,Acculab公司;pH211型pH酸度计,HANNA公司;HWS型恒温恒湿培养箱,宁波江南仪器厂;DHG-9076A型电热恒温鼓风干燥箱,上海精宏实验设备有限公司;3K30高速离心机,美国Sigma公司;实验中使用的PEF杀菌试验装置为中国农业大学食品科学与营养工程学院教育部果蔬加工工程研究中心与清华大学自主研发设计。PEF参数设置:脉冲宽度5 μs;脉冲频率16 Hz;处理腔间距0.4 cm;处理室个数2;流速0.2 mL/cm。
1.2 实验方法
1.2.1 蛋清液的制备
将蛋壳完整无损的鸡蛋在自来水中清洗干净,室温下晾干后,用酒精棉擦试蛋壳表面,然后打蛋,滤蛋器小心分离蛋黄,用电动搅拌器搅拌均匀,得到蛋清液。
1.2.2 分别采用3种杀菌方式处理蛋清液
DPCD杀菌:首先开启冷却器和恒温水浴使其达到设定温度。之后,开启水浴循环使处理釜达到30℃,接着将样品放入处理釜中,完全密封后开启增压泵泵入CO2,在处理釜内形成高密度CO2处理环境,维持恒定的压力(35 MPa)和温度,处理60 min后卸压取出样品。
脉冲电场杀菌:PEF电场强度E和处理时间t的计算:

式中:U,实际电压,kV;电极板间距,0.4 cm;n,处理室个数;V,处理腔体积,0.05 mL;f,频率,Hz;W,脉宽,μs;v,流速,mL/s。电压强度采用10 kV。
热处理杀菌:蛋清液的热处理过程采用模拟工业上巴氏杀菌的方法。将蛋清液装在内径11.5 mm的玻璃试管中,每管装10 mL蛋清液,为确保无微生物污染,试管提前灭菌。先将蛋清液经45℃预热10 min后在60℃保持3.5 min。
1.2.3 紫外光谱法测蛋白质含量
以牛血清蛋白为标准物,测其在280 nm(A280)的紫外光谱吸收[2-3]。称取50 mg牛血清蛋白配制成50 mL的溶液,然后用蒸馏水稀释至质量浓度为0.1、0.2、0.3……0.9 mg/mL,以蒸馏水为对照,测定其在280 nm下的分光光度值。绘制标准曲线,吸光度与牛血清蛋白浓度的线性关系为:y=0.648x+0.030(R2=0.998)。将处理前后的蛋清液离心后稀释100倍,以蒸馏水为对照,测A280值,根据标准曲线计算其蛋白含量。
1.2.4 溶解性的测定[4]
将处理前后的蛋清液于10 000 r/min,4℃下离心10 min,取上清液测定蛋白质含量。蛋清蛋白的溶解度计算:

1.2.5 起泡性及起泡稳定性的测定
根据Sathe等[5]使用的方法,用去离子水将处理前后的蛋清液稀释到蛋白质浓度为2%,取100 mL稀释液250 mL烧杯中,用高速分散器以10 000 r/min的转速分散2 min。记录分散停止时和停止后30 min的泡沫体积数为V1及 V2,起泡性(FC)与泡沫稳定性(FS)计算:

1.2.6 乳化性及乳化稳定性的测定
根据Yao等[6]提出的蛋白质乳化性的测定方法,并稍作修改:分别取0.1 mL处理前后的蛋清液加入到50 mL去离子水中,混匀,按照体积比1∶3向蛋白液中加入花生油,最终制成180 mL的混合液,用高速分散器以10 000 r/min的转速分散1 min,从底部抽取样品液50 μL,并按体积比1∶100稀释到质量浓度0.1%的SDS溶液中,并测其在500 nm下的吸光值A0。测定乳化性后的乳液在80℃水浴加热30 min,冷却至室温,摇匀,记录其在500 nm下的吸光值A1,乳化性(EC)与乳化稳定性(ES)计算:
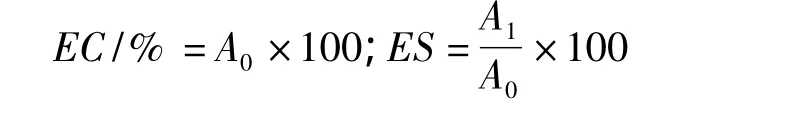
1.2.7 表面疏水性测定
采用8-苯胺基-1-萘磺酸(ANS)作荧光探针。其中ANS溶液是采用10 mmol/L pH 7.2的磷酸盐缓冲溶液配制成浓度为8 mmol/L的溶液。将样品用10 mmol/L pH 7.2的磷酸盐缓冲溶液分别稀释至蛋白质量浓度在0.10~0.50 mg/mL。采用RF-5301PC荧光分光光度计,在390 nm的激发波长下测定样品的荧光强度(FI0),在470 nm的发射波长下测定样品加入10 μL ANS溶液后的荧光强度(FI1),FI1和 FI0的差值记为FI,以蛋白质浓度为横坐标,FI为纵坐标作图,曲线初始阶段的斜率即为蛋白质分子的表面疏水性指数,记为S0。
1.2.8 凝胶结构扫描电镜(SEM)观察
参考赵伟[4]使用的蛋清凝胶结构扫描电镜观察,将一定量处理前后的蛋清液放入50 mL烧杯中,85℃水浴加热30 min后迅速放入冰水浴中冷却,在4℃下放置24 h,取出陈化30 min,从凝胶不同部分切3~5 mm的小立方体,在常温下用3%的戊二醛磷酸盐缓冲液(0.05 mol/L,pH 7.0)固定2 h。用冷缓冲液漂洗3次,每次20 min。接着在4℃下用1%的四氧化锇的磷酸盐缓冲液进行再次固定1.5 h,用缓冲液漂洗3次,每次20 min。分别采用体积分数30%,50%,70%,95%乙醇溶液梯度脱水,最后用无水乙醇漂洗3次,醋酸异戊酯过渡。之后样品用临界点干燥仪干燥,以离子溅射仪喷金,最后用JSM-6510LV扫描电子显微镜进行观测。
2 结果与分析
2.1 三种杀菌方式对蛋清蛋白溶解性的影响
蛋清蛋白的溶解性是蛋清蛋白重要功能性质之一,直接影响蛋清的其它功能特性,如起泡、乳化和增稠作用。蛋白质的溶解度是在蛋白质-蛋白质和蛋白质-溶剂相互作用之间热力学平衡的结果。
如图1所示,经PEF处理使蛋清蛋白的溶解度降低了5%左右,经DPCD处理过的蛋清蛋白溶解度降低了30%,而热处理能使蛋清蛋白的溶解度大幅增加,与新鲜蛋清液相比,经热处理过的蛋清蛋白溶解度提高了45%。Zhao等[7]研究发现,PEF处理会引起蛋清蛋白溶解度的下降,而且下降幅度受电场强度和时间的影响,PEF处理800 μs后蛋清蛋白的溶解度下降了6%,本研究结论与其相符。

图1 DPCD、PEF以及热处理对蛋清蛋白溶解度的影响Fig.1 Effect of DPCD,PEF and heat treatment on the solubility of egg white protein
2.2 三种杀菌方式对蛋清蛋白起泡性能的影响
空气随着蛋清的搅打而进入蛋液形成泡沫,随着泡沫数目的增多,气泡逐渐变小,直到最后失去流动性,然后加热使之固定,蛋清的这种特性在很多食品如奶油蛋糕中得到应用。
如图2所示,经热处理后蛋清蛋白的起泡性明显降低。PEF处理使蛋清液的起泡性和泡沫稳定性分别提高了12%和44%,主要是由于在低电场强度的作用下蛋清蛋白结构受到轻微改变,致使蛋白结构展开,因此有利于其发挥起泡性能[8-9]。DPCD处理使蛋白结构改变剧烈,蛋白质分子展开后相互作用,形成聚集体,最终导致不溶性蛋白质沉淀,蛋白质溶解度降低,致使起泡性大幅降低。
2.3 三种杀菌方式对蛋清蛋白乳化性能的影响
蛋白质具有乳化性是因为蛋白质具有两亲结构,分子中同时含有亲油性基团和亲水性基团。在油水混合液中,蛋白质有扩散到油-水界面的趋势,并且使疏水部位展开朝向脂质,极性部分朝向水相,蛋白质分子聚集于油-水界面,表面张力下降,促进脂肪和水形成油-水乳化液。而后,乳化的油滴被聚集在其表面的蛋白质所稳定,形成一种保护层,该保护层可以防止油滴的聚积和乳化状态的破坏,这就是通常所说的蛋白质的乳化性[10]。

图2 DPCD、PEF以及热处理对蛋清液起泡性能的影响Fig.2 Effect of DPCD,PEF and heat treatment on the forming properties of egg white liquid
根据图3所示,经DPCD处理后,蛋清蛋白的乳化性大大降低,PEF处理后蛋清液的乳化性提高了40%,而热处理则使蛋清液的乳化性降低了7%,主要是因为2种处理方式造成的蛋清蛋白变性程度不同。蛋白质轻微变性时,可使蛋白质分子结构舒展而又不会使其溶解度降低太多,疏水基团外露致使蛋白质分子的表面疏水性增加,此时蛋白质的乳化能力增强;当蛋白质变性程度增大,舒展的蛋白质分子通过疏水作用和二硫键的交互作用形成大的蛋白质聚集体,甚至形成沉淀,此时蛋白质的乳化能力降低。

图3 DPCD、PEF以及热处理对蛋清液乳化性能的影响Fig.3 Effect of DPCD,PEF and heat treatment on the emulsifying properties of egg white liquid
2.4 三种杀菌方式对蛋清蛋白表面疏水性的影响
疏水相互作用对蛋白质的功能性质及其结构的稳定具有重要的作用,是维持蛋白质三级结构的主要作用力。疏水性的氨基酸残基一般位于蛋白质分子内部,当蛋白质分子受到较强的外部作用力时如高温、高压,蛋白质结构舒展,致使疏水基团外露。因此,可以用蛋白质的表面疏水特性评价蛋白质结构的改变[11]。对蛋清液分别进行DPCD、PEF及热处理后应用ANS荧光探针法测定蛋白质的表面疏水性,ANS荧光探针法是评价蛋白质表面疏水性的一种经典方法,可以在一定程度上反映出水溶液中蛋白质的三级结构。ANS与芳香族氨基酸在390 nm激发波长下结合,并在470 nm处有最大吸收,且荧光强度与蛋白的表面疏水性成正相关[12]。
图4为3种处理作用对蛋清蛋白表面疏水性的影响。由图4可以得出,这3种处理方式均能使得蛋清蛋白的表面疏水性有不同程度的增强,其中热处理对其影响最大,使疏水性跟对照相比增加近1倍。这一结果表明,这3种处理使蛋清蛋白的结构发生改变,导致疏水基团外露,因此处理后的蛋白质分子表面疏水性增强。当外露的疏水基团增加到一定程度时,蛋白质分子间发生疏水相互作用,发生“疏水塌陷”,由此蛋白质表面疏水性下降,从而形成蛋白质聚集[4]。
2.5 三种杀菌方式对蛋清液凝胶结构的影响

图4 DPCD、PEF和热处理分别作用对蛋清蛋白表面疏水性的影响Fig.4 Effect of DPCD,PEF and heat treatment on surface hydrophobicity of egg white protein
图5显示了4组蛋清蛋白凝胶扫描电镜对比图,未经处理的蛋清蛋白(图5A)凝胶结构致密、空隙小,分布均匀。DPCD处理(图5B)的蛋清蛋白凝胶结构变化最为显著,与原蛋清蛋白凝胶结构相比,经DPCD处理后,凝胶结构变成稀疏多孔的颗粒状态,有一定的团簇状态,说明DPCD处理对蛋白凝胶结构影响显著。PEF处理后,蛋清蛋白凝胶结构变得粗糙和无序,说明PEF处理对蛋清蛋白凝胶结构有一定影响(图5C)。热处理(图5D)的蛋清蛋白凝胶结构变化明显,变得更加致密疏松,600倍扫描电镜下观察,有不均匀的空穴,这主要是因为蛋清蛋白经热处理后产生了较大程度聚集,大粒径的颗粒增多后发生交联,形成了致密的凝胶结构。
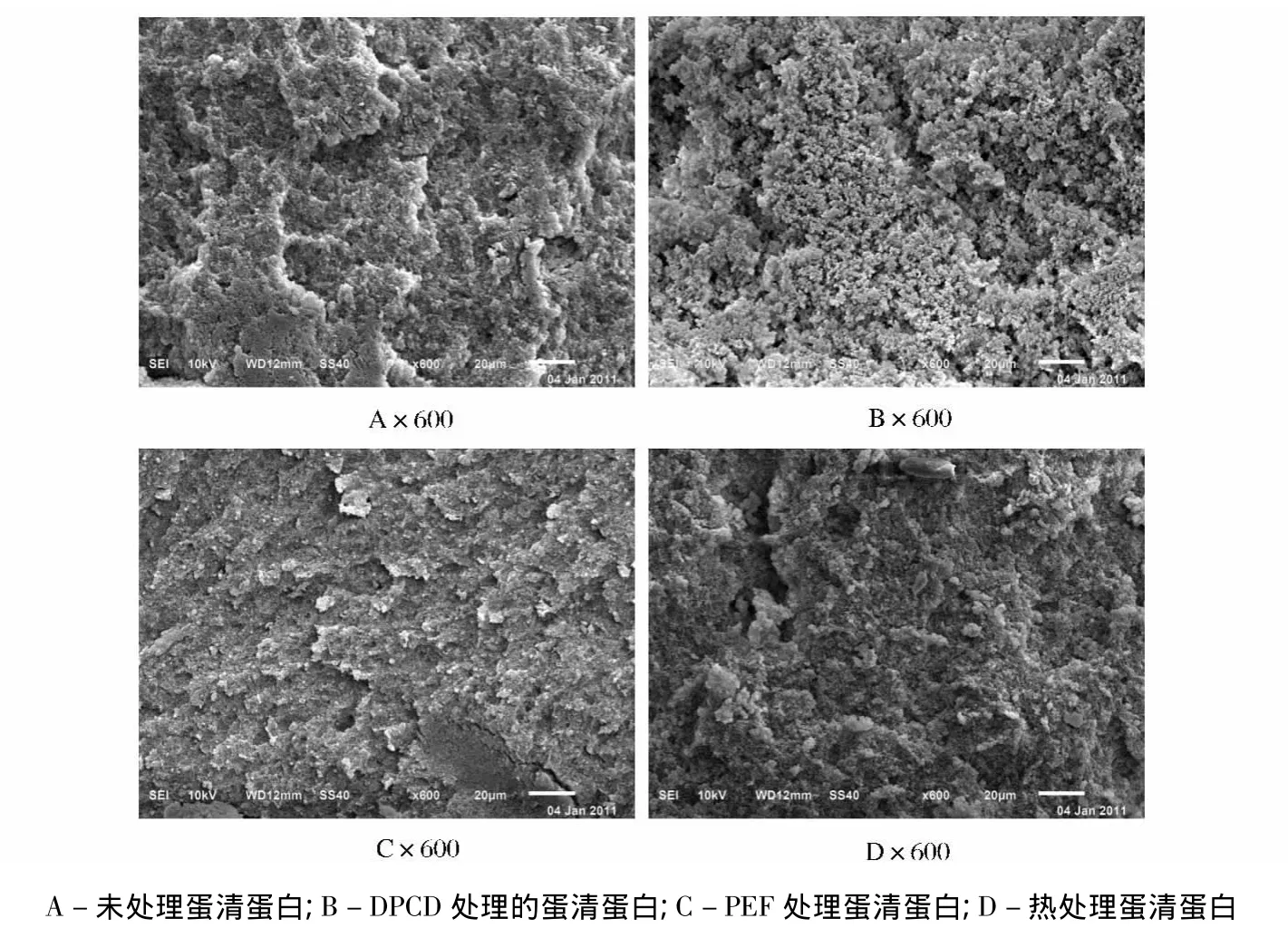
图5 DPCD、PEF和热处理蛋清蛋白凝胶结构SEM图Fig.5 SEM micrographs of gels from egg white treated by DPCD,PEF and heat treatment
3 结论
本文研究了经DPCD、PEF和热处理对蛋清蛋白的溶解性、起泡性、乳化性等功能性质以及结构特征的影响,结果表明:DPCD处理使蛋清蛋白的溶解度降低了30%,使其起泡性及泡沫稳定性、乳化性及乳化稳定性大幅降低;PEF处理使蛋清蛋白的溶解度降低了5%左右,提高蛋清液的起泡性和泡沫稳定性分别为12%和44%,使蛋清液的乳化性提高了40%;热处理使得蛋清蛋白溶解度提高了45%,但蛋清蛋白的起泡性明显降低。蛋清液分别经DPCD、PEF和热处理后,蛋清蛋白的结构发生改变,蛋白质部分变性,导致疏水基团外露,表面疏水性有不同程度的增强,其中热处理对其影响最大。热处理发生的蛋白聚集程度要大于DPCD处理对蛋清蛋白的影响,PEF处理对蛋清蛋白的影响最轻微。因此,综合以上结果,PEF处理的综合效果要好于其他2种处理。
[1] Yeom HW.Enzymatic inactivation by pulsed electric fields:A review,pulsed electric fields in food processing[M].Lancaster,PA:Technomic Publishing,2001:6-12.
[2] 汪家政,范明.蛋白质技术手册[M].北京:科学技术出版社,2000:1-12.
[3] 李小勇.猪肺中胶原蛋白的提取及理化特性研究[D].重庆:西南大学,2009:7-22.
[4] 赵伟.高压脉冲电场在液态蛋杀菌中的应用及其对微生物和蛋白质的作用机制[D].无锡:江南大学,2009:5-31.
[5] Sathe S K,Salunkhe D K.Functional properties of the great northern bean proteins:Emulsion,foaming,viscosity and gelation properties[J].Journal of Food Science,1981,46(1):71-81.
[6] Yao J J,Tanteeratarm K,Wei L S.Effect of maturation and storage onsolubility,emulsion stability and gelation properties of isolated soy protein[J].American Oil Chemists'Society,1990,67(12):974-979.
[7] Zhao W,Yang R,Tang Y,et al.Investigation of the protein-protein aggregation of egg white proteins under pulsed electric field[J].Journal of Agricultural and Food Chemistry,2009,57(9):3 571-3 577.
[8] 张铁华,殷涌光,刘静波.高压脉冲电场(PEF)对蛋清蛋白功能特性的影响[J].食品科学,2007,28(09):98-102.
[9] Li Y,Chen Z,Mo H.Effects of pulsed electric fields on physicochemical properties of soybean protein isolate[J].LWT-Food Science and Technology,2007,40(7):1 167-1 175.
[10] 刘超.蛋清蛋白的改性及其起泡特性研究[D].武昌:湖北工业大学,2008:25-36.
[11] Chiti F,Webster P,Taddei N,et al.Designing conditions for in vitro formation of amyloid protofilaments and fibrils[J].The Proceedings of the National Academy of Sciences USA,1999,96(7):3 590-3 594.
[12] Alizadeh-Pasdar N,Li-Chan ECY.Comparison of protein surface hydrophobicity measured at various pH values using three different fluorescent probes[J].Journal of Agricultural and Food Chemistry,2000,48(2):328-334.
