鞘氨醇单胞菌的3-苯氧基苯甲酸降解酶定位及分子质量确定*
2014-12-16李建龙王志龙刘书亮姚开邓维琴黄道梅赖海梅
李建龙,王志龙,刘书亮,姚开,邓维琴,黄道梅,赖海梅
1(四川农业大学食品学院,四川 雅安,625014)
2(四川大学轻纺与食品学院,四川成都,610065)
拟除虫菊酯类农药具有高效、低毒、选择性好等优点,已在全世界范围内被广泛使用。该类农药对光、热具有稳定性,自然条件下难迅速降解[1-2],长期接触有致畸、致癌、致突变的危险[3-4]。3-PBA是大多数拟除虫菊酯类农药的分解产物之一[5-6],与拟除虫菊酯类农药相比,在环境中的迁移速率更快,在土壤中的半衰期长达180 d左右[7],远远长于大多数拟除虫菊酯杀虫剂约30 d的半衰期。3-PBA对微生物的生长具有一定的抑制作用,能阻止拟除虫菊酯类农药的彻底降解,从而使得该类农药难以被生物降解为无毒小分子[8],因此3-PBA对生态环境和人类健康的潜在危害性较菊酯类杀虫剂大[9]。微生物降解效率高、无二次污染,且可有效降低环境中的有毒污染物[10],但其降解效率可能低于其降解酶[11],且菌株产生的降解酶对环境条件的忍受范围比菌体宽[12],酶又是一类蛋白质,安全性比微生物更高[13]。Chen等分离到多株可降解3-PBA的菌株,如Ochrobactrum lupini[14]、Streptomyces aureus[15]、Bacillus sp.[16]、Stenotrophomonas sp.[17],并研究了降解菌株的降解特性及降解途径等,但未进行3-PBA降解酶研究;许育新等[18]分离到1 株Pseudomonas sp.PBM11 菌株,24h可完全降解200 mg/L的3-PBA,并提取PBM11菌株的质粒,推断3-PBA降解酶基因可能位于质粒上;邱吉国等[19]分离到1株可降解乙羧氟草醚的菌株(Pseudomonas sp.),乙羧氟草醚和3-苯氧基苯甲酸都含有二苯醚键结构,实验中检测到菌株细胞内邻苯二酚1,2-双加氧酶对乙羧氟草醚有活性,推断乙羧氟草醚降解途径是先醚键断裂然后脱去苯环上的侧链,最终通过邻苯二酚1,2-双加氧酶裂解开环。
本文针对1株可高效降解3-PBA的鞘氨醇单胞菌SC-1(在MM培养基中,30℃,16 h可将300 μg/mL 3-PBA完全降解),研究其产3-苯氧基苯甲酸(3-PBA)降解酶的细胞定位,并对该降解酶进行Native-PAGE和SDS-PAGE电泳,初步确定酶的分子质量,为深入研究3-PBA降解酶提供基础数据。
1 材料与方法
1.1 材料
1.1.1 菌株
鞘氨醇单胞菌(Sphingomonas sp.)SC-1,由四川农业大学食品微生物实验室分离保藏,可高效降解3-PBA(在MM培养基中,30℃,16 h可将300 μg/mL 3-PBA完全降解)。
1.1.2 培养基
LB固体培养基:酵母膏5 g;蛋白胨10 g;NaCl 10 g;琼脂2 g;水1 000 mL;调pH值至7.0;加入3-PBA至终浓度 100 μg/mL。
LB液体培养基作为发酵种子培养基。
MM培养基:(NH4)2SO41.5 g;MgSO40.2 g;NaCl 0.5 g;KH2PO40.5 g;K2HPO41.5 g;蒸馏水1 000 mL;pH 7.5,3-PBA 浓度为 100 μg/mL。
发酵培养基:(NH4)2SO41.5 g;MgSO40.5 g;NaCl 0.5 g;KH2PO40.5g;K2HPO41.5 g;葡萄糖5.0 g;酵母浸出粉5.0 g;水1 000 mL;调节pH值至7.0;加入3-PBA 至 100 μg/mL。
以上培养基均121℃灭菌15 min。
1.1.3 药品及试剂
3-苯氧基苯甲酸(98%),Sigma公司;检测用乙腈(色谱纯),德国CNW Technologies GmbH公司;丙烯酰胺,成都溶海公司;甲叉双丙烯酰胺,Sigma公司;SDS,美国Amresco公司;TEMED(进口分装);过硫酸铵,上海诺伦生物医药技术有限公司;考马斯亮蓝R-250,天根生化科技(北京)有限公司;蛋白质分子质量标准(低),天根生化科技(北京)有限公司;溴酚蓝,天津市巴斯夫化工有限公司。
PBS缓冲液:用 KH2PO4及 K2HPO4配制 0.02 mol/L、pH 7.0的磷酸盐缓冲液。
PBS底物缓冲液:将3-PBA充分溶于0.02 mol/L、pH 7.0的PBS缓冲溶液中,分别制成5 μg/mL及20 μg/mL的PBS底物缓冲溶液。
其他化学试剂均为进口或国产分析纯。
1.1.4 主要仪器设备
UV-3200紫外可见分光光度计,上海美谱达仪器有限公司;RZ-10L发酵罐,南京瑞泽生物工程设备有限公司;LC-10A2010C HT型液相色谱仪(配有可变波长紫外检测器,LC-solution工作站),日本Shimazu公司;Gel Doc XR凝胶成像仪,BIO-RAD公司;Milli-Q Gradient超纯水系统,Millipore公司;Scientz-ⅡD超声波细胞破碎仪,宁波新芝生物科技股份有限公司;DSHZ-300水浴恒温多用途摇床培养箱,江苏太仓市实验设备厂。
1.2 实验方法
1.2.1 3-PBA降解酶的细胞定位
1.2.1.1 发酵液的制备
从平板上挑取SC-1单菌落,划线于LB斜面培养基上,30℃恒温培养24 h。用无菌生理盐水将SC-1菌苔从斜面培养基上洗脱并混匀制成菌悬液,接种1.0 mL SC-1菌悬液(菌浓度约为108CFU/mL)于30 mL发酵培养基中,30℃,180 r/min恒温摇振培养24 h得种子液,将种子液按3%接种至发酵罐,发酵罐装料系数0.65,接种量6.25%,起始pH 7.0,发酵温度30℃,转速控制在300 r/min,发酵罐压维持在0.04~0.05 MPa,产泡较多时加少量无菌消泡油进行消泡。发酵培养24 h,得到SC-1发酵混合液。
发酵结束后将SC-1发酵混合液冷冻离心(4℃,10 000 r/min,10 min),离心分别收集上清液及菌体沉淀,菌体沉淀用0.02 mol/L PBS缓冲液悬浮清洗2次后于-20℃低温保存备用。
1.2.1.2 3-PBA降解酶初步定位
胞外酶液:在冰水浴下,向500 mL的SC-1发酵上清液中缓慢加入烘干研细的(NH4)2SO4粉末,并同时利用磁力搅拌器进行搅匀,使(NH4)2SO4饱和度逐渐达到100%,4℃盐析过夜。低温冷冻离心(4℃,10 000 r/min,10 min)收集盐析液中蛋白沉淀,用0.02 mol/L PBS缓冲液溶解蛋白沉淀,并于4℃条件下透析(透析袋截留系数MWCO=14 000)直至氯化钡溶液检测透析液中无SO42-,4 ℃条件下用聚乙二醇20000浓缩酶液至1 mL。
胞内粗酶液和菌体细胞碎片液:将SC-1菌体室温解冻,称取1.0 g湿菌体,按1 g菌体+4 mL PBS缓冲液的比例重悬,冰浴中超声破碎(功率290 W,工作1 s,间歇3 s)菌悬液1 200 s,4 ℃10 000 r/min离心10 min,上清液为SC-1胞内粗酶液。沉淀用PBS缓冲液重悬离心清洗2次,再向沉淀中加入4 mL PBS缓冲液重悬,即细胞碎片液。
降解酶活力测定:取0.5 mL的20 μg/mL PBS底物缓冲液与0.4 mL PBS缓冲溶液混匀,30℃保温10 min后加入粗酶液0.1 mL,水浴摇振反应10 min,1 mL乙腈终止反应。以加入酶液后立即用乙腈终止反应的样品为空白对照,HPLC检测反应体系中3-PBA残留量。
1.2.1.3 3-PBA 的检测方法[8]
样品处理:色谱纯乙腈终止体系反应并定容至10 mL,混匀后10 000 r/min离心10 min,取上清液过有机相滤膜,弃去初滤液,取续滤液用于 HPLC检测[8]。
HPLC检测条件:色谱柱:Gemini 100Å C18柱(5.0 μm,150 mm ×4.60 mm,i.d.),流动相为 V(乙腈)∶V(磷酸水)=55∶45,磷酸水 pH=2.5,流速为0.7 mL/min,进样量为10 μL,检测波长为210 nm,柱温 25 ℃[8]。
3-苯氧基苯甲酸降解酶的酶活力定义:在本实验条件下,1.0 min内使3-PBA减少1.0 nmol所需要的酶量为1个酶活力单位(U)。
3-PBA残留量(μg/mL)计算:
式中:Cx,3-PBA残留量;C0,样品中3-PBA初始浓度;Sx,样品中残留3-PBA的峰面积;S0,样品中初始3-PBA的峰面积。
1.2.1.4 细胞膜片段的分离
将重悬后的细胞碎片液于冰水浴中超声破碎(功率290 W,工作1 s,间歇3 s)1 200 s。向10 mL透明离心管中加入1 mL 37%蔗糖溶液,再用注射器缓慢向37%蔗糖溶液底部注入3 mL 41%蔗糖溶液,使之形成清晰的蔗糖梯度浓度界面。取0.4 mL破碎细胞碎片液沿管壁缓慢旋转加入至蔗糖溶液表面,4℃离心(12 000 r/min,20 min),收集蔗糖梯度界面层雾状细胞膜[20]。4℃透析除去雾状细胞膜中的高浓度蔗糖溶液,4℃条件下用聚乙二醇20000浓缩至少量细胞膜悬浮液。收集蔗糖密度梯度离心的细胞碎片,用PBS缓冲液清洗离心2次,再恢复细胞碎片至蔗糖密度梯度离心前原体积。
分别向0.5 mL细胞膜浓缩液和0.1 mL细胞碎片悬液中加入0.5 mL 5 μg/mL PBS缓冲液,补足反应体系至1.0 mL,30℃水浴、摇振反应2 h后,1 mL乙腈终止反应。以加入PBS底物缓冲液后立即用乙腈终止反应的样品为空白对照,HPLC检测反应体系中3-PBA残留量。
1.2.2 3-PBA降解酶分子质量的初步确定
1.2.2.1 Native-PAGE分离膜蛋白及切胶回收作3-PBA降解反应
将密度梯度离心所得的细胞膜片段悬浮液置于冰水浴中超声破碎 (功率50 W,工作1 s,间歇3 s)2 400 s,破碎后置于透析袋(透析袋截留系数MWCO=14 000)中,于4℃用聚乙二醇20000浓缩至少量膜片段悬液。
取Native-PAGE样品缓冲液50 μL与膜片段悬液样品200 μL混合,不经离心取样品混合液直接上样。恒定电压90 V电泳至样品进入分离胶,提高电压至120 V电泳,待溴酚蓝接近胶边缘0.5 cm处,电泳结束,取一块凝胶用蛋白染色液进行染色1 h,脱色液脱色,直至出现清晰条带;另一块凝胶用Native-PAGE电泳缓冲液浸泡,4℃暂存。
凝胶配方参见《蛋白质纯化技术及应用》[21](表1)。
取另一块Native-PAGE凝胶,比对蛋白染色后的凝胶分别对电泳条带进行切胶回收。取相同重量的聚丙烯酰胺凝胶分别研碎,加入0.5 mL 5 μg/mL PBS底物缓冲液及3.0 mL PBS缓冲液,30℃水浴摇振反应24 h,以加入蛋白染色无条带的凝胶反应体系为空白对照。色谱纯乙腈终止反应并定容至10 mL体系,HPLC检测反应体系中3-PBA残留量。
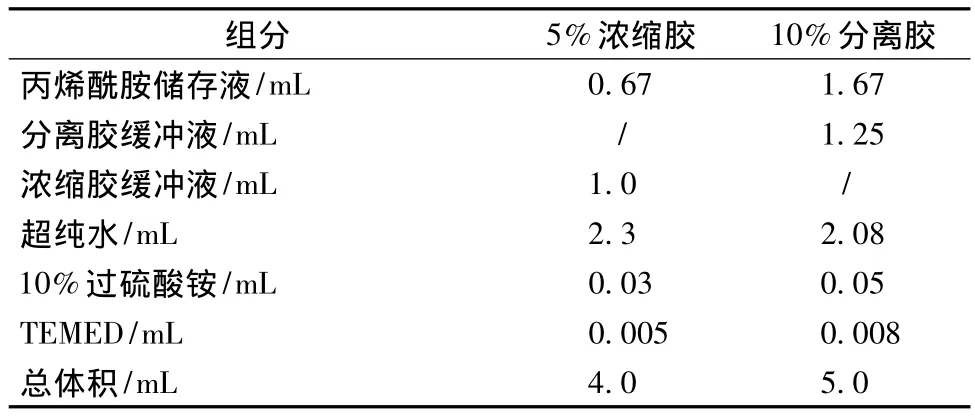
表1 Native-PAGE凝胶配方Table 1 Gel composition of Native-PAGE gel
1.2.2.2 3-PBA降解酶SDS-PAGE
切胶回收作3-PBA降解反应时,有3-PBA降解活性的蛋白条带,将此条带凝胶切成小块,完全浸没于含SDS-PAGE电泳缓冲溶液的透析袋中,于水平电泳槽上对凝胶中的蛋白进行电泳洗脱(电压200 v,洗脱时间8 h)。离心电泳洗脱液得上清液,于4℃条件下用聚乙二醇20000浓缩至少量,取SDS-PAGE样品缓冲液50 μL与浓缩后样品200 μL混合,沸水浴5 min,10,000 r/min 离心 5 min,直接取样品混合上清液上样,电泳及染色同Native-PAGE。
SDS-PAGE凝胶制备参见《蛋白质纯化技术及应用》[21](表 2)。

表2 SDS-PAGE凝胶配方Table 2 Gel composition of SDS-PAGE gel
2 结果与分析
2.1 3-PBA降解酶的细胞定位
鞘氨醇单胞菌SC-1细胞不同部位3-PBA降解酶活性如图1所示。可以看出,活细胞菌悬液的3-PBA降解酶活性最高,胞外粗酶液、胞内粗酶液及细胞碎片粗酶液均有3-PBA降解酶活性,但3-PBA降解酶活性主要集中于细胞碎片中,胞外粗酶液及胞内粗酶液的活性较低,这可能与粗酶液制备时的菌体细胞及碎片残留于胞外、胞内粗酶液有关。
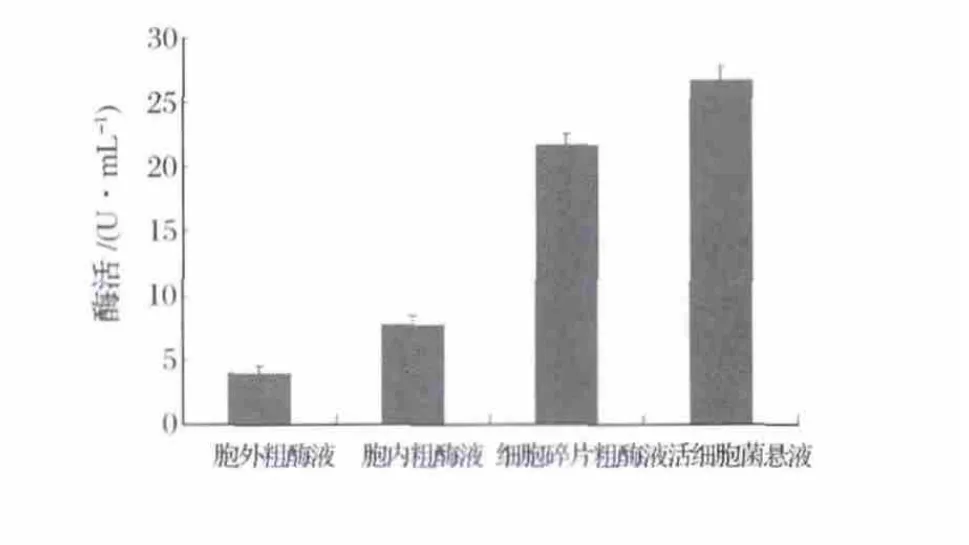
图1 菌株SC-1细胞不同部位3-PBA降解酶活性Fig.1 Activity of 3-PBA-degrading enzymes from different parts of SC-1
鞘氨醇单胞菌SC-1细胞膜降解3-PBA的HPLC色谱图如图 2 所示,1#、2#、3#、4#、5#为非目标峰(培养基杂质峰或细菌代谢产物峰),6#为目标峰(3-PBA),出峰时间为7.21 min。SC-1细胞碎片再次破碎并经蔗糖密度梯度离心等多步处理后,其分离得到的细胞膜对3-PBA仍有一定的降解酶活性,且有疑似降解产物苯酚的生成[8],说明在鞘氨醇单胞菌SC-1中3-PBA降解酶位于细胞膜上。而细胞碎片悬液对3-PBA降解率高于细胞膜悬液可能是:(1)超声处理虽然能使部分细胞膜从碎片上剥离下来,但细胞碎片上仍吸附有细胞膜;(2)虽经过超声波细胞破碎,但由于未能完全破碎菌体,因此细胞碎片中仍有完整的活细胞;(3)将细胞膜剥离后其稳定性降低。

图2 鞘氨醇单胞菌SC-1细胞膜降解3-PBA的HPLC色谱图Fig.2 The chromatogram of degrading 3-PBA by the cytomembrane of Sphingomanas sp.SC-1
2.2 鞘氨醇单胞菌SC-1中3-PBA降解酶的分离
将蔗糖密度梯度离心后得到的细胞膜再次破碎浓缩,并对其进行Native-PAGE电泳后染色(图3),针对染色后的主要条带将未染色凝胶进行切胶回收,破碎后的细胞膜电泳时出现多条蛋白条带。
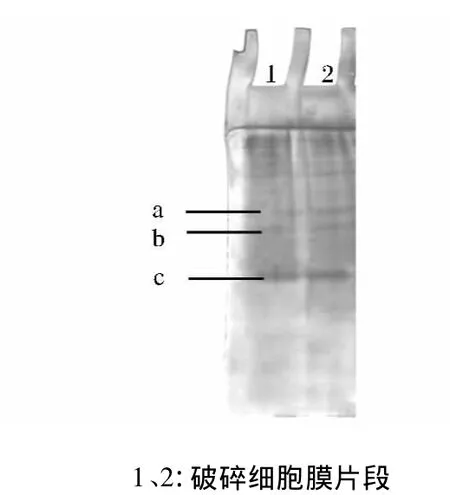
图3 鞘氨醇单胞菌SC-1细胞膜Native-PAGE图Fig.3 The Native-PAGE diagram of the cytomembrane of Sphingomanas sp.SC-1
Dehmel等[22]得出蛋白质在Native-PAGE中的迁移率主要取决于它所带电荷及分子大小,因此对分离胶中疑似降解酶的条带a、b及c进行切胶回收和3-PBA降解反应。回收蛋白条带降解3-PBA的HPLC色谱图如图4所示,7#、8#、9#为非目标峰(杂质峰),10#为目标峰(3-PBA),出峰时间为7.21 min,条带a及条带b未检测有3-PBA降解活性,条带c在24 h内对0.5 mL、5 μg/mL 3-PBA的降解率为22.23%,仍具有一定的降解活性,见图4。

图4 回收蛋白条带降解3-PBA的HPLC色谱图Fig.4 The chromatogram of degrading 3-PBA by the protein recovered
对Native-PAGE凝胶中的条带c进行切胶回收,条带c经电泳洗脱浓缩后与细胞膜破碎液一同进行SDS-PAGE,结果见图5。条带c在SDS-PAGE上出现2条条带,其分子质量约为50~90 ku,推测鞘氨醇单胞菌SC-1中3-PBA降解酶位于细胞膜上面,其可能是一类多亚基结构酶。
3 讨论与结论

图5 回收蛋白条带SDS-PAGE图Fig.5 SDS-PAGE diagram of degrading 3-PBA by the protein recovered
(1)根据3-PBA的化学结构推测,其降解酶可能是氧化酶中的一种。Shaohua等[16]检测菌株(Bacillus sp.)降解3-PBA的产物时,发现3-(2-羟基苯氧基)苯甲酸在初期大量积累,之后经过二芳基醚键的断裂生成原儿茶酸、苯酚等,由此推断菌株可产一种3-PBA氧化酶;Halden等[23]分离到1株产碱假单胞菌POB310,虽不能完全降解3-PBA,但能通过角双加氧酶的作用使二苯醚键断裂,生成苯酚和原儿茶酸。目前报道的大部分芳香族化合物氧化酶主要为胞内酶[24],也有部分位于细胞膜上,吴炬等[25]分离出的甲基单胞菌(Methylomonas sp.)具有较高的甲烷单加氧酶活性,且酶位于细胞膜上,可催化甲烷羟基化反应生成甲醇;在真核生物中氧化酶主要分布于光滑内质网上,也有部分位于细胞器的膜中[9],而原核生物没有细胞器,呼吸作用由细胞膜完成,其主要酶系也都分布于细胞膜上。这与本实验得出的鞘氨醇单胞菌SC-1中3-PBA降解酶是一类膜蛋白吻合。本文首次提出了鞘氨醇单胞菌3-PBA降解酶位于细胞膜上,为3-PBA降解酶的进一步研究提供了理论基础。
(2本实验采用超声波细胞破碎仪对分离得到的细胞膜进行处理,通过超声过程中的空穴作用使细胞膜进一步破裂成碎片,使膜蛋白与细胞膜分离,通过Native-PAGE发现,膜蛋白可得到较好的分离,并具有一定的活性。
(3)本文对Native-PAGE中有降解活性的条带c回收后进行SDS-PAGE分析,得到2条蛋白条带,条带蛋白所对应分子质量均较Dehmel等[22]从基因角度预测的分子质量大,约为50~90 ku。根据降解酶分子质量可初步推测出降解酶基因的大小,对3-PBA降解酶基因的研究及基因工程菌的构建具有指导意义,段晓芹等[26]分析了菌株 Sphingobium fanise JZ-2降解3-苯氧基苯甲酸的代谢产物,其中有邻苯二酚的生成,邻苯二酚在邻苯二酚1,2-双加氧酶作用下开环,根据邻苯二酚1,2-双加氧酶基因序列设计兼并引物,成功地从JZ-2基因组扩增出邻苯二酚1,2-双加氧酶基因(catA);Zhang等[27]从菌株 Ralstonia eutropha JMP134扩增出降解3-苯氧基苯甲酸的基因mbhDHIM,最终获得了可矿化3-苯氧基苯甲酸的工程菌。
(4)本文确定了鞘胺醇单胞菌的3-苯氧基苯甲酸降解酶的产生位于细胞膜上,该酶是一种膜蛋白,分子质量约为50~90 ku。
[1] 陈家长,吴伟,瞿建宏,等.溴氰菊酯胁迫下罗非鱼组织中过氧化氢酶和单胺氧化酶的变化[J].农业环境科学学报,2006,25(6):1 441-1 445.
[2] Helbling D E,Hollender J,Kohler H E,et al.Structurebased interpretation of biotransformation pathways of amidecontaining compounds in sludge-seeded bioreactors[J].Environmental.Science and Technology,2010,44(17):6 628-6 635.
[3] Nisha P,Meghna S,Surya T,et al.S100β upregulation:A possible mechanism of deltamethrin toxicity and motor coordination deficits[J].Neurotoxicology and Teratology,2009,31(3):169-176.
[4] Yang D F,Robin E P,Wang X L,et al.Human carboxylesterases HCEl and HCE2:Ontogenic expression,inter-individual variability and differential hydrolysis of oseltamivir,aspirin,deltamethrin and permethrin[J].Biochemical Pharmacology,2009,77(2):238-247.
[5] Jin M,Li L,Xu C,et al.Estrogenic activities of two synthetic pyrethroids and their metabolites[J].Journal of Environmental Sciences,2010,22(2):290-296.
[6] 李少南.农药对土壤生物群落的副作用的研究方法[J].生态毒力学报,2010,5(2):18-24.
[7] Yuan C,Wang C,Gao S Q,et al.Effects of permethrin,cypermethrin and 3-phenoxybenzoic acid on rat sperm motility in vitro evaluated with computer-assisted sperm analysis[J].Toxicology in Vitro,2010,24(2):382-386.
[8] 赵楠,刘书亮,赖文,等.HPLC-UV法测定微生物降解体系中3-苯氧基苯甲酸含量[J].食品科学,2011,32(14):181-184.
[9] Ji G X,Xia Y K,Gu A H,et al.Effects of non-occupational environmental exposure to pyrethroids on semen quality and sperm DNA integrity in Chinese men[J].Reproductive Toxicology,2011,31(2):171-176.
[10] 张锡辉.高等环境化学与微生物学原理及应用[M].北京:化学工业出版社,2001:50-70.
[11] 虞云龙,陈鹤鑫,樊德方,等.Alcaligenes sp.YF11菌对杀灭菊酯的降解机理[J].环境污染与防治,1998,6(20):5-7.
[12] Mccarthy A R,Thomson B M,Shaw I C,et al.Estrogenicity of pyrethroid insecticide metabolites[J].Journal of Environmental Monitoring,2006,8(1):197-202.
[13] 虞云龙,盛国英,傅家馍.杀灭菊酯的微生物降解及酶促降解[J].环境科学,1997,18(1):5-8.
[14] Chen S H,Hu M Y,Yang L,et al.Biodegradation of beta-cypermethrin and 3-phenoxybenzoic acid by a novel Ochrobactrum lupini DG-S-01[J].Journal of Hazardous Materials,2011,187(1-3):433-440.
[15] ChenS H,Geng P,Xiao Y,et al.Bioremediation of βcypermethrin and 3-phenoxybenz-aldehyde contaminated soils using Streptomyces aureus HP-S-01[J].Environmental Biotechnology,2012,94(2):505-515.
[16] Chen S H,Hu W,Xiao Y,et al.Degradation of 3-phenoxybenzoic acid by a Bacillus sp.[J].Plos One,2012,7(11):1-12.
[17] Chen S H,Yang L,Hu M Y,et al.Biodegradation of fenvalerate and 3-phenoxybenzoic acid by a novel Stenotrophomonas sp.strain ZS-S-01 and its use in bioremediation of contaminated soils[J].Environmental Biotechnology,2011,90(2):755-767.
[18] 许育新,李晓慧,秦华,等.3-苯氧基苯甲酸降解菌的分离及降解特性研究[J].微生物学通报,2005,32(5):62-66.
[19] 邱吉国,郑金伟,张隽,等.乙羧氟草醚降解菌Pseudomonas sp.YF1的分离、鉴定与降解特性[J].应用与环境生物学报,2009,15(5):686~691.
[20] Pattana P,Khanok R,Khin L K.Isolation and properties of cellulosome-type multienzyme complex of the thermophilic Bacteroides sp.strain P-1[J].Enzyme and Microbial Technology,2000,26(5-6):459-465.
[21] 陆健.蛋白质纯化技术及应用[M].北京:化学工业出版社,2005:181-202.
[22] Dehmel U,Engesser K H,Timmis K N,et al.Cloning,nucleotide sequence,and expression of the gene encoding a novel dioxygenase involved in metabolism of carboxydiphenyl ethers in Pseudomonas pseudomas pseudoalcaligenes POB310[J].Archives of Microbiology,1995,163(1):35-41.
[23] Halden R U,Tepp S M,Halden B G,et al.Degradation of 3-phenoxybenzoic acid in soil by Pseudomonas pseudoalcaligenes POB310(pPOB)and two modified Pseudomonas strains[J].Applied and Environmental Microbiology,1999,65(8):3 354-3 359.
[24] 邱凌峰,吴芳芳,姚尧.苯酚降解菌TXl的分离鉴定及其降解特性[J].上海环境科学,2010,29(1):35-40.
[25] 吴炬,李永泉,冯建军,等.甲基单胞菌Methylomonas sp.GYJ3的生长特性及产甲烷单加氧酶特性[J].兰州大学学报,2002,38(6):72-77.
[26] 段晓芹,郑金伟,张隽,等.3-PBA降解菌BA3的降解特性及基因工程菌构建[J].环境科学,2011,32(1):240-246.
[27] Zhang J,Zheng J W,Liang B,et al.Biodegradation of chloroacetamide herbicides by Paracoccus sp.FLY-8 in vitro[J].Journal of Agricultural Food Chemistry,2011,59(9):4 614-4 621.
