肿瘤相关低磷性骨软化症1例并文献复习
2014-12-16张自琴崔爱民北京积水潭医院普外科北京100035
谭 屾,柏 楠,张自琴,崔爱民(北京积水潭医院普外科,北京 100035)
低血磷性骨软化症(hypophosphatemic osteomalacia,HO)(以往称为低磷维生素D-抵抗性软骨病)是由于低磷血症和活性维生素D产生不足造成的,以骨骼矿化不良、骨软化或佝偻病为主要特征的一组疾病,发病率约1∶25 000。分为:X连锁显性低磷性骨软化症(X-linked hypophosphatemic rickets,XLH)、常染色体显性遗传低磷性骨软化症(autosomal dominant hypophosphatemic rickets,ADHR)和肿瘤相关低磷性骨软化症(tumor-induced osteomalacia,TIO)3种类型[1]。本文报道1例TIO如下。
1 病例资料
患者,女,61岁,因“全身骨痛5年,加重伴乏力1年”入院。5年前无明显诱因出现双足、双髋、胸廓及腰部疼痛,因胸部疼痛不敢深呼吸及咳嗽,四肢酸冷、麻木,晨起加重,活动后减轻,晨僵约数分钟,关节活动明显受限,行走困难,夜间翻身困难。近1年自觉症状逐渐加重,伴全身乏力。就诊于当地医院,诊断为“重度骨质疏松”,予以止痛、补钙治疗,自觉症状无明显减轻。查体:跛行。胸廓挤压征阳性,腰椎重度活动受限,腰椎体叩痛阳性。双侧大腿外型正常,左大腿下端内侧深部可及一约2 cm×1 cm椭圆形质软肿物,边界不清,固定,无压痛。门诊辅助检查:血、尿常规及肝、肾功能均正常;血磷0.43 mmol/L(正常参考值0.81-1.65 mmol/L),血钙2.23 mmol/L(正常参考值 2.20-2.55 mmol/L),碱性磷酸酶(ALP)280 U/L(正常参考值40-150 U/L);血25-羟基维生素D3(25-(OH)VD3)48.77 ng/ml(正常参考值20.00-40.00 ng/ml);全段甲状旁腺激素(PTH)54.3 pg/ml(正常参考值 15.0-65.0 pg/ml);尿磷4.98 mmol/24 h,尿钙0.81 mmol/24 h。B 超示:左侧大腿肌间可见一实性低回声肿物,大小约2.2 cm ×1.6 cm ×1.8 cm,边界清,回声欠均匀,后方回声稍增强。可见少量血流信号自边缘进入边缘内部。左股骨MRI示:左大腿肌间肿物(图1)。奥曲肽显像示:左侧大腿内侧肌间隙内生长抑素受体高表达病变,考虑TIO可能性大。入院诊断为:成人低磷性骨软化症,左大腿软组织肿物性质待查,重度骨质疏松。行左大腿深层软组织肿物切除术。病理报告:瘤组织呈结节状结构,为疏密不均的单一性短梭形细胞,细胞有轻度非典型性,瘤组织内可见较丰富的玻璃样变性的厚壁血管及血管外周细胞瘤样结构。结合免疫组化结果,为胸膜外孤立性纤维瘤性肿瘤(交界性)(见图2)。术前AKP 231 IU/L;血钙2.30 mmol/L;血磷 0.59 mmol/L。切除肿物 30 min AKP 264 IU/L;血钙 2.39 mmol/L;血磷 0.65 mmol/L。术后第1天 AKP 226 IU/L;血钙2.29 mmol/L;血磷0.85 mmol/L。术后第4天 AKP 232 IU/L;血钙 2.24 mmol/L;血磷 1.11 mmol/L。出院诊断:成人肿瘤相关低磷性骨软化症,左大腿胸膜外孤立性纤维瘤性肿瘤(交界性),重度骨质疏松。出院后继续给予钙剂以及活性维生素D治疗。术后1个月随访,全身骨痛及乏力显著缓解。
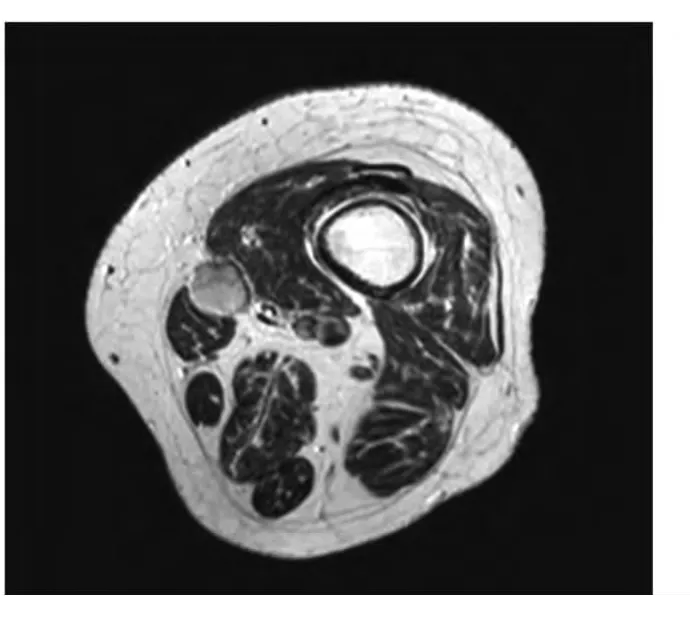
图1 左股骨MRI示:左大腿肌间肿物

图2 左大腿深层软组织肿物免疫组化 (HE,×100)
2 讨论
低磷性骨软化症是一种少见的骨代谢疾病,以低血磷、高尿磷、低1,25(OH)2D3水平、骨骼矿化障碍为其特点。临床上常表现为逐渐加重的骨骼疼痛、畸形、活动受限、身材缩短、肌无力。生化检查常表现为低血磷、高尿磷,碱性磷酸酶升高,1,25(OH)2D3降低或正常,血钙水平多正常。骨密度扫描多表现为中重度骨质疏松。TIO是一种少见的副瘤综合征,最早被报道于1947年[2]。它的相关肿瘤多发生于四肢,其次为头颈颌面部。这些肿瘤既可附着于骨骼表面,又可位于软组织浅层。CT和MRI等影像学检查可发现相关肿瘤,肿瘤切除后临床症状和生化检查可在短期内显著改善。TIO肿瘤良性居多,体积小,生长缓慢。恶性仅占10%左右;肿瘤以间叶组织来源多见,病理类型多,其中血管瘤或血管内皮细胞瘤占总数的50%以上,其次为纤维瘤或纤维肉瘤[3]。
本病的发病机制尚未完全明确。目前认为与成纤维细胞生长因子-23(fibroblast growth factor 23,FGF-23)在肿瘤组织中过度释放有关[4,5]。FGF-23主要通过调节肾脏钠-磷共转运蛋白1Ia(NaPi 1Ia)和1α羟化酶的活性而参与肾脏磷酸盐代谢过程。当肿瘤细胞过度合成FGF-23,超出体内蛋白水解酶对其灭活能力时,可导致体内FGF-23水平显著升高。FGF-23的增多短期内使近曲小管刷状缘表面的NaPi1Ia内移和降解;长期作用则可使肾脏近曲小管内NaPi1Ia表达显著降低,从而减少肾脏对磷的重吸收,增加尿磷排出[6]。此外,FGF-23增多还可抑制1α羟化酶的生成及活性,导致活性维生素D生成不足,也会导致血磷水平降低[7]。FGF-23虽然是体内重要的调磷因子,但不是唯一的调磷因子。在TIO肿瘤中除FGF-23过度表达外,可能还存在其他调磷因子,如细胞外基质磷酸糖蛋白(MEPE)和卷曲相关蛋白(FRP4),且已有研究证实MEPE和FRP4具有降低血磷或导致佝偻病的作用[6,8]。
对于TIO诊断,根据患者的病史、症状及体征、血液生化检查及X线检查即可诊断。但肿瘤大多较为隐蔽,需仔细查体及多项辅助检查如超声、CT、MRI、奥曲肽显像等才能确诊。该病的治疗应以手术为主,预后良好[9]。有报道手术切除肿瘤后10余小时至数十小时就可见到l,25(OH)2D3、血磷及肾小管磷重吸收率恢复正常[10]。药物治疗以终生补充中性磷溶液和1,25(OH)2D3为主,但只能将血钙、血磷维持在一定水平,不能治愈。
由于本病较为少见,大多数临床医生对其较为陌生,容易误诊、误治。故提示临床医师当患者出现乏力、骨痛等佝偻病症状,尤其对于血磷降低者,要积极寻找原因,应首先考虑TIO。
[1]Jande SM,Levine MA.Molecular pathogenesis of hypophosphatemic rickets[J].J Clin Endocrinol Metab,2002,87(6):2467-2473.
[2]McCance RA.Osteomalacia with Looser’s nodes(Milkman’s syndrome)due to a raised resistance to vitamin D acquired about the age of 15 years[J].Q J Med,1947,16:33-47.
[3]Noovo MA,Doffman HD,Sun CC,et al.Tumor-induced osteomalacia and rickets[J].Am J Stag Path,1989,13(7):588-599.
[4]Xia WB,Jiang Y,Li M,et al.Levels and dynamic changes of serum fibroblast growth factor 23 in hypophosphatemic rickets/osteomalacia[J].Chin Med J(Engl),2010,123:1158-1162.
[5]While KE,Jonsson KB,Cam G,et al.The ADHR gene is a secreted polypeptide over-expressed by tumors that cause phosphate wasting[J].J Clin Endocrinol Metab,2001,86(2):497-500.
[6]Razzaque MS,Lanske B.The emerging role of the fibroblast growth factor-23-klotho axis in renal regulation of phosphate homeostasis[J].J Endocrinol,2007,194(1):1-10.
[7]Berndt TJ,Schiavi S,Kumar R.“Phosphatonins”and the regulation of phosphorus homeostasis[J].Am J Physiol Renal Physiol,2005,289(6):1170-1182.
[8]De Beur SM,Finnegan RB,Vasailiadis J,et al.Tumor associated with oncogenic osteomalacia express genes important in bone and mineral metabolism[J].J Bone Miner Res,2002,17(6):1102-1110.
[9]Jande Beur SM,Streeten EA,Civelek AC,et al.Localisation of mesenchymal tumours by somatostatin receptor imaging[J].Lancet,2002,59(9308):761-763.
[10]钟定荣,刘彤华,杨堤,等.骨软化或佝偻病相关的间叶组织肿瘤临床病理分析[J].中华病理学杂志,2005,34(11):724-725.
