流速对西伯利亚鲟(Acipenser baerii)行为特性,抗氧化酶及体内盐酸恩诺沙星残留的影响
2014-12-14宋波澜许忠能王占全
宋波澜,许忠能,王占全
(1.河北农业大学 海洋学院水产科学系,河北 秦皇岛 066003;2.暨南大学 水生生物研究所/热带亚热带水生态工程教育部工程研究中心,广东 广州 510632;3.北京市水产科学研究所,北京 100068)
近年来养殖动物药物残留等水产品质量安全问题倍受关注,作为与此相关的理论基础,影响药物残留消除的因素已成为一个研究热点。研究结果表明,影响药物残留消除的因素主要为温度、盐度等环境条件和药物种类、给药方式、动物种类及其不同组织等[1-6]。水流是鱼类生活环境中的一种重要生态因子,能够通过刺激鱼类的感觉器官,使其产生相应的行为反应和活动方式,进而影响鱼类的摄食、生长、代谢等生命活动[7]。近年来,有关养殖鱼类游泳行为与生理活动关系已有一些研究[8-9],而有关水流因子对鱼体内行为,抗氧化酶和抗生素残留的影响研究则尚不多见[10]。西伯利亚鲟(Acipenser baerii)属鲟科(Acipenseridae)鲟属(Acipenser),具有食谱广、易驯养、苗种培育成活率高、生长快等特点[11],本文以西伯利亚鲟为研究对象,以盐酸恩诺沙星作为抗生素代表,研究不同水流条件下西伯利亚鲟的行为学指标,抗氧化酶活力变化和抗生素在体内的残留及消除规律,拟为进一步探讨影响药物残留的生理生态因子以及生产上确定合理休药期提供科学依据。
1 材料与方法
1.1 试验材料
本研究于2011 年4—6 月于北京水产科学研究所河北滦平鲟鱼试范基地进行。实验用鱼为滦平鲟鱼试范基地的西伯利亚鲟幼鱼,选择健康活跃且规格相近的幼鱼350 尾作为试验用鱼[体质量(82.1±4.9)g,体长(25.3±1.1)cm]。实验在特定的蓝色圆形玻璃钢盆内进行,钢盆直径2 m,深50 cm,一字排列。上部供水,每盆供水采取独立喷头式喷水管注水。喷水管外有球形阀门开关可调水流速度和水量,从而获得不同的试验盆中相异的流速。中央底孔排水,排水口具拦鱼设施。从进水口到排水口可形成环形水流。水深可通过水位调节管进行调节,池底边缘到底孔形成倾斜中央坡。实验前将幼鱼在圆形玻璃钢盆驯化7 d,每天投喂2 次饲料,时间为09:00 和18:00,投喂鲟鱼配合饲料(粗蛋白质≥45%,脂肪≥10%,粗纤维≤3%,粗灰分≤17%)为北京汉业饲料公司生产。为避免因水流量的不同而造成的溶氧水平的差异,利用增氧机保持各组溶氧水平基本一致。投喂1 h 后吸去残饵,并换水1/3。水源充分曝气以保持充足的氧气(≥6.2 mg/L),水温恒定(19.0±1.0)℃,pH 7.2~7.4。
1.2 处理方法
1.2.1 不同流速下摆尾频率和趋流率 实验设定0 BL/s(体长/秒)和1.0 BL/s,2.0 BL/s 3 个流速梯度,即0、0.25 和0.5 m/s 流速。静水实验组实际上由于换水的需要通过水交换保持微流状态,流速实测值为0.03 BL/s,近似为0 BL/s 流速。流速采用流速水位计(澳大利亚,Unidata M6526c)在供水口20 cm水下测定。每个流速条件设3 个平行玻璃钢盆,每一玻璃钢盆放置10 尾鱼。2 个流速组每天于2次投喂时各停止水流2 h,投喂时间为09:00 和18:00。每次投喂暂养期相同配合饲料直到实验鱼不再摄食。实验进行30 d,(19.0±1.0)℃。实验期间分别于第1 天(实验开始之前)、第15 天、第30 天08:00 开始测定实验鱼的行为学指标。使用摄像机从钢盆正上方拍摄鱼的游泳行为,每次拍摄持续600 s,然后将所拍录像转换成MPEG4 视频文件在计算机上分析摆尾频率,趋流率[7]。
计算公式如下:
摆尾率:TBF(Hz)=TBT/t;
趋流率:RF(%)=Σni/Nj;
摆尾率TBF 指每尾鱼在被观察期间的摆尾次数t 为观察时间(s)。
趋流率RF 指实验鱼逆流游泳次数占总观察次数的百分比,式中ni 指第i(i=1…,12)条实验鱼在观察期间逆流游泳的次数(每10 s 观察记录1 次,观察时间为600 s),Nj 指总的观察次数。测定静水组实验鱼“趋流率”时设定第1 次观察时实验鱼的游泳方向即为“逆流”方向。
1.2.2 不同流速下抗氧化酶 实验设计同行为学指标测定。实验期间分别于第1 天(实验开始)、第15 天、第30 天上午拍摄之后,投喂之前取样。实验分组前直接从挑选备用的鱼当中取9 尾作为第1 天样品。每个流速水平设3 个平行组,实验中期(15 d)和结束时(30 d)从各平行组取3 尾鱼作样品,测定实验鱼的抗氧化酶指标。
用2 mL 一次性无菌注射器从尾动脉抽取0.8~1.0 mL,不加抗凝剂,直接装入1.5 mL 离心管。4℃冰箱过夜,缓慢摇晃均匀,3 000 r/min 离心15 min 制备血清,-20 ℃冰箱保存备用。
超氧化物歧化酶(SOD)、过氧化氢酶(CAT)和 丙二醛(MDA)的测定采用南京建成生物工程研究所的试剂盒进行测定,具体测定方法按照试剂盒的说明进行。SOD 活力测定采用羟胺法。酶活力单位的定义为:每毫升反应液中SOD 抑制率达50%时所对应的SOD 量为1 个SOD 活力单位),单位U/mL。CAT 活性采用钼酸铵显色测定法。CAT 活力单位的定义为:每毫升血清每秒钟分解1 umoL 双氧水的量为1 个活力单位,单位U/mL。丙二醛(MDA)采用TBA 法。MDA 活力单位的定义为:每毫升血清每秒钟与1 umoL TBA 反应的量为1 个活力单位。
1.2.3 不同流速下肌肉抗生素残留 实验分为静水组、1.0 和2.0 BL/s 流速组。实验前将西伯利亚鲟幼鱼随机分成40 组,每组5 尾鱼。其中1—10 组作为静水采样组,从2 h~20 d(2 h、6 h、1 d、2 d、4 d、6 d、8 d、12 d、16 d 和20 d)共进行10 次采样;11—20 组为作为1.0 BL/s 流速采样组,20—30 组为作为2.0 BL/s流速采样组,从2 h~20 d 分别进行10 次采样;同时设立10 组不投喂药饵的静水空白对照组。本实验所用恩诺沙星标准品(纯度≥99.5%)购于Sigma 公司,盐酸恩诺沙星原粉(纯度不低于98%),由浙江国邦兽药有限公司生产。采用混饲给药法,药饵按盐酸恩诺沙星原粉含量10 g/kg 的配比,采用盐酸诺氟沙星原粉和不含药物的配合饲料原粉以及粘合剂混合后制作颗粒。实验共进行27 d。实验前鱼在实验盆内适应一周,此间投喂用不含药物的饲料原粉制成的颗粒饵料。实验开始后给药组开始投喂药饵,按鱼体质量以每天50 mg/kg 口服盐酸恩诺沙星原粉的剂量折算投喂药饵量,每天投喂1 次。每次投饲时先投药饵,待鱼摄食干净后再补充不含药物饲料,直至饱食。在连续投喂药饵7 d 后开始停药,以后改为投喂不含药饲料,继续养殖20 d。空白对照组则每天投喂1 次不含药饲料。实验期间每天换水1/3,并记录投饲量和水温、溶解氧值等水质指标,保持水质稳定。实验期间溶解氧6.2~8.0 mg/L;pH 值7.2~7.4;水温(19.0±1.0)℃;光照为室内自然光照。
实验组停药后每隔一定时间取样检测肌肉药物残留。静水组、1.0 和2.0 BL/s 流速组于停药后的2 h、6 h、1 d、2 d、4 d、6 d、8 d、12 d、16 d 和20 d 分别取样,每一时间点分别各取1 个水盆5 尾鱼,分作5 个平行样品处理,在每个时段另取空白静水对照组水槽5 尾未给药的鱼作对照,同样处理。取样后破坏其脑脊髓,解剖取背部肌肉,用滤纸吸净组织表面的血液和水分。全部样品-20 ℃冷冻保存用于药物残留分析。
肌肉组织解冻后,称取2 g 样品使用手术剪刀剪成小块,加1 mL pH7.4 的磷酸盐缓冲液后匀浆,然后精确称取1 g 组织匀浆于50 mL 具塞离心管中。加入4 mL 乙睛作为萃取剂,为提高回收率,需重复萃取2 次。于漩涡振荡器上充分混匀,然后以4 000 r/min 离心20 min,取上清液于70 ℃水浴并以氮气流吹干。于剩余残渣中准确加入400 μL 流动相,正己烷去脂肪,下层液用0.22 μm 微孔滤膜过滤,取20 μL滤液,采用岛津LC-20A 高效液相色谱(HPLC)仪测定药物浓度。
色谱条件:色谱柱:SHIM-PACK ODS C18 分析柱;流动相:0.05 mol/L 磷酸溶液、三乙胺+乙腈=82 mL+18 mL;流速:0.8 mL/min;荧光检测器:激发波长280 nm,发射波长480 nm;进样量20 μL;方法检出限:25 μg/kg。
1.3 数据处理
实验数据用Excel 进行常规计算后,用SPSS17.0 进行统计分析。采用单因素方差分析,并利用LSD多重比较法比较各组的差异。统计数据均用平均值±标准差(mean±SD)表示,显著性水平为(P<0.05)。
2 结果分析
2.1 不同流速下西伯利亚鲟游泳行为变化
实验录像分析表明,流速对西伯利亚鲟的游泳行为产生明显的影响(表1)。静水组西伯利亚鲟大多分散活动且游泳方向随机,极少聚集向同一方向游动;3 个时间段趋流率均在60%左右,差异不显著(P>0.05),而各时间段1.0 BL/s 组明显出现群体逆流游泳现象,趋流行为达到98%以上,显著高于静水对照组(P<0.05)。各时间段2.0 BL/s 流速下有部分西伯利亚鲟出现后退行为和顺流行为,但趋流行为仍达到了96%以上。显著高于静水对照组(P<0.05),但和1.0 BL/s 对照组差异不显著(P>0.05)。
不同流速下西伯利亚鲟摆尾频率有随流速增加显著上升的趋势(表1),2.0 BL/s 流速下有最高的摆尾频率2.84 和3.27 Hz。实验期间无论哪个时段2 个实验组下西伯利亚鲟摆尾频率均显著大于静水组(P<0.05),1.0 BL/s 流速条件下15 d 和30 d 摆尾频率分别比静水实验组增加了160.1%和151%。2.0 BL/s流速条件下15 d 和30 d 摆尾频率分别比静水实验组增加了279%和284%。静水条件下西伯利亚鲟摆尾频率随养殖时间的延长变化不大,第1 天和15 天,第30 天摆尾频率无显著性的差异;2 个流速实验组鱼摆尾频率同样随时间的延长变化不明显,第15 天和30 天差异均不显著(P>0.05)。

表1 不同流速对西伯利亚鲟趋流率和摆尾频率的影响Tab.1 Effect of water velocity on the RF and TBF in Siberian Sturgeon

表2 不同流速对西伯利亚鲟抗氧化酶的影响Tab.2 Effect of water velocity on antioxidant enzyme in Siberian Sturgeon
2.2 不同流速下西伯利亚鲟抗氧化酶的变化
不同流速下西伯利亚鲟3 种抗氧化酶随时间变化趋势相同(表2),均随流速增加显著上升(P<0.05)。同一时间段不同流速比较,15 d 和30 d 取样的1.0 BL/s 流速实验组CAT,SOD 和MDA 相比静水对照组均显著上升(P<0.05),15 d 和30 d 2.0 BL/s 流速实验组CAT,SOD 和MDA 3 种酶活力均最高,显著大于1.0 BL/s 流速实验组和对照组。静水组鱼抗氧化酶随饲养时间延长除MDA 外变化不明显,静水组1 d,15 d 和30 d 取样的SOD 和CAT 差异不显著(P>0.05),静水组30 d 取样MDA 显著小于1 d,15 d 取样;而2 个流速组西伯利亚鲟随时间延长3 种抗氧化酶差异均不显著(P>0.05)。
2.3 不同流速处理下西伯利亚鲟肌肉抗生素残留变化
以测得的盐酸恩诺沙星峰面积Ai 对每个浓度Ci 作回归,在0.01~1.00 g/mL 的浓度范围内盐酸恩诺沙星在肌肉组织中药物浓度(Y)与平均峰面积(X)有良好线性相关,回归方程为:Y=467.2X-14.5(r=0.997);本实验条件下,最低检测限为0.025 μg/mL,平均回收率(89.3±2.2)%,表明测定方法具有较高的准确性。
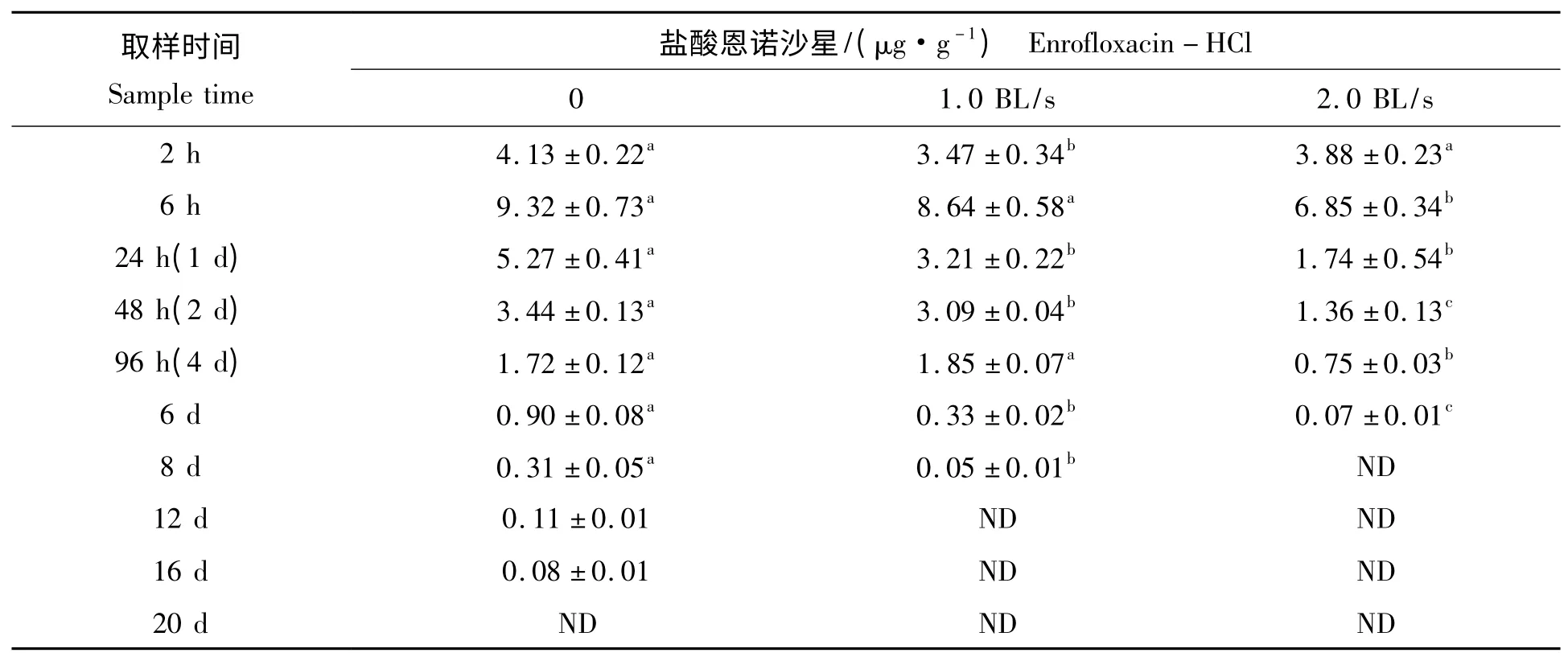
表3 不同流速对西伯利亚鲟肌肉组织盐酸恩诺沙星影响Tab.3 Effect of water velocity on enrofloxacin-HCl level in muscle of Siberian Sturgeon
以50 mg/kg 体质量的投喂量连续7 d 混饲给药,停药后在鱼肌肉组织中盐酸恩诺沙星残留量的时间变化见表3。停药初期静水组盐酸恩诺沙星显著上升,从2 h 时点的4.13 μg/g 上升到6 h 时的9.32 μg/g,增加了125%,随后迅速下降,24 h 后减少到6 h 峰值时的56.5%。与静水组相比,1.0 BL/s流速组肌肉中药物残留消除速度明显加快,停药2 h 到6 h 间含量增加了149%,然后开始降低,1 d、2 d、4 d 和8 d 后残留浓度均显著低于静水组(P<0.05),12 d 后已低于检测限。2.0 BL/s 流速组肌肉中药物残留消除最快,变化趋势与其他两组类似,6 h 后显著下降,1 d、2 d 和4 d 后残留浓度均显著低于静水组,8 d 后已低于检测限。而静水对照组停药6 d 后其残留浓度仍为0.90 μg/g,停药12 d 为0.11 μg/g,直至20 d 后才低于检测限。实验期间空白对照组的测定结果均低于最低检测浓度,可以视为无残留。
3 结论与讨论
养殖条件下,水流作为鱼类生活的一种环境因子,能够使其产生不同的运动方式及相应生理机制。生活在流水中的中上层鱼类大多具有趋流性,它们倾向于对抗水流,能根据流速和流向调整自身的游泳速度和方向,使其保持逆流游泳状态或停留在某一特定位置上。游泳鱼类这种逆流游泳时表现出的头部顶流的行为称为趋流性,是鱼类的一种天性[12]。本研究发现和静水对照组相比,2 个水流组西伯利亚鲟摆尾频率和趋流率均显著上升,1.0 BL/s 组流速下有最高的趋流率。今井义弘等[13]对远东多线鱼和六线鱼,张硕等[14]对黑鲪等海洋鱼类,李丹等[9]对杂交鲟在回形水槽中进行了趋流性和耐流性的研究,同样发现在静水和流速较低的情况下,趋流率为48%~82%,随着流速的增加鱼的趋流率不断增加,当流速达到0.5~0.6 m/s 时,趋流率接近100%。欧洲研究人员对鲨鱼、欧蝶鱼等海洋鱼类的研究也表明在一定的流速范围内,鱼类的趋流率随着流速增大而升高[15]。随着趋流率增加,这些鱼类摆尾频率也相应增加,这和本研究结果相似。这是因为尾鳍是鱼类主要运动器官,随着流速和趋流率的增加,逆流游泳所需动力也相应增加,为此必须通过加大摆尾频率才能保持逆流状态。
CAT,SOD 和MDA 均为广泛存在于生物体内的抗氧化防御性功能酶,是机体清除氧自由基的重要抗氧化保护酶[16-17]。水流最主要的作用就是影响鱼类的游泳运动,而运动的增加将影响其新陈代谢和生理功能。本研究结果表明,不同流速对杂交鲟血清中3 种抗氧化酶活性的影响表现出一定剂量效应关系:即血清中的CAT,MDA 和SOD 活性随着流速浓度的增加而升高。这有可能因为适当的流速促进了运动功能[8],额外的运动使代谢增强[10],诱导机体产生过量的活性氧。而生物体内对应激化抗氧化酶系统,从而消除活性氧损伤。或是促进了血清酶原激活系统的激活,从而使其活力升高。而3 种酶随着时间的延长变化不明显,说明鱼类已经适应了相应水流的影响。
抗生素在动物体内残留量的影响因素很多[1-6,10]。其中水温是影响残留药物代谢和排泄速率的主要环境因素之一[1,3]。一般认为,温度变化通过影响生物整体代谢速率进而影响药物在体内的吸收、代谢和排泄,温度改变1 ℃,药物代谢速度将变化10%[18]。同样,流速的增加能刺激西伯利亚鲟的逆流游泳运动,其摆尾频率也随之加大,从而使代谢速率提高。因而水流的刺激和温度变化效果一样影响到抗生素在鱼体内的代谢和排泄[10]。本研究结果表明,停药后各时间点流速组鱼体内药物残留浓度均显著低于静水组,2.0 BL/s 流速组鱼肌肉盐酸恩诺沙星在停药第8 天已低于检出限,1.0 BL/s 流速组鱼在停药第12 天低于检出限,而静水对照组则在停药20 d 才低于检出限。说明适当的水流因子刺激,能通过诱导鱼类进行逆流游泳运动,促进鱼体药物代谢和加速药物残留的排除。
休药期(WDT)指从停止给药到允许动物屠宰或其产品上市的时间间隔,可看作从停止给药到保证所有食用组织中总残留浓度降至安全浓度以下所需的时间[19]。而本研究结果可为生产上确定和调整休药期,例如在必要时为经过药物治疗康复后的养殖鱼类缩短其休药期提供有效的技术手段。有报道称欧盟要求水产品恩诺沙星残留低于30 μg/kg;日本厚生劳动省自2007 年5 月30 日起,将从我国进口的水产品恩诺沙星残留限量标准由100 μg/kg 调整为10 μg/kg[20]。我国规定的恩诺沙星最高残留限量为100 μg/kg(肌肉)[21]。据此,对于养殖西伯利亚鲟时,若以本研究的给药方式和剂量,停药后在2.0 BL/s流速下养殖的鱼8 d 就可达到要求,1.0 BL/s 流速下需12 d,而静水养殖条件下其休药期则需20 d 以上。本研究结果为进一步探讨流水养殖模式和降低抗生素残留的生理学机理奠定了理论基础,并可为流水养殖杂交鲟提供参考。
[1]艾晓辉,刘长征,周运涛.不同水温和给药方式下磺胺甲噁唑在草鱼体内的药动学研究[J].水生生物学报,2005,9(2):210-214.
[2]Tyrpenou A E,Lossifidou E G,Psomas I E,et al.Tissue distribution and depletion of sarafloxacin hydroch-loride after in feed administration in gilthead seabream(Spares aurata L)[J].Aquaculture,2003,215:291-300.
[3]吴光红,张静波,孟勇,等.不同水温下恩诺沙星在中华绒鳌蟹体内药物代谢动力学[J].南京农业大学学报,2008,31(2):105-110.
[4]黄金田,熊勇君,吴林坤,等.恩诺沙星在中华绒螯蟹体内的衰减研究[J].水产科学,2011,30(2):112-114.
[5]房文红,于慧娟,蔡友琼,等.恩诺沙星及其代谢物环丙沙星在欧洲鳗鲡体内的代谢动力学[J].中国水产科学,2007,14(4):622-629.
[6]方星星,刘秀红,丁相卿,等.恩诺沙星在异育银鲫体内的组织分布及消除规律[J].南京农业大学学报,2012,35(4):110-114.
[7]宋波澜,林小涛,许忠能.逆流运动训练对多鳞四须鲃摄食、生长和体营养成分的影响[J].水产学报,2012,36(1):134-142.
[8]宋波澜,林小涛,王伟军,等.不同流速下红鳍银鲫趋流行为与耗氧率的变化[J].动物学报,2008,54(4):686-694.
[9]李丹,林小涛,李想,等.水流对杂交鲟幼鱼游泳行为的影响[J].淡水渔业,2008,38(6):46-51.
[10]宋波澜,林小涛,许忠能.逆流运动锻炼对多鳞四须鲃运动代谢及鱼体盐酸诺氟沙星残留的影响[J].淡水渔业,2012,42(6):3-7.
[11]曲秋芝,高艳丽.西伯利亚鲟的人工繁殖[J].中国水产科学,2005,12(4):492-495.
[12]何大仁.鱼类行为学[M].厦门:厦门大学出版社,1998:141-145.
[13]今井义弘,高谷义幸.回流水槽にょる北海道西南沿岸の鱼类の行动观察[J].北水实验报,1998(52):9-16.
[14]张硕,陈勇.黑鲪幼鱼趋流性的初步研究[J].上海水产大学学报,2005,14(3):282-287.
[15]Wilga C D,Lauder G V.Functional morphology of the pectoral fins in bamboo sharks,Chiloscy llium plagio sum:benthic vs.pelagic station-holding[J].Journal of Morphology,2001,249:195-209.
[16]郭黎,马爱军,王新安,等.盐度和温度对大菱鲆幼鱼抗氧化酶活性的影响[J].大连海洋大学学报,2012(5):422-428.
[17]王凡,赵元凤,吕景才,等.铜对牙鲆CAT、SOD 和GSH-PX 活性的影响[J].华中农业大学学报,2007,26(6):836-838.
[18]Ingebrigtsen K.Factors affecting drug disposition in fish[J].Acta Veterinaria Scand,1991,87:44-56.
[19]李俊锁,邱月明,王超.兽药残留分析[M].上海:科学技术出版社,2002:257.
[20]Anadon A,Martinez-Larranaga M A,Velez C,et al.Phannacokinetics of norfloxacin and its N-desethyl-and oxo-metabolites in broiler chickens[J].American Journal of Veterinary Reseach,1992,53(11):2084-2089.
[21]农业部渔业局.中华水产标准:无公害食品卷[S].北京:中国标准出版社,2002:137-145.
