猕猴桃果实熟腐病菌生物学特性及其寄主抗病性鉴定研究
2014-12-14蒋军喜王园秀赵尚高李帮明涂贵庆
李 诚,王 禄,蒋军喜*,王园秀,赵尚高,李帮明,余 强,涂贵庆
(1.江西农业大学 农学院,江西 南昌 330045;2.江西省奉新县农业局,江西 奉新 330700)
猕猴桃(Actinidia spp.)营养丰富,经济价值高,是一种深受消费者和生产者喜爱的新兴水果。江西省奉新县是我国猕猴桃生产大县,素有“中国猕猴桃之乡”之美誉。近年来,随着奉新猕猴桃种植规模的逐年扩大,猕猴桃果实熟腐病发生呈明显加重趋势,严重时病果率高达80%以上,严重制约奉新猕猴桃产业的发展,成为奉新猕猴桃生产上亟待解决的问题[1]。
猕猴桃果实熟腐病又称猕猴桃黄腐病,是猕猴桃果实成熟期和采后贮藏期主要病害之一,主要由Botryosphaeria dothidea(无性态Macrophoma sp.或Fusicoccum aesculi)和Phomopsis sp.(有性态Diaporthe sp.)引起[2-5]。目前该病害已在新西兰[6]、韩国[7]、日本[3]、意大利[8]和智利[9]等多个国家和地区报道。我国于1989 年在陕西周至县和北京房山区的猕猴桃上首次报道该病害的发生[10],其后该病害在我国的浙江江山[11]、福建建宁[12]和四川苍溪[13]等地相继报道发生。笔者于2010—2011 年对奉新猕猴桃果实熟腐病病原菌进行鉴定后明确奉新猕猴桃果实熟腐病由6 种真菌引起,其中主要为B.dothidea(占83.0%)和Phomopsis sp.(占8.9%)[1]。鉴于目前国内外对猕猴桃果实熟腐病研究较少的现状,本文从病菌的生物学特性、寄主范围及其品种抗性对该病害进行了较为系统的研究,旨在为深入了解该病害的发生规律和综合防治提供理论依据。
1 材料及方法
1.1 供试菌株
供试菌株分别为葡萄座腔菌(Botryosphaeria dothidea)奉新第6 号菌株(BDF-6)和拟茎点霉菌(Phomopsis sp.)奉新第11 号菌株(PSF-11),两种菌株均由作者于2012 年12 月从奉新猕猴桃果实熟腐病病果中分离获得,并通过致病性测定被确定为强致病力菌株。菌株用甘油长期保存于江西农业大学植物病理实验室4 ℃冰箱,试验前转接PDA 平板进行活化和扩繁。
1.2 病菌生物学特性测定
1.2.1 温度对病菌生长速率的影响 将直径为5 mm 的适龄B.dothidea 和Phomopsis sp.菌饼移至试前备好的PDA 平板上,分别置于5,10,15,20,25,30,35 ℃7 个不同温度梯度的恒温培养箱中培养,每处理3 次重复,培养96 h 后用“十字交叉法”测量菌落直径,计算病菌生长速率。
1.2.2 pH 对病菌生长速率的影响 用1.0 mol/L 的盐酸或氢氧化钠溶液调配pH 为2、3、4、5、6、7、8、9、10、11、12 和13 共12 个不同酸碱度的PDA 平板,将直径为5 mm 的适龄菌落边缘菌饼接种至不同pH的PDA 平板中央,每平板接一菌饼,每处理3 次重复,接种后将其置于25 ℃的恒温培养箱中进行培养,96 h 后用“十字交叉法”测量菌落直径,计算病菌生长速率。
1.2.3 不同培养基质对病菌生长速率的影响 选用马铃薯琼脂培养基(PDA)、牛肉浸膏培养基(NA)、燕麦片琼脂培养基(OMA)、玉米粉琼脂培养基(CMA)、查氏培养基(Czapek)、胡萝卜培养基(CA)、苜蓿煎汁培养基(AEA,alfalfa extract agar)和烟草煎汁培养基(TEA,tobacco extract agar)8 种培养基,相关配方参照文献[14]。将直径为5 mm 的适龄菌落菌饼接种于不同培养基平板上,每处理3 次重复,接种后置25 ℃恒温箱中培养,96 h 后用“十字交叉法”测量菌落直径,计算病菌生长速率。
1.2.4 不同碳、氮源对病菌生长速率的影响 以Czapek 培养基为基础培养基,以等碳量的葡萄糖、α-乳糖、可溶性淀粉、麦芽糖、甘露醇、山梨醇、纤维二糖和甜醇取代蔗糖,配制9 种不同碳源培养基;同理以等氮量的硝酸钾、磷酸二氢铵、牛肉膏、蛋白胨、酵母膏、硝酸铵和氯化铵取代硝酸钠,配制8 种不同氮源培养基。将直径为5 mm 的适龄菌落菌饼接种于含不同碳、氮源的培养基平板上,每处理3 次重复,接种后置25 ℃恒温箱中培养,96 h 后用“十字交叉法”测量菌落直径,计算病菌生长速率。
1.3 寄主范围及猕猴桃品种抗性鉴定
1.3.1 猕猴桃果实熟腐病菌的寄主范围鉴定 选取葡萄科(马奶提、红提、无籽葡萄)、蔷薇科(丰水梨、苹果梨、嘎纳苹果、嘎啦苹果、油桃、冰糖心苹果和香梨)、葫芦科(甜瓜)、芸香科(甜桔和柠檬)和茄科(圣女果)共5 科14 种水果进行抗性鉴定。方法如下:将健康近成熟果实的待接种部位用酒精棉球擦拭消毒,待酒精挥发后用经消毒的镊子轻轻刮开一直径约5 mm 大小的小伤口,以直径为5 mm 的B.dothidea和Phomopsis sp.菌饼为接种体,将其菌丝面紧贴果实伤口面进行接种,设无菌PDA 基块作为对照,接种后用无菌湿棉球进行保湿,置于25 ℃光照培养箱中培养,每处理6 重复,逐日观察发病情况,4 d 后测量病斑直径,计算病斑扩展速率,依据病斑扩展速率来测定猕猴桃果实熟腐病菌对不同种类水果的侵染能力差异。观测后对发病果实进行病菌再分离。
1.3.2 不同猕猴桃品种对果实熟腐病菌的抗性 选取海沃德、金魁、徐香、秦美、红阳、魁蜜、华优、楚红、云海1 号、晚红、武植1 号、金桃、青皮红香、金果、早鲜、金艳和美良1 号共17 个猕猴桃品种进行品种抗性鉴定,鉴定方法同1.3.1。
1.4 统计分析方法
采用SPSS 17.0 软件进行单因素方差分析,处理间的显著差异分析采用Duncan’s 新复极差法。
2 结果与分析
2.1 猕猴桃果实熟腐病菌生物学特性
2.1.1 温度对病菌生长速率的影响 不同温度对B.dothidea 和Phomopsis sp.生长影响较大,在5~35 ℃的温度范围均能正常生长,但温度低于15 ℃时生长相对缓慢,大于30 ℃时生长速率迅速降低,B.dothidea和Phomopsis sp.的最适生长温度均为25 ℃,此时生长速率分别为26.58 mm/d 和9.14 mm/d(图1)。
2.1.2 pH 对病菌生长速率的影响 B.dothidea 和Phomopsis sp.对酸碱度的适应能力较强,只有在pH为2~3 的强酸性基质中不能正常生长。在供试的其余pH 基质中均能正常生长,但其病菌的生长速率存在较显著差异,在中性或略偏碱的条件下最适宜生长,在中性基质中B.dothidea和Phomopsis sp.的生长速率分别高达26.37 mm/d 和8.12 mm/d(图2)。

图1 温度对病菌菌丝生长的影响Fig.1 Effect of temperature on mycelial growth of pathogenic fungi

图2 pH 对病菌菌丝生长的影响Fig.2 Effect of pH on mycelial growth of pathogenic fungi
2.1.3 不同培养基质对病菌生长速率的影响B.dothidea 在PDA、CA 和苜蓿煎汁培养基上生长较快,生长速率分别高达27.00,27.00,26.67 mm/d,在烟叶煎汁培养基、OMA 和CMA 上次之,在Czapek 和NA 上生长较慢,生长速率分别为15.11 mm/d 和10.11 mm/d;Phomopsis sp.在烟叶煎汁培养基、PDA、CA 和苜蓿煎汁培养基上生长较快,生长速率分别为14.44、13.22,12.67,11.89 mm/d,在OMA、Czapek 和CMA 上次之,在NA 中生长缓慢,生长速率为5.11 mm/d(图3)。

图3 不同培养基对病菌菌丝生长的影响Fig.3 Effect of medium on mycelial growth of pathogenic fungi
2.1.4 不同碳、氮源对病菌生长速率的影响在9 种供试碳源培养基上,B.dothidea 和Phomopsis sp.均能正常生长,其中蔗糖、葡萄糖、麦芽糖和纤维二糖最适宜两种病菌的生长,乳糖、淀粉、甘露醇和甜醇次之,在山梨醇中生长最慢(表1)。
在8 种供试氮源培养基上,B.dothidea 和Phomopsis sp.均能正常生长,但存在较显著差异,最适生长氮源为酵母膏、牛肉膏和蛋白胨,磷酸二氢铵和硝酸钠次之,在氯化铵、硝酸铵和硝酸钾中生长最慢(表1)。
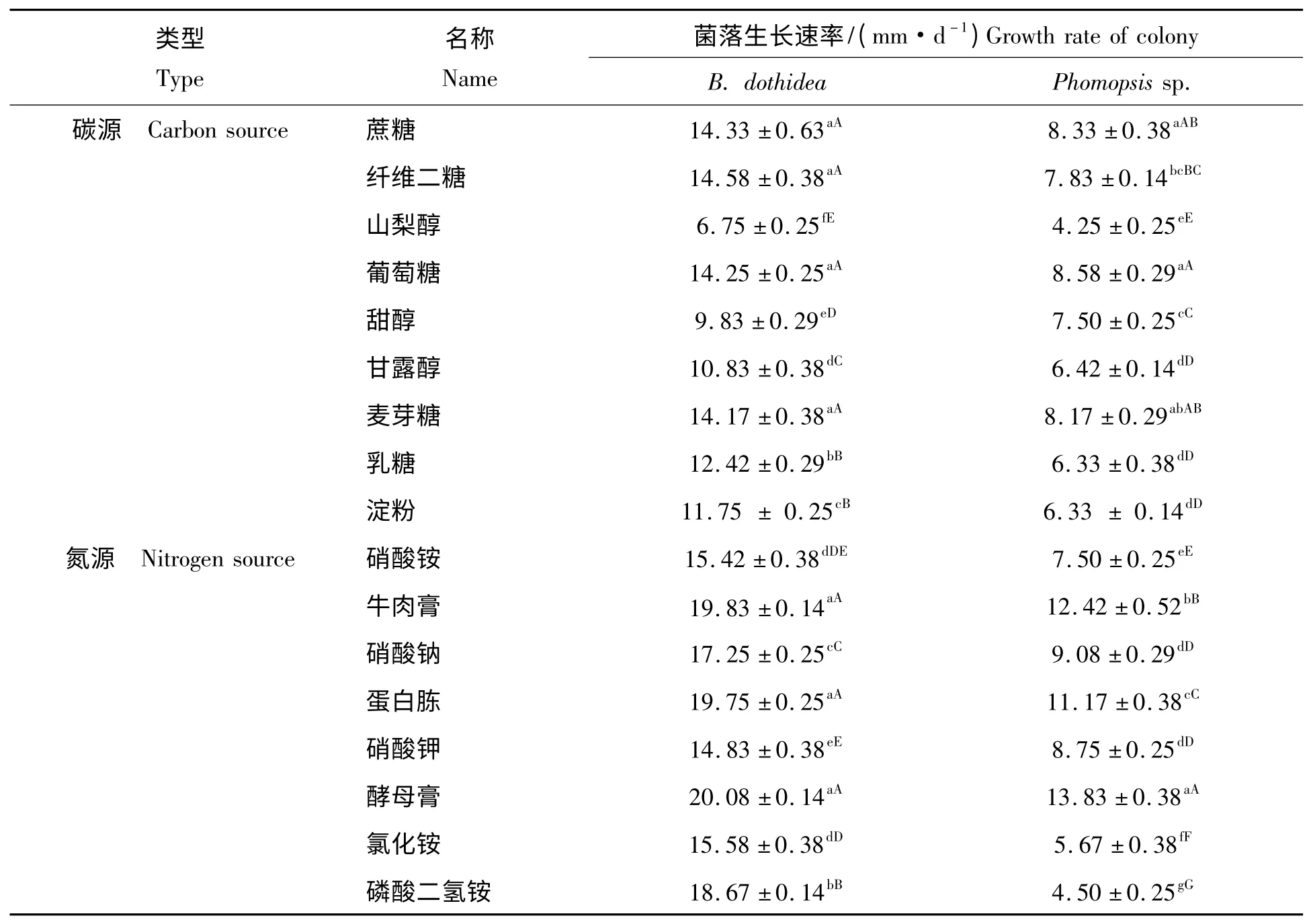
表1 不同碳氮源对病菌菌丝生长的影响Tab.1 Effect of different carbon(nitrogen)sources on mycelia growth of pathogenic fungi

图4 病菌对不同种类水果的侵染能力Fig.4 Pathogenicity of pathogenic fungi on different fruit species
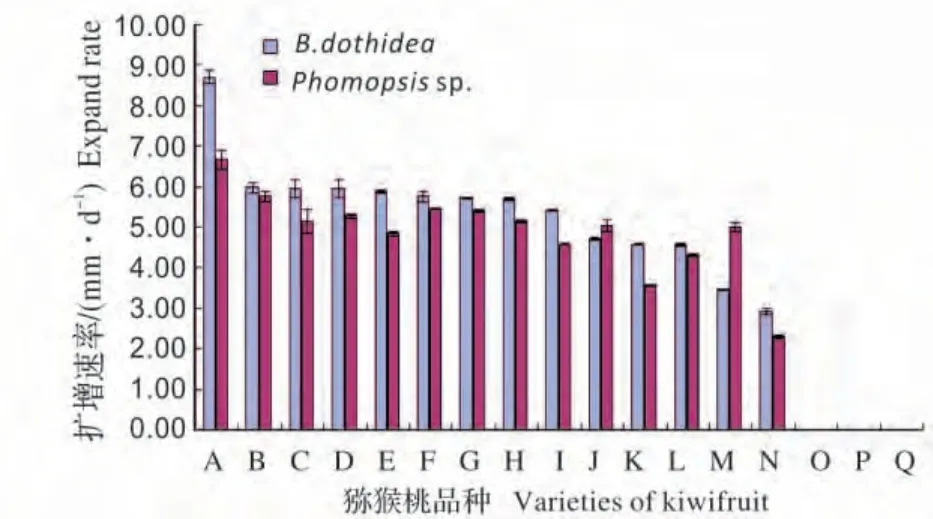
图5 病菌对不同猕猴桃品种的侵染能力Fig.5 Pathogenicity of pathogenic fungi on different varieties of kiwifruit
2.2 寄主范围及猕猴桃品种抗性鉴定
2.2.1 猕猴桃果实熟腐病菌的寄主范围鉴定 人工伤口接种试验表明,B.dothidea 和Phomopsis sp.能侵染马奶提、红提、无籽葡萄、丰水梨、苹果梨、香梨、冰糖心苹果、嘎纳苹果、嘎啦苹果、油桃、梨瓜、甜桔、柠檬和圣女果等共5 科14 种水果(图4),对发病果实进行病菌再分离,分离到与接种菌一致的病菌。
2.2.2 不同猕猴桃品种对果实熟腐病菌的抗性 17 个猕猴桃品种分别被刺伤接种B.dothidea 和Phomopsis sp.,96 h 后,除海沃德、云海1 号和金艳3 个品种无发病症状外,其余14 个品种均表现出不同程度的感病症状(图5),其中秦美最感病,被B.dothidea 和Phomopsis sp.侵染后,病斑扩展速率分别达8.70 mm/d和6.67 mm/d;晚红感病性相对最低,被B.dothidea 和Phomopsis sp.侵染后,病斑扩展速率仅为2.92 mm/d 和2.31 mm/d;其他12 个品种的感病性则介于其间。对发病猕猴桃进行病菌再分离,得到与接种菌一致的病菌。
3 结论与讨论
本试验对猕猴桃果实熟腐病菌的生物学特性及寄主抗病性进行了较为系统的研究,结果表明不同温度、pH、培养基和碳氮源对病菌菌丝生长存在较显著差异,菌丝生长的最适温度为25 ℃,最适pH 为7,最适培养基为PDA、CA 和苜蓿煎汁培养基,最有利于菌丝生长的碳源为蔗糖、葡萄糖、麦芽糖和纤维二糖,最佳氮源为酵母膏、牛肉膏和蛋白胨。研究还发现猕猴桃熟腐病菌能侵染供试的全部5 科14 种植物,表明其寄主范围较广。试验中筛选到海沃德、云海1 号和金艳3 个高抗果实熟腐病的猕猴桃品种,这3 个高抗品种除可供生产中直接利用外,还可以作为抗病育种和抗病机理研究的宝贵材料。
有关其他寄主植物上的葡萄座腔菌和拟茎点霉菌的生物学特性研究有见报道,但之前尚未见过对猕猴桃上的葡萄座腔菌和拟茎点霉菌的生物学特性研究。赵晓军[15-16]等记述枣树干腐病菌(B.dothidea)在PDA 上生长较好,在Czapek 中生长最差,最适温度为31 ℃,最适pH 为6,蔗糖和硝酸钾为最佳碳氮源,与本研究结果相比存在一定差异;刘琪[17]、张勇[18]和李红叶[19]等记述李树、扁桃和梅树流胶病菌(B.dothidea)的最适生长温度为25-30 ℃,最佳氮源为蛋白胨,与本研究结果较相吻合。有关Phomopsis sp.,牛晓庆等[20]记述油棕叶斑病菌(Phomopsis sp.)最适培养基为PDA,最适温度25 ℃,最适pH 为7,以葡萄糖和蛋白胨为最佳碳氮源,与本研究结果较相吻合;姜淑霞等[21]记述板栗褐缘叶枯病菌(Phomopsis sp.)最适温度为20~30 ℃,最适pH 为5~6,最佳碳氮源分别为葡萄糖和氯化铵,梁臣等[22]记述桦树枯枝病菌(Phomopsis sp.)在20~30 ℃,偏酸性条件下生长较好,蔗糖为最佳碳源,蛋白胨为最佳氮源,与本研究结果存在一定差异。不同寄主来源的葡萄座腔菌和拟茎点霉菌其生物学特性不完全相同,提示在对这些病菌进行人工培育时,需要设置不同的培养条件。
[1]李诚,蒋军喜,冷建华,等.奉新县猕猴桃果实腐烂病病原菌分离鉴定[J].江西农业大学学报,2012,34(2):259-263.
[2]Pennycook S R,Samuels G.Botryosphaeria and Fusicoccum species associated with ripe fruit rot of Actinidia deliciosa(kiwifruit)in New Zealand[J].Mycotaxon,1985,24:445-458.
[3]Masaru K,Toyozo S.Kiwifruit dieback caused by Diaporthe sp.and Botryosphaeria dothidea,kiwifruit rot fungi[J].Annals of the Phytopathological Society of Japan,2003,69(4):373-383.
[4]Koh Y J,Lee J G,Hur J S,et al.Screening of fungicides for the control of postharvest fruit rots of kiwifruit[J].Research in Plant Disease,2005,9(3):170-173.
[5]Manning M A,Meier X,Olsen T L,et al.Fungi associated with fruit rots of Actinidia chinensis‘Hort16A’in New Zealand[J].New Zealand Journal of Crop and Horticultural Science,2003,31:315-324.
[6]Pennycook S R.Fungal fruit rots of Actinidia deliciosa(kiwifruit)[J].New Zealand Journal of Experimental Agriculture,1985,13:289-299.
[7]Koh Y J,Lee J G,Lee D H,et al.Botryosphaeria dothidea,the cause organism of rot of kiwifruit(Actinidia deliciosa)in Korea[J].The Plant Pathology Journal,2003,19(5):227-230.
[8]Luongo L,Santori A,Riccioni L,et al.Phomopsis sp.associated with post-harvest fruit rot of kiwifruit in Italy[J].Journal of Plant Pathology,2011,93(1):205-209.
[9]Auger J,Perez I,Esterio M.Diaporthe ambigus associated with post-harvest fruit rot of kiwifruit in chile[J].Plant Disease,2013,97(6):843.
[10]丁爱冬,于梁,石蕴莲.猕猴桃采后病害鉴定和侵染规律研究[J].植物病理学报,1995,25(2):149-153.
[11]宋爱环,李红叶,马伟.浙江江山地区猕猴桃储运期主要病害鉴定[J].浙江农业科学,2003(3):131-134.
[12]姜景魁,张绍升,廖廷武.猕猴桃黄腐病的研究[J].中国果树,2007(6):14-16.
[13]王瑞玲.红阳猕猴桃采后病害生理及臭氧保鲜技术研究[D].雅安:四川农业大学,2010.
[14]方中达.植病研究法[M].北京:中国农业出版社,1998.
[15]赵晓军,周建波,任璐.枣树干腐病菌生物学特性研究[J].山西农业大学学报:自然科学版,2011,31(5):434-439.
[16]赵晓军,周建波,赵子俊,等.枣树干腐病病原菌的鉴定[J].菌物学报,2009,28(3):332-335.
[17]刘琪,何朝辉,黄丹敏,等.李树流胶病病原特性及发病规律研究[J].植物保护,2003,29(1):39-42.
[18]张勇,李晓军,曲健禄,等.扁桃流胶病病原菌及其生物学特性研究[J].中国果树,2008(1):41-44
[19]李红叶,曹若彬,方华生,等.梅树流胶病病原生物学及防治研究[J].浙江农业大学学报,1990,16(3):281-284.
[20]姜淑霞,贾雯,邵云华,等.板栗褐缘叶枯病病原菌生物学特性研究[J].山东农业科学,2010(4):52-55.
[21]牛晓庆,唐庆华,余凤玉,等.油棕叶斑病的病原鉴定及其生物学特性[J].江西农业学报,2011,23(11):103-105.
[22]梁臣,张宏敏,郎子建,等.桦树枯枝病病原菌的生物学特性研究[J].中国森林病虫,2008,27(2):4-6.
