抗生素的高级氧化降解工艺与机理研究进展
2014-12-11符荷花熊小京
符荷花,陈 猛,熊小京
(1.厦门大学 深圳研究院,广东 深圳518057;2.厦门大学 环境与生态学院,福建 厦门361005)
1 引言
抗生素广泛存在于抗生素生产废水、医院废水[1~3]、城市污水 处理厂[4,5]、养殖废水、地 表 水[2,6]、饮用水[2,3]及土壤[7]中,其残留水平从ng/L到μg/L,检出的抗生素包括β-内酰胺类、磺胺类、大环内酯类、氟喹诺酮类、四环素类、林可胺类等。抗生素生产废水、医院废水、养殖废水和生活污水是抗生素的主要环境污染源。抗生素属生物难降解物质[8,9],可长期残留在环境中,对生态环境与人居的危害有:①引起微生物耐药性[10];②影响水生生物生长和繁殖[11,12];③影响植物生长[13,14];④影响人类健康。我国是抗生素生产和使用大国,因此,抗生素污染控制技术研究与应用已成为当前环保领域的热点。
本文系统介绍常用的高级氧化抗生素处理工艺,并根据抗生素不同分类,对近年β-内酰胺类、磺胺类、大环内酯类、喹诺酮类抗生素高级氧化降解机理的研究进展进行综述。
2 抗生素高级氧化处理工艺研究
常用的高级氧化技术有:光催化氧化(UV/H2O2、UV/O3、 UV/H2O2/O3、UV/TiO2和 UV/H2O2/TiO2)、臭 氧 及 组 合 臭 氧 氧 化 技 术(O3、O3/H2O2)、Fenton法(Fe2+/H2O2)及改进Fenton法(光-Fenton、电-Fenton等)、超声氧化等。该技术是通过羟基自由基(·OH)氧化分解水中有机污染物。·OH 氧化能力很强(氧化还原电位高达2.80V)。高级氧化技术处理抗生素的研究报道如表1所示。可以看出,TiO2光催化反应360 min可降解82%的磺胺甲噁唑,反应120 min可降解98%林可霉素和四环素去除[15,16];臭氧氧化反应20~120 min可完全降解喹诺酮类、大环内酯类、四环素类、磺胺类等抗生素[17~19]。Fenton法能有效降解青霉素类抗生素,最佳反应条件下,Fenton法和光-Fenton法完全降解阿莫西林只需2.5 min 和3.0 min[20,21],完全降解磺胺甲噁唑和磺胺柳氮磺胺嘧啶需要60min左 右[22,23]。Elmolla[24]比 较 了TiO2光 催 化、UV/ZnO 和Fenton、光-Fenton对抗生素的处理效果。几种工艺都能较好地去除β-内酰胺类抗生素,光催化降解工艺反应速率常数比Fenton和photo-Fenton小很多,可见臭氧氧化和各种Fenton氧化工艺对抗生素去除效果较高,可作为处理实际抗生素废水的首选。
3 抗生素高级氧化降解机理研究
3.1 β-内酰胺类抗生素
β-内酰胺类抗生素含有共同的β-内酰胺环结构,主要有青霉素类(阿莫西林和青霉素G、V 等)和头孢菌素(头孢氨苄等)。降解机理研究报道主要涉及青霉素类,较少涉及头孢菌素类。Klauson等[25]研究阿莫西林TiO2光催化降解特性。经鉴定降解中间产物发现,降解产物和途径与阿莫西林浓度有关,可能是阿莫西林易吸收其邻近分子表面和空间的活性部位。在10~25mg/L 低浓度下,可能的降解途径为:①与苯环邻近的肽键(表2中阿莫西林结构1位置)断裂,形成对羟基苯甲酸和内酰胺环;②内酰胺键(表2中阿莫西林结构2位置)断裂,然后是相同部位肽键断裂。当浓度为100mg/L时,阿莫西林除上述途径外,还有氨基断裂及羟基化两种途径。
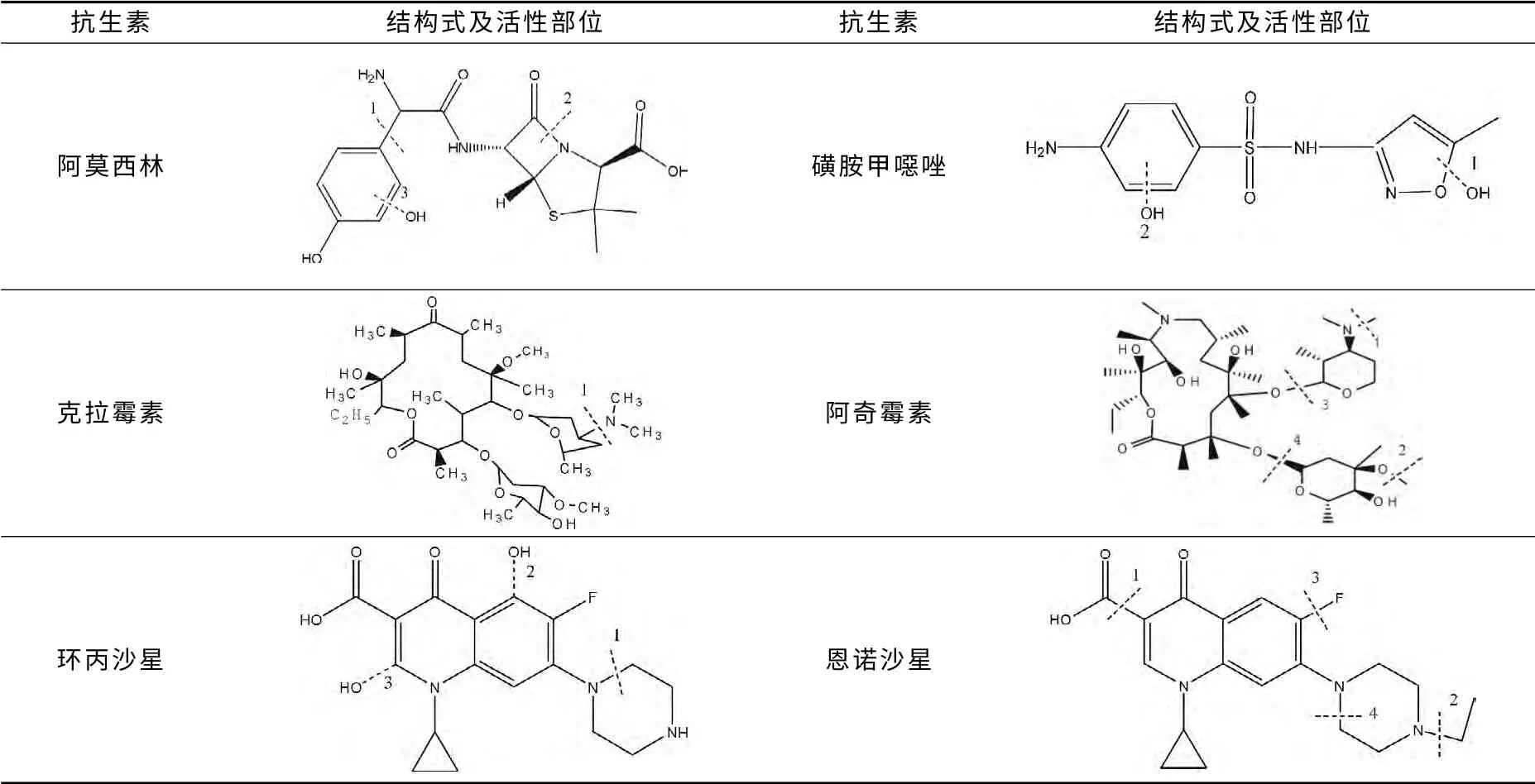
表2 几种抗生素结构及活性部位
Trovo等[26]研 究 光-Fenton 法 阿 莫 西 林 降 解 机理。发现降解过程中有16种中间产物,由此推断阿莫西林的机理为:①羟基化,反应过程中形成羟基自由基攻击亲电子的苯环和氮原子,形成不同中间产物;②β-内酰胺开环,之后脱羧基和甲基氧化;③形成同素异形体,在不同部位羟基化。反应60min所有中间产物均完全降解;还发现,使用草酸铁钾和用硫酸亚铁反应时,产生中间产物有所不同,这可能和降解速率有关。青霉素类降解途径可以分为内酰胺环开环和羟基化(苯环位置)两种。同一抗生素因浓度不同、氧化速率不同其降解中间产物和降解途径也有所不同。
3.2 磺胺类抗生素
磺胺类抗生素均含有磺胺结构,如磺胺甲噁唑、磺胺嘧啶、磺胺甲嘧啶、磺胺吡啶等,其中有关磺胺甲噁唑降解机理研究报道最多。Calza等[27]研究磺胺嘧啶、磺胺甲基嘧啶、磺胺二甲氧嘧啶、磺胺噻唑等4种磺胺的TiO2光催化降解机理。经降解中间产物测定发现,4种磺胺的降解途径十分类似,只是中间产物稳定性不同,路径之一是磺胺类结构中S-N 键断裂,释放S;而途径之二是羟基自由基于苯环作用,形成羟基-磺胺类,然后S-N 键断裂中间产物进一步释放S、N 原子。5种磺胺S-N 键断裂后形成的RNH2结构稳定性有所不同。Abellán[15]、Trovó[28]、Dirany[23]研究磺胺甲噁唑降解机理。Abellán研究TiO2光催化磺胺甲噁唑,发现羟基自由基先与磺胺甲噁唑中异恶唑环作用(表2中磺胺甲噁唑结构1位置),开异恶唑环,形成4-氨基-N 苯磺胺酰,之后羟基与苯环作用(表2中磺胺甲噁唑结构2 位置),苯环开环,最后形成SO42-、NH4+和CO2。Trovó的光-Fenton法结果与Abellán的结果基本一致,发现降解反应中羟基自由基攻击磺胺甲噁唑苯环和异恶唑环;进一步发现,羟基自由基更易与异恶唑环作用,使异恶唑环开环,之后脱羧基等继续氧化降解,形成甲酸、乙酸、丙酮酸、草酸以及等;而Dirany在考察磺胺甲噁唑电-Fenton降解机理中发现,降解反应首先是磺胺甲噁唑在苯环上羟基化,之后是S-N 断裂形成对–苯醌和3-氨基-5甲基异恶唑,它们氧化裂解产物中包含丁烯酸、羟基丁二酸、乙醛酸、丙酮酸以及SO42-、NO3-、NH4+等。在磺胺类抗生素中,分子结构中苯环和对应磺胺特征环及S-N 键是活性部位。羟基自由基容易与活性部位作用,发生开环和S-N 断裂。中间产物的形成和降解与磺胺种类、浓度以及处理工艺有关。Calza[27]发现磺胺甲基嘧啶S-N 键断裂后的中间产物很稳定,而磺胺噻唑S-N 键断裂后的中间产物不稳定,降解半周期为7min,最终生成SO42-、NO3-、NH4+、CO2及其他一些难降解的中间产物。
3.3 大环内酯类抗生素
大环内酯类抗生素均含有一个12-16碳的大内酯环,结构较复杂,常见的有红霉素、罗红霉素及近年新研制的克拉霉素、阿奇霉素等。红霉素、罗红霉素和克拉霉素结构类似,均含有二甲氨基团,降解机理类似。Lange[29]研究克拉霉素的臭氧氧化机理,发现臭氧作用部位是二甲氨基团(表2中克拉霉素1位置)。首先是臭氧在二甲氨基氮原子上加孤对电子,使其形成两性离子氨,之后分两步反应降解:首先失去2 个氧,形成N氧化克拉霉素(占反应90%),之后形成臭氧游离自由基阳离子和氨自由基阴离子,再失去质子,氧化脱甲基,形成脱甲基-克拉霉素。阿奇霉素、林可霉素与红霉素、克拉霉素的结构差异较大,降解机理有所不同。Tong Lei等[30]在研究阿奇霉素光催化降解机理中发现其降解途径主要有两种:①去氧氨糖中N-脱甲基(脱一个甲基和脱两个甲基,见表2中阿奇霉素结构1 位置)和克拉定糖中O-脱甲基(表2 中阿奇霉素结构1位置);②去氧氨糖断裂和克拉定糖断裂(表2中阿奇霉素结构3、4位置)。
3.4 喹诺酮类抗生素
喹诺酮类为人工合成抗生素药物,常见的有恩诺沙星、环丙沙星、氧氟沙星等。An Taicheng[31]研究环丙沙星光催化降解机理,发现环丙沙星的降解有两种途径:其一是与羟基自由基作用,其二是与光子空穴直接作用。经前沿电子密度算出·OH 攻击点为:①环丙基连接N 的邻近位置碳;②苯环中与氟连接碳的邻近位置碳(表2中环丙沙星结构2、3位置)。空穴攻击哌嗪基上N(表2 中环丙沙星结构1 位置),进一步氧化降解。然而,Li Yang等[32]在研究恩诺沙星光催化降解机理中却得出不同的结论,认为恩诺沙星降解途径为:①羧酸键断裂;②与哌嗪基连接乙基断裂;③环丙基和氟键断裂;④哌嗪环开环(表2 中恩诺沙星结构1、2、3、4位置)。第三代喹诺酮类抗生素中,哌嗪基上N,环丙基上N,-F,C-COOH 键为活性部位,易受自由基攻击而断裂。
4 结论
臭氧氧化和各种Fenton氧化工艺对抗生素去除效果较高,可作为处理抗生素废水的首选。高级氧化对青霉素类降解途径主要分为内酰胺环开环和羟基化(苯环位置)两种;对磺胺类经降解最终生成及其他难降解中间产物;对喹诺酮类降解包括羧酸键断裂、与哌嗪基连接乙基断裂、环丙基和氟键断裂、哌嗪环开环等。
[1]Brown K.D.,Kulis J.,Thomson B.,et al.Occurrence of antibiotics in hospital,residential,and dairy effluent,municipal wastewater,and the Rio Grande in New Mexico[J].Science of The Total Environment,2006,366(2-3):772~783.
[2]Watkinson A.J.,Murby E.J.,Kolpin D.W.,et al.The occurrence of antibiotics in an urban watershed: From wastewater to drinking water[J].Science of The Total Environment,2009,407(8):2711~2723.
[3]Chang X.,Meyer M.T.,Liu X.,et al.Determination of antibiotics in sewage from hospitals,nursery and slaughter house, wastewater treatment plant and source water in Chongqing region of Three Gorge Reservoir in China[J].Environmental Pollution,2010,158(5):1444~1450.
[4]Göbel A.,Thomsen A.,Mcardell C.S.,et al.Occurrence and sorption behavior of sulfonamides,macrolides,and trimethoprim in activated sludge treatment[J].Environmental Science &Technology,2005,39(11):3981~3989.
[5]Gulkowska A.,Leung H.W.,So M.K.,et al.Removal of antibiotics from wastewater by sewage treatment facilities in Hong Kong and Shenzhen,China[J].Water Research,2008,42(1):395~403.
[6]Golet E.M.,Alder A.C.,Giger W.Environmental exposure and risk assessment of fluoroquinolone antibacterial agents in wastewater and river water of the Glatt Valley Watershed,Switzerland[J].Environmental Science &Technology,2002,36(17):3645~3651.
[7]Schauss K.,Focks A.,Heuer H.,et al.Analysis,fate and effects of the antibiotic sulfadiazine in soil ecosystems[J].TrAC Trends in Analytical Chemistry,2009,28(5):612~618.
[8]Al-Ahmad A.,Daschner F.,Kümmerer K.Biodegradability of cefotiam, ciprofloxacin, meropenem, penicillin G, and sulfamethoxazole and inhibition of waste water bacteria[J].Archives of Environmental Contamination and Toxicology,1999,37(2):158~163.
[9]Ingerslev F.,Halling S.B.Biodegradability properties of sulfonamides in activated sludge[J].Environmental Toxicology and Chemistry,2000,19(10):2467~2473.
[10]Reinthaler F.,Posch J.,Feierl G.,et al.Antibiotic resistance of E.coli in sewage and sludge[J].Water Research,2003,37(8):1685~1690.
[11] Baran W., Sochacka J., Wardas W. Toxicity and biodegradability of sulfonamides and products of their photocatalytic degradation in aqueous solutions [J].Chemosphere,2006,65(8):1295~1299.
[12]Sanderson H.,Brain R.A.,Johnson D.J.,et al.Toxicity classification and evaluation of four pharmaceuticals classes:antibiotics,antineoplastics,cardiovascular,and sex hormones[J].Toxicology,2004,203(1-3):27~40.
[13]Batchelder A.Chlortetracycline and oxytetracycline effects on plant growth and development in liquid cultures[J].Journal of Environ.Quality,1981,10:515~518.
[14]Migliore L.,Civitareale C.,Brambilla G.,et al.Effects of sulphadimethoxine on cosmopolitan weeds (Amaranthus retroflexus L.,Plantago major L.and Rumex acetosella L)[J].Agriculture,Ecosystems & Environment,1997,65(2):163~168.
[15]Abellán M.N.,Bayarri B.,Giménez J.,et al.Photocatalytic degradation of sulfamethoxazole in aqueous suspension of TiO2[J].Applied Catalysis B:Environmental,2007,74(3):233~241.
[16]Addamo M.,Augugliaro V.,Paola A.D.,et al.Removal of drugs in aqueous systems by photoassisted degradation[J].Journal of applied electrochemistry,2005,35(7):765~774.
[17]Lin A.Y.C.,Lin C.F.,Chiou J.M.,et al.O3and O3/H2O2 treatment of sulfonamide and macrolide antibiotics in wastewater[J].Journal of Hazardous Materials,2009,171(1):452~458.
[18]De Witte B.,Dewulf J.,Demeestere K.,et al.Ozonation and advanced oxidation by the peroxone process of ciprofloxacin in water[J].Journal of Hazardous Materials,2009,161(2):701~708.
[19]Dalmázio I.,Almeida M.O.,Augusti R.,et al.Monitoring the degradation of tetracycline by ozone in aqueous medium via atmospheric pressure ionization mass spectrometry[J].Journal of the American Society for Mass Spectrometry,2007,18(4):679~687.
[20]Ay F.,Kargi F.Advanced oxidation of amoxicillin by Fenton's reagent treatment[J].Journal of Hazardous Materials,2010,179(1):622~627.
[21]Rozas O.,Contreras D.,Mondaca M.A.,et al.Experimental design of Fenton and photo-Fenton reactions for the treatment of ampicillin solutions[J].Journal of Hazardous Materials,2010,177(1):1025~1030.
[22]Fan X.,Hao H.,Shen X.,et al.Removal and degradation pathway study of sulfasalazine with Fenton-like reaction[J].Journal of Hazardous Materials,2011,190(1):493~500.
[23]Dirany A.,Sirés I.,Oturan N.,et al.Electrochemical abatement of the antibiotic sulfamethoxazole from water[J].Chemosphere,2010,81(5):594~602.
[24]Elmolla E.,Chaudhuri M.Optimization of Fenton process for treatment of amoxicillin,ampicillin and cloxacillin antibiotics in aqueous solution[J].Journal of hazardous materials,2009,170(2):666~672.
[25]Klauson D.,Babkina J.,Stepanova K.,et al.Aqueous photocatalytic oxidation of amoxicillin[J].Catalysis Today,2010,151(1):39~45.
[26]Trovo A.G.,Nogueira R.F.P.,Aguera A.,et al.Degradation of the antibiotic amoxicillin by photo-Fenton process- Chemical and toxicological assessment[J].Water Research,2011,45(3):1394~1402.
[27]Calza P.Photocatalytic transformations of sulphonamides on titanium dioxide[J].Applied Catalysis B:Environmental,2004,53(1):63~69.
[28]TrovóA.G.,Nogueira R.F.P.,Agüera A.,et al.Degradation of sulfamethoxazole in water by solar photo-Fenton.Chemical and toxicological evaluation[J].Water Research,2009,43(16):3922~3931.
[29]Lange F.,Cornelissen S.,Kubac D.,et al.Degradation of macrolide antibiotics by ozone:A mechanistic case study with clarithromycin[J].Chemosphere,2006,65(1):17~23.
[30]Tong L.,Eichhorn P.,Perez S.,et al.Photodegradation of azithromycin in various aqueous systems under simulated and natural solar radiation: Kinetics and identification of photoproducts[J].Chemosphere,2011,83(3):340~348.
[31]An T.,Yang H.,Li G.,et al.Kinetics and mechanism of advanced oxidation processes (AOPs)in degradation of ciprofloxacin in water[J].Applied Catalysis B-Environmental,2010,94(3-4):288~294.
[32]Li Y.,Niu J.,Wang W.Photolysis of Enrofloxacin in aqueous systems under simulated sunlight irradiation: Kinetics,mechanism and toxicity of photolysis products [J].Chemosphere,2011,85(5):892~897.
