原发性失眠患者默认网络神经功能的静息态MRI研究
2014-12-10李永丽LIYongli
李永丽 LI Yongli
王恩锋 WANG Enfeng
张红菊 ZHANG Hongju
张晓琪 ZHANG Xiaoqi
贾艳艳 JIA Yanyan
张 斌 ZHANG Bin
窦社伟 DOU Shewei
贾武林 JIA Wulin
失眠易导致日间认知功能障碍[1-3]。原发性失眠(primary insomnia, PI)在慢性失眠患者中发病率高达25%[4],是一种尤为常见的睡眠障碍。PI的病因及发病机制并不明确,临床治疗针对性不强。既往研究发现脑默认网络(default mode network, DMN)的存在,主要包括后扣带回(posterior cingulate cortex, PPC)皮质、楔前叶、前扣带回腹侧、内侧前额叶、角回、双侧侧顶叶皮层、海马旁回及双侧颞叶皮质等脑区,这些结构是一种相互联系的大脑系统,维持着人脑在静息状态下的一些最基本的认知活动[5-8]。关于PI对DMN的影响目前研究较少,本实验利用磁共振脑功能成像技术(fMRI),通过种子点相关分子方法,选取双侧PCC为种子点,分析PI患者DMN脑功能连接是否存在特异性改变及其发生机制,为PI临床认知功能障碍的诊疗提供可能的客观依据。
1 资料与方法
1.1 研究对象 选择2013-07~12郑州大学人民医院神经内科门诊20例脑部结构正常的PI患者作为PI组,其中男7例,女13例;年龄23~48岁,平均(38.50±8.57)岁,选择20名健康者作为对照组,性别和年龄与PI组匹配,对照组年龄21~54岁,平均(35.40±10.41)岁。所有受试者均为右利手。实验前,所有受试者均签署知情同意书,并进行匹兹堡睡眠质量指数量表(Pittsburgh sleep quality index,PSQI)、汉密尔顿抑郁量表(Hamilton depression scale, HAMD)、汉密尔顿焦虑量表(Hamilton anxiety scale, HAMA)测量。
1.2 试验入组标准
1.2.1 PI组入组标准 ①符合美国DSM-IV(diagnostic and statistical manual of mental disorders-4th ed, DSM-IV)[9]关于PI和中国精神障碍分类与诊断标准(Chinese classif i cation of mental disorders-3, CCMD-3)PI诊断标准;②PI组PSQI>5分,HAMD<14分;③排除其他精神疾病及全身器质性病变;④MRI常规扫描脑部结构图检查正常;⑤年龄18~55岁;⑥近1周无服用抗焦虑、抑郁及睡眠药物史;⑦右利手。
1.2.2 对照组入组标准 ①排除家族疾病、全身器质性疾病;②MRI常规扫描脑部结构图检查正常;③无酗酒、吸烟不良习惯;④PSQI<5分,HAMD<7分,HAMA<7分;⑤1周内无熬夜史;⑥年龄18~55岁;⑦右利手。
1.3 研究方法 所有符合入组条件者提前30 min到MR室,由2名实验课题组研究生向受试者训练静息态脑功能成像实验流程。所有受试者在扫描前休息约10 min,尽量安静闭目不思考问题。数据采集均采用Siemens Tim Trio 3.0T超导MRI仪,头颅12通道专用线圈,进行脑部常规结构像、静息态脑功能像数据采集,扫描时以泡沫固定受试者头部以减少头动,使用棉球和耳塞以减少噪声。脑部结构异常及脑功能数据不符合标准者提前舍弃不用。
1.3.1 常规MRI扫描序列参数 首先进行常规脑部结构图扫描,扫描序列包括轴位T1WI、T2WI、FLAIR、DWI序列,层厚5 mm,间隔1 mm,视野230 mm×230 mm,矩阵128×128;T1WI:TR 400 ms,TE 15 m s;T2WI:TR 3500 m s, TE 105 m s;FLAIR :TR 10 000 ms,TE 175 ms,TI 2200 ms;DWI:TR 5000 ms,TE 97 ms, 激 励 次 数 1,b=0、1000 s/mm2。
1.3.2 静息态脑功能成像扫描序列参数[10,11]静息态扫描时嘱受试者静息平卧,安静闭目,尽量不思考。采用梯度回波-平面回波(GRE-EPI)序列:TR 3000 ms,TE 30 ms,矩阵 64×64,层厚5 mm,层间隔0.5 mm;共36层,视野320 mm×320 mm。高分辨率T1 3D-MPRAGE序列:TR 1950 ms,TE 2.30 ms,TI 900 ms,矩 阵 248×256;层厚1 mm;无间隔,视野244 mm×252 mm, 扫描时间 4.24 min。
1.4 脑功能成像数据处理
1.4.1 图像预处理 使用MRIcron进行DICOM数据转换,数据使用SPM8进行预处理过程,对每个受试者的EPI图像首先进行时间校正,然后进行头部校正,舍弃头动三维平衡超过1.5 mm或三维旋转超过1.5°的数据。然后将静息态数据前10个TR时间的数据去除,重排:即运动校正,找一个最接近定位像的点作为参照点,把其他点与其对应,将同一受试者不同采样时间点上的三维脑对齐。配准:将受试者的功能像与解剖定位像进行配准以消除功能像的集合变形。空间标准化和平滑处理:使不同受试者脑图像中的同一像素代表相同的解剖位置,将每个个体脑放进一个公共的标准脑空间-Talairach坐标系,空间平滑处理使残差项更符合高斯分布假设,减少标准化后剩余的个体间差异,提高信噪比。
1.4.2 DMN功能连接分析 以PCC为种子点。因为PCC与脑DMN的其他脑区连接,故常被选为种子点[5,12]。使用WFU_PickAtlas tool生成种子点,然后进行重采样,使之与试验数据匹配。使用Rest软件进行数据分析,其计算过程为:首先提取PCC时间序列的平均值,然后与大脑其余的体素进行相关分析,相关系数经过Fisher Z值转换,得到每个被试的Z值图,首先分别进行PI组、对照组单样本t检验,显著阈值设为P<0.001,体素簇≥1350 mm3(校正阈值根据AlphaSim设定)。然后进行两样本t检验,显著阈值设为P<0.01,体素簇≥513 mm3(校正阈值根据AlphaSim设定)。使用BrainNet Viewer生成三维图像,使用xjview自动识别功能连接异常脑区。
1.5 统计学方法 采用Rest 软件及SPSS 12.0软件,PI组与对照组脑DMN、脑区计量资料比较采用单样本t检验,以P<0.001为差异有统计学意义,得出有统计学意义的脑区。PI组与对照组年龄、PSQI、HAMA、HAMD比较采用两样本t检验,以P<0.01为差异有统计学意义。
2 结果
2.1 PI与对照组PSQI、HAMA、HAMD评分比较
PI组PSQI、HAMD、HAMA评分均显著高于对照组(t= -11.332、-13.629、-10.840, P<0.001),PI组与对照组年龄差异无统计学意义(t=-0.937, P>0.01),见表1。
2.2 以PCC为种子点,PI组与对照组静息态脑DMN功能连接结果
2.2.1 对照组与PCC功能连接脑区 包括左侧颞极/颞图1 对照组静息态脑DMN与PCC为种子点功能连接图,A、B分别为MRI图像和采用BrainNet Viewer生成的三维图像。功能连接脑区主要包括双侧前额叶、扣带回、顶叶、颞叶等脑区。显著阈值设为P<0.001,体素簇≥1350 mm3(校正阈值根据AlphaSim设定),红色区域代表功能连接脑区上回/额上回/岛叶、右侧颞上回/岛叶、右侧枕下回/梭状回、右侧额下回/额下回眶部、双侧楔前叶/后扣带回/中间扣带回、左侧颞上回/颞横回、右侧枕中回/楔前叶/顶上小叶、右侧额上回(表2、图1)。
2.2.2 PI组与PCC功能连接脑区 包括左侧额下回眶部/颞上回/额中回、双侧楔前叶/后扣带回/中间扣带回、右侧颞中回/枕中回/楔前叶/角回、左侧额中回/额上回、右侧中央前回、右侧额上回(表3、图2)。
2.2.3 PI组DMN功能连接异常脑区 PI组与PCC功能连接增强脑区包括双侧额上回、双侧中间扣带回(表4、图3);PI组与PCC连接减弱脑区包括左侧枕叶舌回/海马旁回/梭状回、右侧颞上回/颞极、右侧颞中回/枕中回、左侧枕叶/颞中回(表5、图3)。
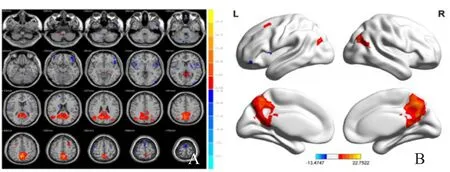
图2 PI组静息态脑DMN与PCC为种子点功能连接图,A、B分别为MRI图像和采用BrainNet Viewer生成的三维图像。功能连接脑区主要包括双侧前额叶、扣带回、顶叶、颞叶等。显著阈值设为P<0.001,体素簇≥1350 mm3(校正阈值根据AlphaSim设定),红色区域代表功能连接脑区

表1 PI组与对照组PSQI、HAMD、HAMA临床量表比较
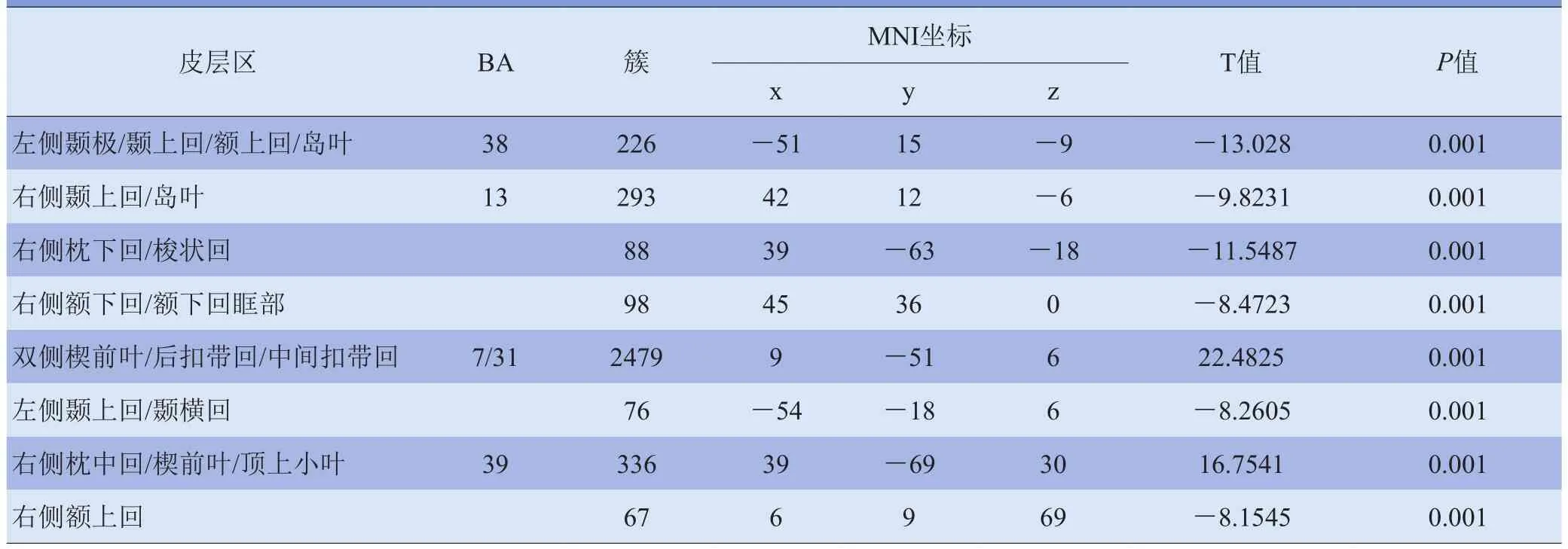
表2 对照组静息态脑DMN 与PCC功能连接脑区

表3 PI组静息态脑DMN 与PCC功能连接脑区

图3 与对照组对比,PI组与PCC连接异常脑功能图,A、B分别为MRI图像和采用BrainNet Viewer生成的三维图像。PI组与PCC功能连接增强脑区为双侧额上回和中间扣带回;减弱脑区为左侧枕叶舌回、海马旁回、梭状回、右侧颞上回、颞极、颞中回、枕中回。显著阈值设为P<0.01,体素簇≥513 mm3(校正阈值根据AlphaSim设定),红色代表连接增强区域,蓝色代表连接减弱区域
3 讨论
人脑在清醒静息状态下,脑内有自发的、连续的神经元功能活动,即DMN的存在[13],这一网络维持着人脑在静息状态下的一些最基本的认知活动。DMN的确切功能及机制尚不清楚,但可以肯定的是DMN提示大脑存在静息状态下的内在“思考”[14]。以往许多研究均发现阿尔茨海默病、自闭症和精神分裂症患者脑DMN发生改变。本实验以双侧PCC为种子点,采用静息态fMRI分析PI患者DMN脑功能连接是否存在特异性改变,为PI认知功能障碍的诊疗提供可能的影像学客观依据。

表4 PI组DMN与PCC功能连接增强区域
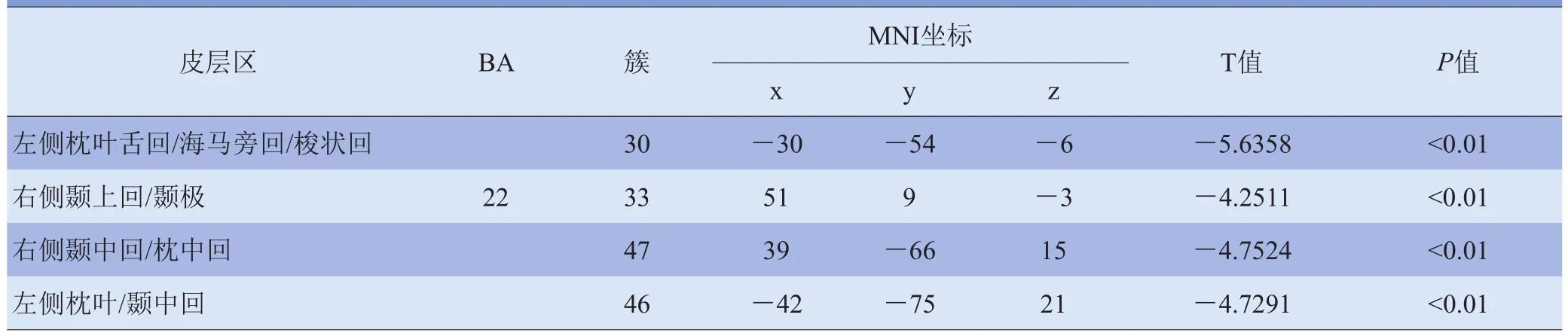
表5 PI组DMN与PCC功能连接减弱区域
本研究结果显示,PI组、对照组与双侧PCC功能连接主要脑区,如楔前叶、双侧额中回、双侧扣带回等属于DMN固有的脑区,与以往静息态DMN研究一致,提示PI组与对照组在静息状态下DMN连接的存在。
与对照组相比,PI组双侧额上回、中间扣带回与PCC的功能连接增强。前额叶是脑的重要结构之一,不仅参与人脑对内外环境信息的整合、情绪整合及情景记忆提取等功能,还与脑内其他脑区相互协同作用,共同维持人脑在静息状态下的基本功能。fMRI研究表明,前额叶中内侧背侧与自我意识密切相关,是大脑自发产生自我意识及内察性意识活动所必须的脑区,至少参与了能够体现自我意识某一方面的认知加工过程,这些区域活动增加提示PI患者存在自我意识过度觉醒、情绪调节异常等方面的认知障碍。根据Beck负性认知理论[15],失眠患者过度关注失眠状态,这种负性认知障碍不仅引起失眠之前的焦虑,也使患者更加难以入睡,长期在失眠焦虑影响下会引起抑郁,17%的PI患者在随后的6年内发生抑郁[16],这也与本研究中PI患者存在抑郁、焦虑一致。中间扣带回的过度激活是重度抑郁症的标志[17],PI组可见其与PCC功能连接增强,与PI组临床HAMD指数增高相匹配。DMN功能连接异常揭示PI组HAMD、HAMA评分明显高于对照组的病理损害机制,与临床表现一致。
本研究发现左侧枕叶舌回、海马旁回、梭状回、右侧颞叶皮层(颞上回、颞极、颞中回)、枕中回与PCC功能连接降低。枕叶主要负责处理视觉信息,属于大脑的视觉中枢,同时又负责部分语言、动作及抽象概念等功能,枕叶损伤的患者不仅会产生视觉障碍,还可能出现记忆功能下降或运动知觉障碍等症状。Bilo等[18]研究发现在无症状枕叶癫痫患者中,除出现明显视觉空间认知障碍外,患者的执行功能也较正常人下降,从而进一步证实了枕叶的功能。本研究结果显示,左侧枕叶舌回与PCC连接功能降低,提示PI患者负责短期记忆及社交沟通的部分脑区出现异常,尤其是日间的社交沟通能力下降,提示大脑枕叶部分区域发生功能损伤。海马、海马周边区域及相邻的皮质结构(颞角、岛叶、枕叶齿状回等)均属于边缘系统,接收来自额叶、顶叶、枕叶等皮质的信息,是人脑记忆功能的中枢,边缘系统也是情绪调节的主要区域。Nofzinger等[19]应用PET研究PI患者,发现与情绪及认知相关的脑区代谢下降程度相对较低,这些脑区包括杏仁体、海马及海马旁回等结构。睡眠剥夺后的正常人也会出现精神运动系统损害,包括记忆损害、反应迟缓、警觉下降等[20];海马有参与记忆的储存和加固功能,长期失眠患者其日间陈述性记忆功能明显低于健康人[21];以上结果均表明失眠会使海马、海马旁回、杏仁体等结构功能受损,同时海马与其他区域的连接性也会发生改变。海马在进行记忆等信息的输入时,还与下丘脑-垂体-肾上腺轴的唤醒调节机制有关,本研究发现左侧海马旁回与PCC连接功能降低,可能是由于长期处于失眠状态的PI患者处于过度应激状态,从而引起下丘脑-垂体-肾上腺轴功能亢进,出现记忆损害、执行功能下降等认知功能障碍,产生记忆力下降、焦虑、抑郁情绪调节障碍。
失眠是一个极其复杂的过程,可能涉及多个脑区、神经网络及神经内分泌机制,随着PI患者病情发展,这种静息状态下的功能异常也会发生某种改变,原发性患者静息态DMN的活动变化规律仍有待进一步随访证实。
(志谢:感谢解放军信息工程大学闫斌博士、童莉博士在数据处理方面做出的贡献)
[1] Buysse DJ, Thompson W, Scott J, et al. Daytime symptoms in primary insomnia: a prospective analysis using ecological momentary assessment. Sleep Med, 2007, 8(3): 198-208.
[2] Shekleton JA, Rogers NL, Rajaratnam SM. Searching for the daytime impairments of primary insomnia. Sleep Med Rev,2010, 14(1): 47-60.
[3] Shekleton JA, Flynn-Evans EE, Miller B, et al.Neurobehavioral performance impairment in insomnia:relationships with self-reported sleep and daytime functioning.Sleep, 2014, 37(1): 107-116.
[4] Krystal AD. Insomnia in women. Clin Cornerstone, 2003, 5(3):41-50.
[5] Bluhm RL, Osuch EA, Lanius RA, et al. Default mode network connectivity: effects of age sex, and analytic approach.Neuroreport, 2008, 19(8): 887-891.
[6] 叶恩茂, 邵永聪, 毕国华, 等. 睡眠剥夺对静息态脑功能默认模式网络的影响. 南方医科大学学报, 2009, 29(12):2523-2526, 2532.
[7] Buckner RL, Andrews-Hanna JR, Schacter DL. The brain's default network: anatomy, function, and relevance to disease.Ann N Y Acad Sci, 2008, 1124: 1-38.
[8] 尧兰, 夏阳, 赖永秀, 等. 听觉重复启动时默认模式网络变化的磁共振研究. 生物物理学报, 2011, 27(10): 849-858.
[9] Association AP. The diagnostic and statistical manual of mental disorders. 4th ed. Washington, D.C.: American Psychiatric Press, 1999: 240-241.
[10] 谢洪武, 罗天友, 陈日新, 等. 慢性疼痛患者静息态脑功能磁共振的默认网络研究. 生命科学研究, 2011, 15(6): 502-506.
[11] De Havas JA, Parimal S, Soon CS, et al. Sleep deprivation reduces default mode network connectivity and anti-correlation during rest and task performance. Neuroimage, 2012, 59(2):1745-1751.
[12] Liu Peng, Zhang Yi, Zhou Guangyu, et al. Partial correlation investigation on the default mode network involved in acupuncture: an fMRI study. Neurosci Lett, 2009, 462(3): 183-187.
[13] Raichle ME, MacLeod AM, Snyder AZ, et al. A default mode of brain function. Proc Natl Acad Sci U S A, 2001, 98(2): 676-682.
[14] Shu SY, Wu YM, Bao XM, et al. A new area in the human brain associated with learning and memory:immunohistochemical and functional MRI analysis. Mol Psychiatry, 2002, 7(9): 1018-1022.
[15] Beck AT, Weissman A, Lester D, et al. The measurement of pessimism: the hopelessness scale. J Consult Clin Psychol,1974, 42(6): 861-865.
[16] Fong SY, Wing YK. Longitudinal follow up of primary insomnia patients in a psychiatric clinic. Aust N Z J Psychiatry,2007, 41(7): 611-617.
[17] Lisiecka D, Carballedo A, Fagan AJ, et al. Overactivation of the middle cingulate cortex and the caudate nucleus as neural correlates of the familial liability to major depressive disorder.European Psychiatry, 2011, 26(Supplement 1): 648.
[18] Bilo L, Santangelo G, Improta I, et al. Neuropsychological profile of adult patients with nonsymptomatic occipital lobe epilepsies. J Neurol, 2013, 260(2): 445-453.
[19] Nofzinger EA, Buysse DJ, Germain A, et al. Functional neuroimaging evidence for hyperarousal in insomnia. Am J Psychiatry, 2004, 161(11): 2126-2128.
[20] Vgontzas AN, Zoumakis E, Bixler EO, et al. Adverse effects of modest sleep restriction on sleepiness, performance, and inf l ammatory cytokines. J Clin Endocrinol Metab, 2004, 89(5):2119-2126.
[21] Riemann D, Berger M, Voderholzer U. Sleep and depression--results from psychobiological studies: an overview. Biol Psychol, 2001,57(1-3): 67-103.
