PBDC1蛋白的表达及其多克隆抗体的制备
2014-12-07戚武林胡江江曹玲玲赵辅昆张世馥
戚武林,胡江江,曹玲玲,赵辅昆,张世馥
(浙江理工大学生命科学学院蛋白质组学与分子酶学研究室,浙江杭州310018)
多糖生物合成域1蛋白(polysaccharide biosynthesis domain-containing 1,PBDC1)含有198个氨基酸,分子质量约为22.2 ku。在丁酸钠(sodium butyrate,SB)[1-2]诱导小鼠红白血病(murine erythroleukemia,MEL)细胞[3]分化的差异蛋白质组中,发现了PBDC1蛋白含量在细胞红系分化过程中逐渐下调。由此推测,PBDC1蛋白可能与诱导的MEL细胞分化有关。镍柱亲和层析的原理是利用蛋白质表面的组氨酸能与Ni2+发生特殊的相互作用,能够吸附富含组氨酸的蛋白质,从而达到分离纯化的目的。本实验拟通过原核表达系统表达含有6×His标签的PBDC1融合蛋白,通过镍离子亲和柱纯化得到PBDC1融合蛋白,并免疫新西兰大白兔制备其多克隆抗体,为研究PBDC1蛋白在红系分化中的功能提供有利工具。
1 材料与方法
1.1 材料
大肠杆菌E.coli BL21(DE3)和pET-28a(+)质粒(本研究室保存);MEL细胞(上海生命科学研究院);DMEM培养基和胎牛血清(Gibco公司);质粒提取试剂盒、DNA胶回收试剂盒(Qiagen公司);DNA聚合酶、T4 DNA连接酶、EcoRⅠ和 XhoⅠ(Takara公司);异丙基-β-D-硫代吡喃半乳糖苷(IPTG)、弗氏完全佐剂与不完全佐剂(Sigma公司);Trizol试剂(Invitrogen公司);反转录试剂盒(Fermentas公司);镍离子亲和层析介质(上海生工生物工程公司);其他试剂均为分析纯;引物合成、DNA测序(上海桑尼生物科技有限公司);质谱鉴定(本研究室完成);免疫用新西兰大白兔为普通级,体质量约2.5 kg,雄性,来源于浙江省实验动物中心[合格证号SCXK(浙)2009-0039]。
1.2 PBDC1基因的获得
MEL细胞在含10%胎牛血清的DMEM培养基中培养至对数增殖期,收集细胞,提取RNA[4],反转录获得cDNA。根据PBDC1基因序列,设计上游引物:5'-CGGAATTCATGGATGCTGCCGGCGA-3'(下划线部分为EcoRⅠ酶切位点),下游引物:5'-CCGC TCGAGCTACTTTTCTCCTTCTCTGTTGGCTC-3'(下划线部分为XhoⅠ酶切位点)。以cDNA为模板,PCR扩增PBDC1基因。PCR反应条件为:94℃变性30 s,57 ℃ 退火 30 s,68 ℃ 延伸 1 min,共 30 个循环;再68℃延伸10 min。琼脂糖凝胶电泳回收PBDC1基因片段。
1.3 pET-28a(+)-PBDC1表达载体的构建与鉴定
将pET-28a(+)质粒与PBDC1基因分别用EcoRⅠ/XhoⅠ双酶切,将回收的基因片段与载体通过T4 DNA连接酶进行连接。连接产物转化BL21(DE3)感受态细胞后筛选克隆,对重组质粒进行PCR鉴定、EcoRⅠ/XhoⅠ双酶切鉴定以及测序分析。
1.4 PBDC1蛋白的诱导表达
将筛选到的含阳性克隆的BL21(DE3)菌株接种到4 mL含50 mg/L Kan的LB培养基中,37℃振荡培养过夜;再将培养物按1∶100的比例接种至400 mL含Kan的LB培养基中,37℃振荡培养4 h,使培养液的A600值达到0.5~0.7,加入IPTG至终浓度为1 mmol/L,37℃继续振荡培养4 h,最后离心收集菌体。
1.5 PBDC1蛋白的纯化
将收集得到的菌体重悬于裂解缓冲液(50 mmol/L NaH2PO4,0.3 mol/L NaCl,10 mmol/L 咪 唑,pH 8.0)中,冰浴并超声波破碎后,离心收集上清,上样于镍离子亲和层析柱,用洗涤缓冲液(50 mmol/L NaH2PO4,0.3 mol/L NaCl,40 mmol/L 咪 唑,pH 8.0)洗柱,除去非特异结合的蛋白质,最后用洗脱缓冲 液 (50 mmol/L NaH2PO4,0.3 mol/L NaCl,100 mmol/L咪唑,pH 8.0)洗脱,收集目的蛋白溶液,并通过SDS-PAGE来检测纯化结果。
1.6 PBDC1多克隆抗体的制备
将纯化得到的PBDC1蛋白通过脱盐、浓缩用于免疫兔,首次免疫500μg蛋白,之后每隔7 d加强免疫1次,抗原量减半,颈部皮下多点注射,共加强免疫3次。首次免疫用弗氏完全佐剂乳化,加强免疫用弗氏不完全佐剂乳化。末次免疫7 d后颈动脉取血,收集血清。
1.7 多克隆抗体的Western blot鉴定
用纯化的PBDC1蛋白进行SDS-PAGE电泳,蛋白电转至PVDF膜,5%脱脂奶粉中室温封闭2 h,然后用上述制备的多克隆抗体(TBST稀释,稀释度为1∶10 000)4℃孵育过夜。TBST洗膜,以辣根过氧化物酶标记的羊抗兔IgG室温孵育2 h,最后用化学发光法显色。
2 结果
2.1 目的基因PBDC1扩增
以cDNA为模板,PCR扩增出1条600 bp左右的条带(图1),与预期基因片段长度一致。
2.2 重组质粒p ET-28a(+)-PBDC1的鉴定
PCR鉴定和双酶切鉴定结果显示均在约600 bp处可见一条带,大小与预期相符(图2),经DNA测序证明序列完全正确。阳性克隆命名为BL21/pET-28a(+)-PBDC1。

图2 重组质粒的PCR鉴定及双酶切鉴定Fig 2 Identification of recombinant plasmid by PCR and enzyme digestion
2.3 PBDC1蛋白的表达及可溶性分析
BL21/pET-28a(+)-PBDC1经IPTG诱导,在约27 ku处存在大量表达的蛋白,与预期大小相符。PBDC1蛋白在大肠埃希菌中为可溶性表达(图3)。
2.4 PBDC1蛋白的纯化及鉴定
纯化得到的PBDC1融合蛋白纯度较高,其相对分子质量约为27 ku(图4),进一步通过质谱鉴定证实该蛋白确实是PBDC1蛋白。
2.5 多克隆抗体的Western blot鉴定
Western blot结果表明在25 ku和35 ku之间存在特异性条带,表明制备得到的抗PBDC1蛋白的抗体能与PBDC1蛋白发生免疫印迹反应(图5)。
3 讨论
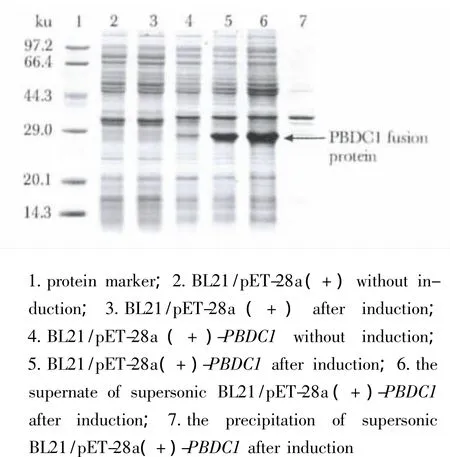
图3 PBDC1蛋白的融合表达及可溶性分析Fig 3 Expression of PBDC1 fusion protein and its soluble analysis

图4 SDS-PAGE检测纯化的PBDC1融合蛋白Fig 4 Identification of purified PBDC1 fusion protein by SDS-PAGE

图5 多克隆抗体的Western blot鉴定Fig 5 Identification of polyclonal antibody by Western blot
PBDC1是一个新发现的蛋白。目前,有关它的特性及功能尚不了解。在丁酸钠诱导MEL细胞红系分化的差异蛋白质组中,发现PBDC1蛋白含量在细胞分化过程中逐渐下调。由此推测PBDC1蛋白参与了红系分化过程,可能是红系分化的一个潜在的调控因子。然而,目前还没有商品化的PBDC1抗体。为了研究它在MEL细胞分化中的功能,本研究拟将PBDC1基因片段插入pET-28a(+)载体,转入大肠埃希菌BL21(DE3)经IPTG诱导,表达出大量、可溶的PBDC1融合蛋白。通过镍离子亲和层析柱分离纯化得到含His标签的重组蛋白。PBDC1蛋白免疫新西兰大白兔制备了抗PBDC1蛋白的多克隆抗体,为后续深入研究相关蛋白功能提供实验材料。
[1]Santini V,Gozzini A,Scappini B,et al.Searching for the magic bullet against cancer:the butyrate saga[J].Leuk Lymphoma,2001,42:275 -289.
[2]Grebenova D,Kuzelova K,Pluskalova M,et al.The proteomic study of sodium butyrate antiproliferative/cytodifferentiation effects on K562 cells[J].Blood Cells Mol Dis,2006,37:210-217.
[3]Friend C.Leukemia of adult mice caused by a transmissible agent[J].Ann N Y Acad Sci,1957,68:522 -532.
[4]J.萨姆布鲁克,D.W.拉塞尔.分子克隆实验指南[M].3版,北京:科学出版社,2002:518-522.
