eIF4H低表达对MEL细胞增殖和红系分化的影响
2014-12-07薛建有桑婷婷戚武林曹玲玲毛群铨朱晓芳张世馥
薛建有,桑婷婷,戚武林,曹玲玲,毛群铨,朱晓芳,张世馥
目前已发现一些因子参与调控红系分化。GATA1是一个至关重要的造血转录因子,GATA1/FOG1复合体通过激活α-珠蛋白和EKLF基因的表达而抑制GATA2的表达来促进红系分化[1]。PU.1与GATA1的作用恰好相反,可阻碍红系分化。在HMBA或DMSO诱导分化的MEL细胞中GATA1表达上调而PU.1表达下调,GATA1的过表达导致MEL细胞红系分化,但这种GATA1的诱导作用可被PU.1的上调表达抑制[2]。PU.1与GATA1相结合导致GATA1级联信号通路的阻断而阻碍了红系分化进程。c-Myc在红系分化过程中表达下调,其过表达阻碍Rac2和组蛋白乙酰转移酶(HAT)Gcn5下调表达从而导致珠蛋白H3和H4乙酰化、阻碍了核固缩和排核[3]。真核生物翻译起始因子 4H(eIF4H)最早在兔子网织红细胞中发现,在eIF4B和eIF4F缺少的情况下可促进血红蛋白的合成[4]。然而eIF4H是否对白血病细胞增殖和红系分化的产生影响尚未见报道。为此,本研究通过构建eIF4H低表达的MEL细胞稳定株,通过观察eIF4H低表达对MEL细胞体外增殖和红系分化的影响,为进一步探究eIF4H在白血病发生中的作用机制提供依据。
1 材料与方法
1.1 细胞和质粒
HEK293T细胞(中国科学院上海生命科学研究院细胞资源中心),MEL细胞(中国协和医科大学基础医学研究所惠赠)。
载体质粒 pLKO.1、对照质粒 pLKO.1-TRC(scramble)、包装质粒pCMV-VSVG和pCMV-dR8.2(Addgene公司)。
1.2 试剂
胎牛血清(Hyclone公司);MEN培养基和DMEM培养基(Gibco公司);嘌呤霉素、丁酸钠和MTT(Sigma公司);转染试剂 LipofectanineTM2000(Invitrogen公司);PI凋亡染色试剂盒(南京凯基生物);兔抗小鼠eIF4H单克隆抗体(CST公司);小鼠抗人β-actin单克隆抗体和羊抗小鼠 IgG单克隆抗体(Sigma公司)。
1.3 方法
1.3.1 细胞培养:MEL和HEK29T细胞培养于含10%FBS的DMEM培养液(100 U/mL青霉素和100μg/mL链霉素)中,于37℃、5%CO2饱和湿度下培养,每隔2 d传代1次,取对数生长期细胞用于实验。
1.3.2 含shRNA干扰序列重组质粒的构建:设计的两对eIF4H靶序列分别为eIF4H-shRNA-1:5'-GAGACAAAGACACAGACAAAT-3';eIF4H-shRNA-2:5'-ACTCGCACACCAACCTTATAT-3'。小发夹shRNA干扰片段经退火后与pLKO.1-TCR质粒载体链接。选取scramble-shRNA作为阴性对照,此序列在细胞内没有靶向基因,对细胞的形态没有影响,序列如下:5'-GCCAATCGTTCTCTGACAGAA-3'。
1.3.3 慢病毒包装:HEK293T细胞按7×105/mL接种于10 cm培养皿中培养过夜;再用无血清MEM培养基培养2 h,加入16μg质粒(7.5μg pLKO.1,2.9 μg pCMV-VSVG,5.6 μg pCMV-dR8.2)和15μL LipofectanineTM2000,继续培养6 h后,换成完全培养基,培养96 h后,收集含有病毒的上清液,-80℃储存。
1.3.4 eIF4H低表达的MEL细胞稳定株的构建:MEL细胞按每孔4 500个细胞接种于24孔板内,加入1 mL DMEM培养基,将pLKO.1-scrambleshRNA(scramble-shRNA)、pLKO.1-eIF4H-shRNA-1(eIF4H-shRNA-1)和 pLKO.1-eIF4H-shRNA-2(eIF4H-shRNA-2)3种病毒分别加到细胞悬液中。侵染96 h后,弃去上清培养基,用0.5μg/mL的嘌呤霉素筛选含抗性基因的细胞。最后通过蛋白免疫印迹实验验证eIF4H的表达情况。
1.3.5 MTT比色法检测细胞增殖:取各组细胞按3 000个细胞/孔接种于96孔板中,每孔200μL。设置培养基空白对照组,每组设置3个重复。于含5%CO2,37 ℃ 的恒温培养箱中培养 24、48、72、96和120 h后,每孔加入10μL 5 g/L的MTT溶液,避光孵育4 h后弃培养基,加入150μL DMSO,待紫色结晶充分溶解,A595nm处测定吸光度值。以时间为横坐标,A595nm为纵坐标绘制生长曲线。
1.3.6 流式细胞术检测eIF4H低表达对MEL细胞周期的影响:收集各组细胞,PBS洗3次,70%乙醇固定至少24 h。根据凯基PI凋亡染色试剂盒说明书操作。
1.3.7 联苯胺染色法检测细胞的红系分化情况:取各组细胞按1.5×104/mL接种于24孔板中,加入1.25 mmol/L诱导剂丁酸钠,对照组不加药。加药后3~5 d分别取各组细胞进行联苯胺染色。收集细胞,1 000 r/min,离心3 min;弃上清,加入1 mL 0.9%氯化钠注射液(0.85%)洗1次,去除残留培养基;加入预混的联苯胺染液:30%H2O2(50∶1,v∶v)100μL;滴片后镜检,统计联苯胺阳性细胞所占比例。
1.4 统计学分析
2 结果
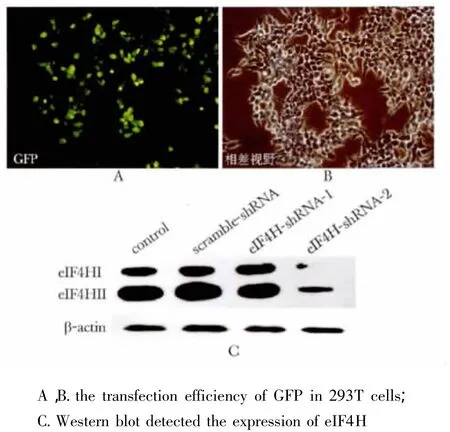
2.1 eIF4H蛋白低表达稳定株的建立
图1A和B显示转染效率较高。eIF4H基因通过选择性的剪接5位外显子产生两个蛋白亚型,亚型Ⅰ约27 ku,亚型Ⅱ约25 ku。图1 C显示与对照组相比eIF4H-shRNA-2组eIF4H两个亚型表达均下调。
2.2 eIF4H蛋白低表达抑制MEL细胞的增殖
与对照组和scramble-shRNA细胞相比,eIF4H-shRNA-2细胞生长明显受到抑制。对照组、scramble-shRNA和eIF4H-shRNA-1细胞在3 d时细胞生长达到平台期,在4 d时细胞生长受到抑制,而eIF4H-shRNA-2在4 d时才达到平台期(图2)。

2.3 eIF4H低表达阻碍了MEL细胞的周期进程
流式细胞术结果显示,eIF4H低表达后MEL细胞的周期G1期增加,S期减少,表明eIF4H低表达阻碍MEL细胞周期在G1期(图3)。
2.4 eIF4H低表达促进丁酸钠诱导MEL细胞红系分化
不加诱导剂丁酸钠时,两组细胞均检测不到联苯胺阳性细胞。当加入诱导剂丁酸钠处理后,eIF4H-shRNA-2组联苯胺阳性细胞明显高于scramble-shRNA组(p<0.01)(图4)。
3 讨论
蛋白质合成最主要的调控发生在翻译起始阶段,该过程需要多种eIF的调控。已发现一些eIF在肿瘤组织中是高表达的,eIF4E在多种癌细胞中高表达,过表达促进细胞增殖和成瘤[5]。eIF4G在肺癌中高表达[6]。RNA解旋酶eIF4A在黑色素瘤和肝癌中高表达[7-8]。eIF4H在结肠癌中高表达,其表达下调后抑制了结肠癌细胞系的增殖同时可诱导凋亡,这种抑制和诱导作用可通过cyclin D1的过表达来消除[9]。
eIF4H是一个重要的真核生物翻译起始因子,能够在蛋白质翻译的起始阶段促进核糖体向起始密码子扫描,从而加速蛋白质的合成。降低蛋白质的合成被认为与细胞增殖和分化有关。本研究通过慢病毒介导的RNA干扰技术成功下调了MEL细胞中eIF4H两个亚型的表达,为进一步探究eIF4H低表达对MEL细胞增殖和红系分化的影响提供了一个合适的细胞模型。MTT比色法和流式细胞术实验结果显示,eIF4H低表达后MEL细胞增殖能力明显受到抑制,同时细胞周期阻滞在G1期,这意味着eIF4H低表达介导了MEL细胞的恶性逆转。

图3 流式细胞术分析eIF4H低表达对MEL细胞周期的影响Fig 3 Flow cytometry analyzed the effect of eIF4H down-expression on the cell cycle of MEL cells
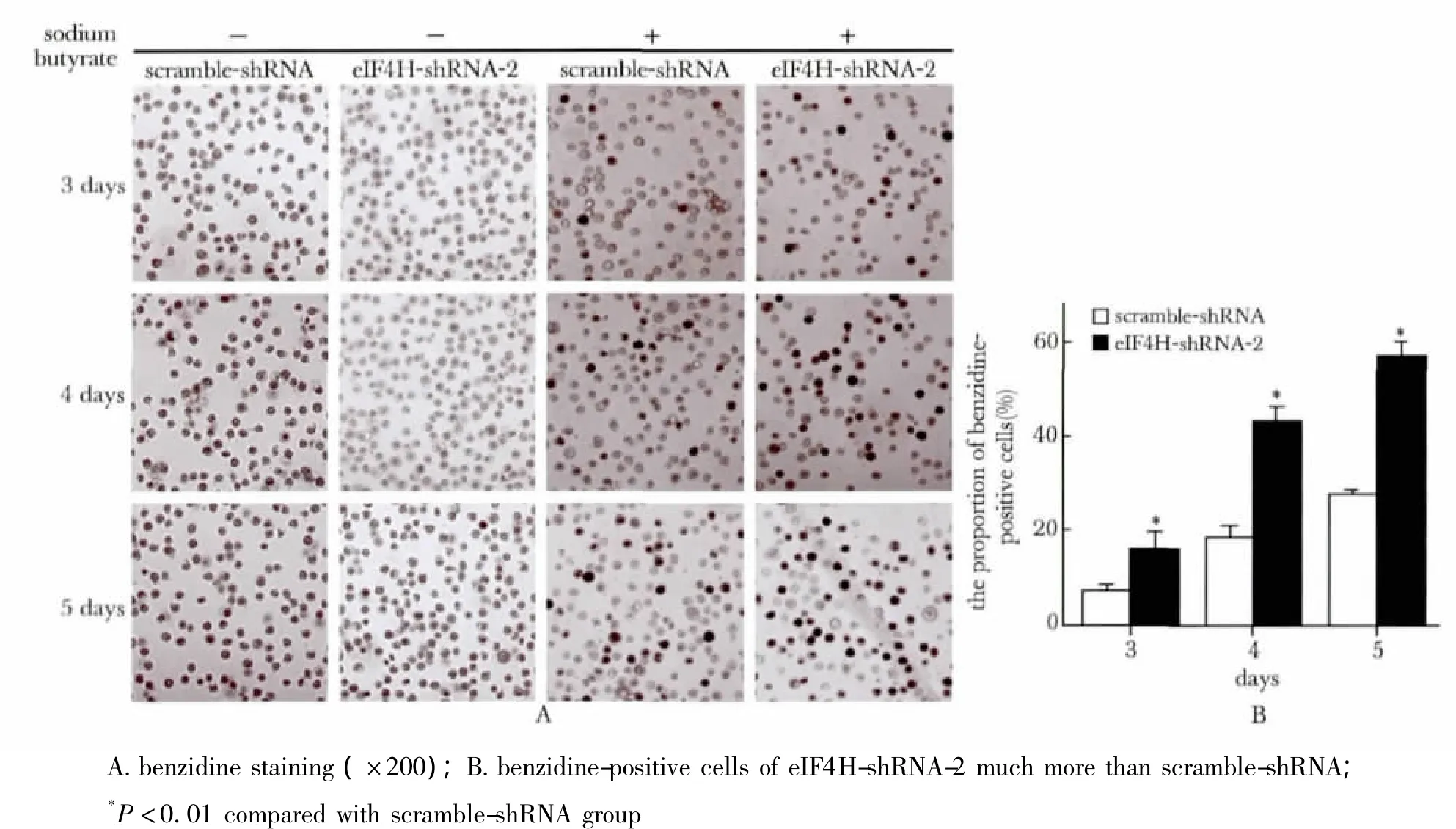
图4 联苯胺染色检测eIF4H低表达对丁酸钠诱导MEL细胞红系分化的影响Fig 4 Benzidine staining analyzed erythroid differentiation of MEL cells affect by eIF4H down-expressed
eIF4H低表达抑制了MEL细胞增殖的同时,是否会调控红系分化?本研究联苯胺染色结果显示,eIF4H低表达并不能诱导MEL细胞红系分化,但可促进丁酸钠诱导MEL红系分化。这可能是由于对红系分化的调控往往表现在表达量的变化和细胞定位的迁移两个层面,单一因素的改变并不能诱导MEL细胞红系分化。
总之,本研究明确了eIF4H低表达可抑制MEL细胞增殖,并可促进丁酸钠诱导MEL细胞红系分化,将为阐明白血病的发生和治疗提供新的理论依据。
[1]Pal S,Cantor AB,Johnson KD,et al.Coregulator-dependent facilitation of chromatin occupancy by GATA-1[J].Proc Nati Acad Sci U SA,2004,101:980-985.
[2]Rao G,Rekhtman N,Cheng G,et al.Deregulated expression of the PU.1 transcription factor blocks murine erythroleukemia cell terminal differentiation[J].Oncogene,1997,14:123-131.
[3]Jayapal SR,Lee KL,Ji P,et al.Down-regulation of Myc is essential for terminal erythroid maturation[J].J Biol Chem,2010,285:40252-40265.
[4]Richter-Cook NJ,Dever TE,Hensold JO,et al.Purification and characterization of a new eukaryotic protein translation factor.Eukaryotic initiation factor 4H[J].J Biol Chem,1998,273:7579-7587.
[5]Ruggero D,Montanaro L,Ma L,et al.The translation factor eIF-4E promotes tumor formation and cooperates with c-Myc in lymphomagenesis[J].Nat Med,2004,10:484-486.
[6]Bauer C,Diesinger I,Brass N,et al.Translation initiation factor eIF-4G is immunogenic,overexpressed,and amplified in patients with squamous cell lung carcinoma[J].Cancer,2001,92:822 -829.
[7]Eberle J,Krasagakis K,Orfanos CE.Translation initiation factor eIF-4A1 mRNA is consistently overexpressed in human melanoma cells in vitro[J].Int J Cancer,1997,71:396-401.
[8]Shuda M,Kondoh N,Tanaka K,et al.Enhanced expression of translation factor mRNAs in hepatocellular carcinoma[J].Anticancer Res,2000,20:2489 -2494.
[9]Tomonaga T,Matsushita K,Yamaguchi S,et al.Identification of altered protein expression and post-translational modifications in primary colorectal cancer by using agarose two-dimensional gel electrophoresis[J].Clin Cancer Res,2004,10:2007-2014.
