柞蚕蛹虫草水提物对人乳腺癌细胞MCF-7增殖和凋亡的影响
2014-12-07岳冬梅王林美李树英
岳冬梅 王林美 李树英
(辽宁省农业科学院大连生物技术研究所,辽宁大连 116024)
乳腺癌在我国发病率较高且近年来有逐渐增加的趋势[1],临床上治疗癌症主要采用放疗和化疗,其手段除了杀伤肿瘤细胞以外,对人体的免疫系统也会造成很大的伤害,因而寻找疗效好、副作用低的治疗药物是近年来科研工作者研究的热点之一[2]。蛹虫草菌寄生在鳞翅目、鞘翅目、双翅目等昆虫蛹体上生成的一种虫草混合体,隶属真菌门(Eumycota;Mycobionta)、子囊菌亚门(Ascomycotina)、麦角菌目(Clavicipitales)、麦角菌科(Clavicipitaceae)、虫草属(Cordyceps),是我国传统的名贵中药材,具有补肺益肾等多种功效,是扶正祛邪的良药之一。现代药理学研究证明,蛹虫草主要通过调节机体的免疫功能而发挥其生物学活性效应[3-4]。辽宁省农业科学院大连生物技术研究所柞蚕产品研发实验室成功地建立了以柞蚕蛹为宿主,大规模人工培育柞蚕蛹虫草的技术体系[5-6]。检测分析表明[7-10],柞蚕蛹虫草的化学成分、营养成分和药用功能与冬虫夏草非常相似,且虫草素等主要活性物质的含量高于野生冬虫夏草。目前,用蛹虫草治疗恶性肿瘤的研究已有报道[11-12],那么柞蚕蛹虫草水提物(Aqueous extract from cordycep militaris of antheraea pernyi,AEo-APC)体外抑制人乳腺癌细胞MCF -7 增殖及诱导凋亡的作用如何,我们对其进行了探讨,试验结果如下。
1 材料和方法
1.1 试验材料
试验材料:人乳腺癌细胞株MCF -7,由大连医科大学细胞实验室提供;柞蚕蛹虫草,由辽宁省农业科学院大连生物技术研究所虫草开发研究室培养提供。
主要试剂和仪器:RPMI - 1640 培养液,购自GIBCO 公司;胎牛血清,购自兰州民海生物工程有限公司;二甲基亚砜(DMSO),购自天津科密欧试剂公司;染色剂噻唑蓝(MTT),购自Sigma 公司。HERA cell 150 型CO2培养箱,上海一恒科学仪器有限公司产品;SW-CJ-1F 型超净工作台,苏州苏净集团产品;BIO -RAD 型酶标仪,奥地利Biocell 公司产品;LEICA DMI 3000 B 型相差倒置荧光显微镜,德国Leica 公司产品;JEM -1200EX 型透射电子显微镜,JEOL 公司产品;Anke TDL80 -2B 型台式离心机,上海安亭科学仪器厂产品产品;EPICS -XL 型流式细胞仪,COULTER 公司产品。
1.2 试验方法
1.2.1 柞蚕蛹虫草水提物的制备 取新鲜柞蚕蛹虫草子实体100 g 加水1 000 mL,匀浆后置70 ℃水浴浸提12 h,2 000 r/min 离心10 min,上清液用0.22 μm 滤膜过滤除菌,即得水提物(鲜草子实体100 g/L),4 ℃保存备用。
1.2.2 细胞培养 将人乳腺癌细胞株MCF -7 从-196 ℃液氮中取出,采用参考文献[13]中常规法复苏,添加含10%胎牛血清的RPMI -1640 培养液(pH 7.2~7.4)于37 ℃、5%CO2培养箱中培养,待细胞生长状态良好时进行传代。
1.2.3 AEoAPC 对人乳腺癌细胞MCF -7 增殖的抑制试验 采用MTT 比色检测的方法[14]。MTT 配制:称100 mgMTT 放入小烧杯中,加入20 mL 磷酸盐缓冲液(PBS,0.01 mol/L,pH7.4),磁力搅拌30 min,0.22 μm 微孔滤膜过滤除菌,4 ℃保存备用。将对数生长期的人乳腺癌细胞MCF-7 配成浓度为1 ×105个/mL 的细胞液,接种于96 孔细胞培养板中,每孔加入190 μL,于37 ℃、5%CO2培养箱中培养4 h。待细胞贴壁后分别加入质量浓度为0.1、0.2、0.5、0.8、1.0、2.0、5.0 g/L 的AEoAPC 10 μL,并设置空白孔调零、无菌蒸馏水阴性对照(CK),每个处理6个重复。在37 ℃、5%CO2培养箱中分别培养24、48、72 h 后,每孔加入5 mg/mL MTT 20 μL。继续孵育4 h 以后,每孔加入150 μL 二甲基亚砜溶解,室温振荡10 min,于全自动酶标仪检测每孔的OD(490 nm)值,计算人乳腺癌细胞MCF-7 生长抑制率(Inhibitory rate,IR)。
1.2.4 人乳腺癌细胞MCF -7 形态变化的观察倒置相差显微镜下观察未经处理和经AEoAPC 处理24、48、72 h 后的人乳腺癌细胞MCF-7 的形态学变化,透射电子显微镜下观察其细胞超微结构变化。
1.2.5 人乳腺癌细胞MCF -7 的凋亡和细胞周期检测 采用流式细胞术(Flow cytometry,FCM)检测法[15]。取对数生长期的人乳腺癌细胞MCF -7(5×105个/mL),加入1.0 g/L AEoAPC处理24、48、72 h 后,1 000 r/min 离心5 min,弃上清液,重新悬浮于1 mL、4 ℃预冷的固定液(固定液组成:1.1 g/L 葡萄糖、8.0 g/L NaCl、0.4 g/L KCl、0.39 g/L Na3PO4·12 H2O、0.15 g/L KH2PO4、0.08 g/L MgSO4·7H2O、0.16 g/L CaCl2·2H2O)中固定。缓慢加入-20 ℃预冷的95% 乙醇3 mL,使乙醇终浓度为75%,冰浴30 min,4 ℃保存。加入碘化丙啶(终浓度为50 μg/mL)和无DNA 酶污染的RNA 酶(终浓度为50 μg/mL)1 mL,染色0.5~1.0 h。流式细胞仪检测细胞凋亡和细胞周期,由大连市中心医院中心实验室完成。
1.3 数据计算与统计方法
IR(%)=1 -(加药组OD 值-调零组OD 值)/(阴性对照组OD 值-调零组OD 值)×100。数据统计处理采用SPSS 11.5 软件进行分析处理,用方差分析统计检验。
2 结果与分析
2.1 AEoAPC 对人乳腺癌细胞MCF -7 增殖的影响
将不同浓度的AEoAPC 处理人乳腺癌细胞MCF-7 24、48、72 h 后,本实验不同作用浓度下,试验结果显示,在0.8 g/L 浓度下对人乳腺癌细胞MCF-7 作用48 h 其抑制率更接近半数(55.4%),因此视最佳药物作用质量浓度为0.8 g/L,以该浓度的AEoAPC 处理人乳腺癌细胞MCF-7 24、48、72 h后,对人乳腺癌细胞MCF -7 的生长抑制率分别为32.6%、55.4%、86.6%。MTT 比色法显示,AEoAPC对人乳腺癌细胞MCF -7 有抑制作用,且在一定浓度范围内抑制率呈明显的时间剂量依赖性(表1)。
2.2 AEoAPC 对人乳腺癌细胞MCF -7 形态的影响
在倒置荧光显微镜下观察人乳腺癌细胞MCF-7,对照组的人乳腺癌细胞MCF -7 生长旺盛,形态完整,膜透明,大小均一,呈梭形贴壁生长(图1 -A1~A3);AEoAPC 处理组的人乳腺癌M 细胞MCF-7 生长受到抑制,细胞增长减缓。其中0.8 g/L AEoAPC 处理组单位面积的人乳腺癌细胞MCF -7数量逐渐减少,细胞间连接消失,并且随着用药时间的延长,人乳腺癌细胞MCF-7 数量明显减少,细胞颜色变暗,膜颜色加深,细胞形状不规则,梭形细胞减少,变圆(图1-B1~B3)。在透射电子显微镜下观察人乳腺癌细胞MCF -7,对照组的人乳腺癌细胞MCF -7细胞膜完整,细胞核和细胞器结构完整清晰,染色质分布均匀(图1 -C1);AEoAPC 处理组的人乳腺癌细胞MCF-7 的核染色质出现边集,胞质浓缩,内质网变疏松,胞膜完整但出现发泡现象(图1 -C2)。

表1 AEoAPC 对人乳腺癌细胞MCF-7 生长的抑制作用
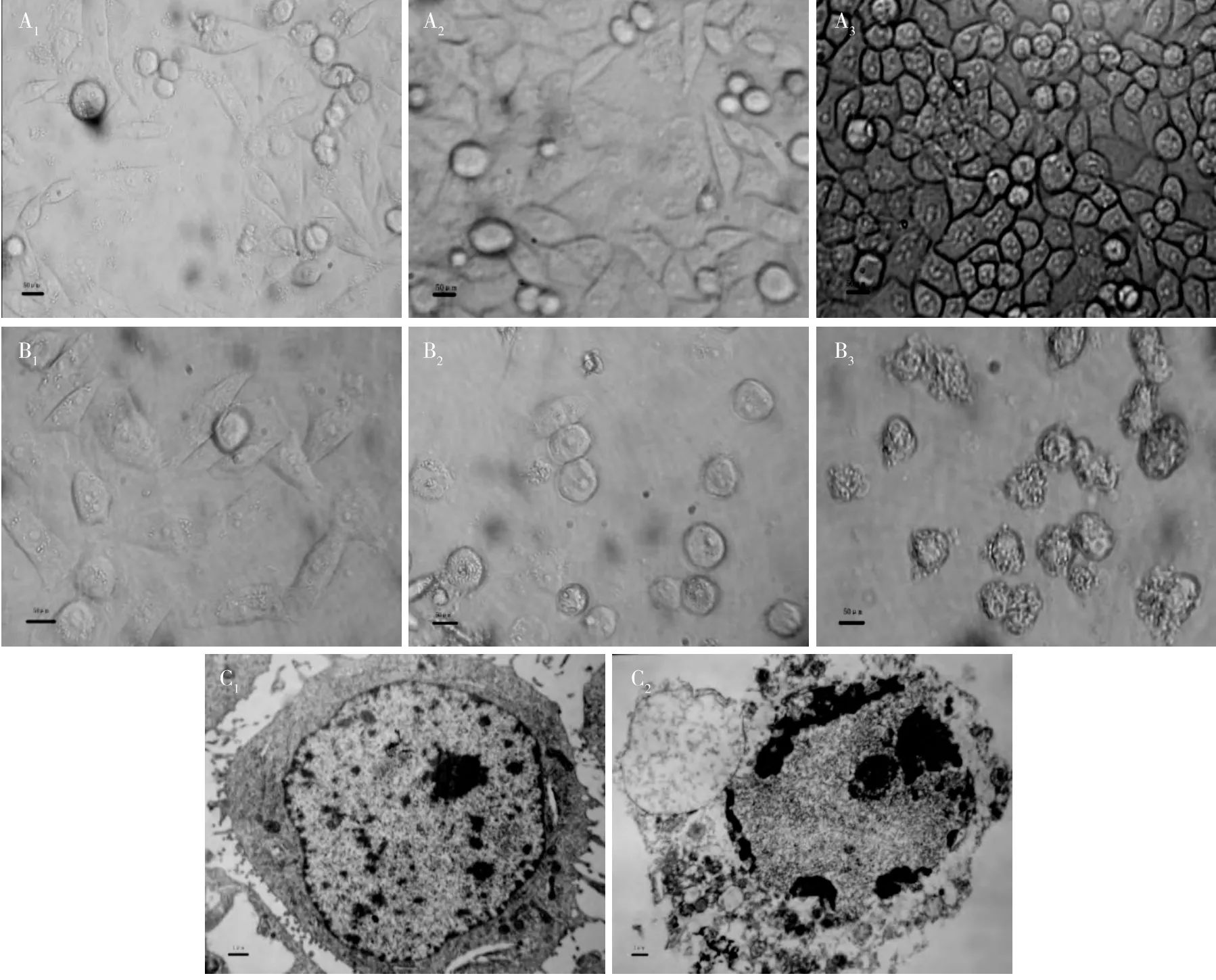
图1 AEoAPC 处理不同时间的人乳腺癌细胞MCF-7 形态观察
2.3 AEoAPC 对人乳腺癌细胞MCF -7 的周期和凋亡的影响
对照组的人乳腺癌细胞MCF -7 在培养24、48、72 h大多数处于G0-G1期(DNA 合成前期)及S期(DNA 合成期),G2-M 期(DNA 合成后期)最少,其凋亡率为1.27%;经0.8 g/L AEoAPC 处理的人乳腺癌细胞MCF -7 出现了被认为凋亡细胞的亚G0-G1期,其凋亡率随着AEoAPC 作用时间的延长而提高,在24、48、72 h 的凋亡率分别为8.65%、14.20%、26.30%。其AEoAPC 对人乳腺癌细胞MCF-7 周期的阻断效应见表2。

表2 经AEoAPC 诱导的人乳腺癌细胞MCF-7 在各细胞周期的细胞核DNA 含量及凋亡率
3 小结与讨论
乳腺癌是威胁女性健康的常见恶性肿瘤之一,其发病机制及治疗一直是临床亟待解决的重要课题,虽经多年研究,目前仍未找到有效的治疗手段。由于中药具有多途径、多靶点、毒副作用低等优点,从中药中寻找抗乳腺癌药物越来越成为广大临床医师的研究热点。AEoAPC 是从柞蚕蛹虫草中提取的有效组分,主要含有虫草素、腺苷等核苷类、多糖类、虫草酸、超氧化物歧化酶和硒类化合物,具有镇静、抗疲劳、抗肿瘤的作用,可增强机体的免疫功能[16]。近年来,有研究证明蛹虫草具有一定的抗肿瘤活性,对胃癌[17]、肝癌[18]、喉鳞癌[19]等均有一定的杀伤作用,但其抗肿瘤作用的确切机制尚不十分明确。
本研究加入浓度0.8 g/L AEoAPC 作用于人乳腺癌细胞MCF-7 后,分别于24、48、72 h 进行MTT比色实验和流式细胞术分析,MTT 比色结果显示,AEoAPC 对人乳腺癌细胞MCF -7 的体外增殖均有一定的抑制作用,与对照组比较,人乳腺癌细胞MCF-7 随着作用时间的延长,生存的数量明显减少;流式细胞术分析结果显示,随着药物作用时间的增加,G0-G1期的细胞分布明显增多,G2期和S 期细胞有所减少。证实AEoAPC 作用于人乳腺癌细胞MCF-7 时可改变细胞的增殖周期动力学,表现为G0-G1期比率上升,G2-S 期比率下降,阻滞肿瘤细胞S 期和G2期,使肿瘤分裂能力下降,使乳腺癌细胞增殖受到抑制,生长出现停滞。试验结果表明:AEoAPC 能显著抑制人乳腺癌细胞MCF -7 的增殖,诱导细胞凋亡,且在一定的浓度范围内呈时间和浓度依赖性。AEoAPC 细胞周期阻断效应是导致凋亡细胞增多的重要原因,这种阻断作用的增强可产生细胞同步化效应,为AEoAPC 在临床上与其他药物的联合应用以提高化疗效果提供了理论依据。
[1]卫文.城市女性乳腺癌发病率高[J]. 家庭医学,2005,(9):28-32.
[2]朱建平,蔡国友,沈子威.化学药物对肝癌细胞增殖抑制作用的观察[J].中华普通外科杂志,2001,16(1):28 -30.
[3]张力. 冬虫夏草的药理学研究进展[J]. 药学通报,1988,23(9):521 -528.
[4]张宏.冬虫夏草的免疫药理作用[J].中西医结合杂志,1994,10(9):570 -577.
[5]李亚洁,孟楠,石理鑫,等. 柞蚕蛹虫草高产栽培技术的研究[J].食用菌,2009,31(1):34 -35.
[6]都兴范,李亚杰,王林华,等.北冬虫夏草的研究发展现状[J].辽宁农业科学,2003,(4):26 -28.
[7]马冰如,何玲,张甲生,等.蚕蛹虫草与冬虫夏草化学成分的比较[J].中国食用菌,1994,13(1):34 -37.
[8]张显科,王玉柱,刘文霞. 蛹虫草与冬虫夏草化学成分比较[J].辽宁大学学报:自然科学版,1996,23(4):79 -82.
[9]彭国平,李红阳,袁永泰.冬虫夏草与人工蛹虫草的成分比较[J].南京中医药大学学报,1996,12(5):26 -28.
[10]李祥麟,石玉洁,黄檀溪. 略述北冬虫夏草生物流行性物质的应用(临床)试验研究[J].传染病药学,2003,13(4):l3 -l6.
[11]纪朋艳,罗速.中药蛹虫草的抗肿瘤活性及机制研究[J].北华大学学报,2005,6(4):324 -329.
[12]程萍,刘若英,刘杰麟. 戴氏虫草对人喉癌细胞生长抑制与诱导凋亡作用[J].陕西医学杂志,2007,36(6):643 -679.
[13]司徒镇强,吴军正.细胞培养[M]. 西安:世界图书出版公司,2004:78 -88.
[14]吕青,呈中,袁淑兰.MTT 法检测乳腺癌细胞对化疗药物敏感性的研究[J].四川医学,2001,22 (3):269 -273.
[15]Mosmann T. Rapid colorimetric assay for cellular growth and survival application to proliferation and cytotoxicity assays[J].J Immunol Methods,1983,65(1/2):55 -63.
[16]倪贺,李海航,黄文芳,等. 北虫草及其活性成分的研究与开发[J].科技导报,2007,25 (15):75 -79.
[17]王林美,都兴范,李学军,等. 蛹虫草对人胃癌细胞BGC -823生长抑制与诱导凋亡作用研究[J]. 中国微生态学杂志,2009,21(2):118 -121.
[18]王林美,都兴范,李学军,等. 柞蚕蛹虫草抑制人肝癌SMMC -7721 细胞增殖和诱导凋亡的作用[J].蚕业科学,2011,37(1):160 -164.
[19]程萍,刘若英,刘杰麟.戴氏虫草对人喉鳞癌细胞生长抑制与凋亡诱导作用[J].陕西医学杂志,2007,36(6):643 -645.
