miR-22通过靶向MTDH抑制胶质瘤细胞的生长
2014-12-06李荣国王剑杨少陵
李荣国 王剑 杨少陵
南华大学附属第一医院急诊科,湖南 衡阳 421001
miRNAs(miR)是一类长度约为22 nt的内源性 非编码单链小RNA分子,通过与靶基因mRNA的3’非编码区结合从而在转录后水平负性调控基因的表达[1]。由于大部分miR与靶结合位点不完全配对,因此,一个miR可调控多个靶点,或一个基因受多个miR的调控。研究表明,miR参与多种癌症的发生、发展,类似癌基因或抑癌基因样作用[2]。miR-22在多种肿瘤中表达失调,如在胃癌、肺癌、结肠癌及乳腺癌中表达下调[3-6],而在白血病和前列腺癌中表达上 调[7-8]。研究显示,MTDH在乳腺癌、肝癌、结肠癌以及膀胱癌中表达上调,存在癌基因样作用[9-12]。目前对于miR-22与MTDH在胶质瘤中的研究鲜见报道。本研究拟采用生物信息学靶基因预测软件、荧光素酶报告活性检测、实时定量PCR(quantitative real-time polymerase chain reaction,qRT-PCR)、蛋白质印迹法(Western blot)以及MTT法检测miR-22在胶质瘤中的生物学作用及作用机制。
1 材料和方法
1.1 病例资料
收集2009年1月—2012年12月南华大学附属第一医院收治的确诊为胶质瘤患者75例。其中男性49例,女性26例,中位年龄39(9~58)岁;其中病理分级Ⅰ级15例、Ⅱ级19例、Ⅲ级34例、Ⅳ级7例。病理诊断结果均经2名以上病理科医师确认。以17例正常大脑组织为对照组,均来自开颅手术的脑外伤患者。
1.2 主要材料
miR-22 mimics及scramble购自Ambion公司。MTDH siRNA质粒购自Santa cruz公司。MTDH 3’UTR的各种报告基因(Wild-MTDH-3’UTR vector,Mut-MTDH-3’UTR vector)由复能基因公司构建,双报告基因载体购自复能基因公司购买。双荧光素酶活性检测试剂盒购自Promega公司。MTDH抗体和β-actin抗体购自CST公司。TRIzol和LipofectamineTM2000转染试剂购自美国Invitrogen公司。RPMI-1640培养基和小牛血清购自Gibco公司。MTT粉购自美国Sigma 公司。
1.3 qRT-PCR检测
取适量组织,用R N A 提取试剂盒提取总R N A,逆转录合成c D N A。P C R 扩增反应为2 0 μ L 体系,包括:T a q D N A 聚合酶 (5 U/μL)0.2 μL,2×SYBR混合物10 μL,miRNA 逆转录产物2.0 μL,miR-PCR引物(5 μmol/L) 0.4 μL,灭菌蒸馏水7.4 μL。循环体系为:95 ℃ 3 min,95 ℃ 12 s,62 ℃ 35 s,72 ℃ 30 s,35个循环。以β-actin为内参,所测定的miR-22的相对表达量采用2-ΔΔCT法分析。
1.4 Western blot检测
将miR-22 mimics或MTDH siRNA质粒转染U251细胞,48 h后提取细胞总蛋白,BCA法测定蛋白浓度。各组取等量样本,进行SDS-PAGE凝胶电泳后将蛋白转移至PVDF膜上,5%脱脂牛奶封闭,加入MTDH抗体或β-actin抗体, 4 ℃过夜。TBST洗膜30 min,加入二抗室温温育1 h,TBST洗膜30 min,然后加ECL发光剂,X片曝光、显影、定影。
1.5 荧光素酶活性检测
将荧光素酶报告载体与miR-22 mimics或scramble mimics共转染U251细胞。转染48 h后,收集细胞。按照Promega公司双荧光素酶活性检测试剂盒说明书操作,在单光子检测仪检测细胞荧光素酶的活性。计算相对荧光素酶活性=萤火虫荧光素酶活性值/海肾荧光素酶活性值。
1.6 MTT法检测细胞增殖活性
消化转染细胞,接种于96孔板中,每孔 3 000个细胞,每组设5个复孔,于37 ℃、CO2体积分数为5%的培养箱中培养。在未接种细胞的孔中加入RPMI-1640中作调零孔。接种72 h后,每孔加20 μL MTT液,37 ℃温育4 h,用酶标仪测定570 nm波长吸光度值(A570)。实验重复3次。
1.7 统计学处理
采用SPSS 13.0软件进行统计学分析。所有结果均以±s 表示,两组间比较采用t检验,P<0.05为差异有统计学意义。
2 结 果
2.1 胶质瘤组织中miR-22表达水平的检测
提取胶质瘤组织和正常大脑组织中的总RNA,以U6 snRNA为内参采用qRT-PCR检测上述组织中miR-22的表达水平。选取1例正常大脑组织的miR-22的值为1,以2-ΔΔCt表示miR-22的表达水平,然后分析得到75例胶质瘤组织中miR-22的平均表达值为1.047±0.121,17例正常大脑组织中miR-22的平均表达值为12.263±0.142,差异有统计学意义(P<0.001, 图1)。

图1 qRT-PCR检测miR-22在胶质瘤和正常大脑组织中表达 变化Fig. 1 The expression of miR-22 in glioma tissues and the normal cerebrum tissues tested by qRT-PCR
2.2 miR-22表达水平与胶质瘤患者预后
进一步以胶质瘤组织中miR-22表达值的均数为临界值,miR-22表达值≥均数为高表达,<均数为低表达。结果显示,在75例胶质瘤组织中有46例(61.33%)miR-22低表达,26例(34.67%)高表达。通过对75例胶质瘤患者的亲属进行电话随访,最长随访42个月(3例胶质瘤患者失 访),经Kaplan-Meier生存曲线分析发现,在随访的患者中,46例miR-22低表达组中死亡28例(60.9%),而在26例miR-22高表达组中死亡8例(30.8%),miR-22高表达组总的生存率明显高于miR-22低表达组(P<0.05,图2),说明miR-22表达越高的胶质瘤患者生存时间越长,预后 越好。
2.3 miR-22对MTDH的3’UTR的荧光素酶活性的影响
运用生物信息学方法,通过在线预测软件(Targetscan and Miranda)预测发现miR-22与MTDH有共同的结合位点(图3A)。为进一步证实MTDH是否是miR-22的直接调控靶基因,运用荧光素酶报告基因检测其活性。结显显示,在胶质瘤U251细胞中共转染miR-22 mimics和野生型(Wt-miR-22/MTDH)或突变型(Mut-miR-22/MTDH)重组质粒。单光子检测发现,miR-22 mimics对突变型Mut-miR-22/MTDH质粒组荧光素酶活性强度无明显影响,但对野生型WtmiR-22/MTDH报告质粒组荧光素酶活性强度下降了约56%,差异有统计学意义(P<0.05, 图3B)。
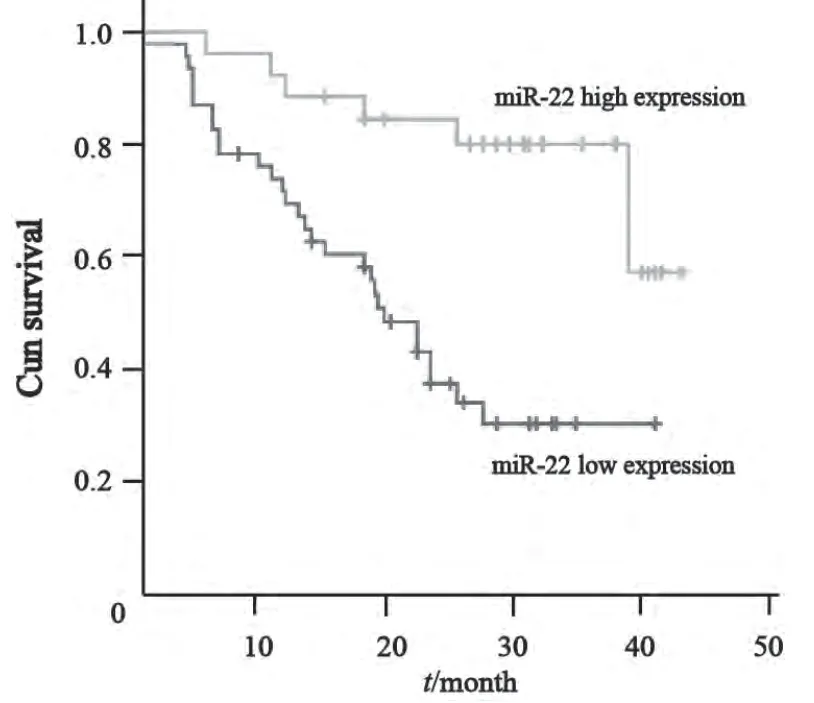
图2 Kaplan-Meier生存曲线分析miR-22表达与胶质瘤患者预后关系Fig. 2 The prognosis relationship between the levels of miR-22 and glioma patients by using Kaplan-Meier survival curves
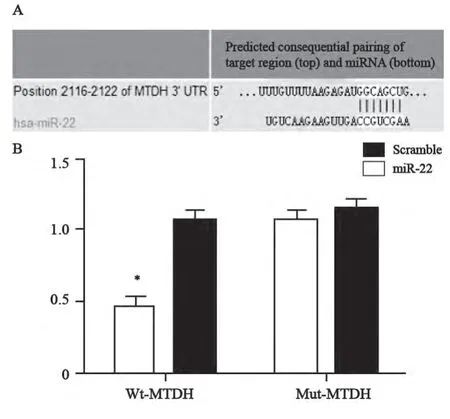
图3 MTDH是miR-22直接调控的靶基因Fig. 3 MTDH as a target gene of miR-22
2.4 miR-22对MTDH蛋白表达的影响
为了明确miR-22对MTDH的蛋白质表达的调控,将miR-22 mimics转染胶质瘤U251细胞,以转染miR-22-scramble为阴性对照,转染MTDH siRNA为阳性对照,转染48 h后收集蛋白。Western blot检测结果显示,转染miR-22组和MTDH siRNA组MTDH蛋白表达水平较阴性对照组明显降低(图4)。结果提示,在胶质瘤细胞系中miR-22能下调MTDH蛋白质的表达。
2.5 miR-22对胶质瘤细胞增殖能力的影响
分别将miR-22-mimics、miR-22-scramble (阴性对照组)和MTDH siRNA(阳性对照组)转入U251细胞48 h后,通过MTT法检测其对细胞增殖活性的影响。结果显示,转染MTDH siRNA和miR-22 mimics组U251细胞从48 h起增殖速度明显减慢,与miR-22 scramble对照组细胞相比,差异均有统计学意义(P<0.05,图5),提示高表达miR-22通过下调MTDH的表达,从而抑制U251细胞的增殖。
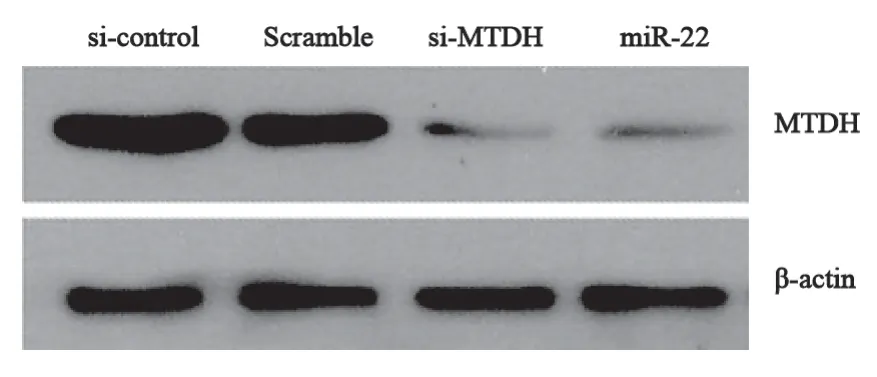
图4 Western blot检测miR-22对MTDH蛋白的影响Fig. 4 The expression of MTDH protein was tested by Western blot
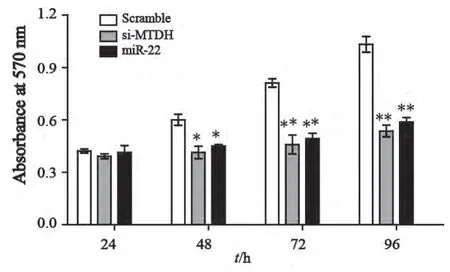
图5 MTT检测miR-22与MTDH siRNA对U251细胞增殖的影响Fig. 5 miR-22 and MTDH siRNA inhibited the proliferation of U251 cells was tested by MTT
3 讨 论
恶性胶质瘤是起源于胶质细胞的恶性肿瘤,也是脑肿瘤中最常见的类型。胶质瘤约占所有原发性脑肿瘤的80%,尽管目前治疗方案已有改进,但胶质瘤的死亡率仍较高,诊断后平均生存期为12~15个月[13-14]。胶质瘤主要的治疗方式以外科根治术加放化疗辅助治疗为主,放化疗辅助治疗的目的是阻滞细胞周期的演进以及促进肿瘤细胞的调亡[15]。然而,恶性胶质瘤的早期复发率高,其主要原因是肿瘤细胞对放化疗抵抗所致。因此亟待发现新的治疗 靶点。
越来越多的研究证实miRNA在多种生理和病理学过程中的作用发挥重要作用,并且与癌症的发生密切相关[2]。miR-22最初是在宫颈癌HeLa细胞中发现,并且作为一个抑癌基因,随后又有很多中研究者对miR-22在不同的肿瘤中的作用进行了研究。Tang等[3]研究证实miR-22在胃癌中表达下调,通过靶向调控Wnt信号通路抑制胃癌细胞的增殖并诱导调亡。Ling等[4]研究显示,miR-22通过靶向调控ErbB3的表达,抑制A549和H1299肺癌细胞株的增殖和侵袭能力,体外实验也表明,高表达miR-22能抑制裸鼠皮下肿瘤的生长,表明miR-22在肺癌中具有抑瘤作用。Zhang等[16]研究表明,miR-22在肝癌中表达下调,通过靶向HDAC4的表达抑制肝癌细胞的增殖和致瘤活性,并且Kaplan-Meier生存曲线分析显示,miR-22的表达越低,患者的预后越差。Li等[5]研究证实miR-22在结肠癌中表达下调,并且通过靶向TIAM1抑制人结肠癌HCT-116细胞的迁移和侵袭。
本研究通过qRT-PCR检测发现miR-22在胶质瘤组织中表达下调,且Kaplan-Meier生存分析发现,miR-22表达越低的胶质瘤患者其生存时间越短,预后越差。反之,miR-22表达越高的胶质瘤患者其生存时间越长,预后越好。我们通过荧光素酶报告载体和Western blot证实MTDH是miR-22直接调控的靶基因。MTDH最初在胎儿胶质细胞瘤中发现,是一个HIV诱导的基因,并且作为癌基因参与多种肿瘤的发生、发展。研究证实MTDH在乳腺癌、肝癌、结肠癌、膀胱癌、以及子宫内膜癌中表达上调,并且通过PI3K-AKT、NF-κB、MAPK以及Wnt/β-catenin信号途径参与肿瘤发生的多种生物学过程[9-12,17]。本研究还发现在U251细胞中过表达miR-22或干扰MTDH后能明显抑制U251细胞的增殖,表明miR-22可能通过下调MTDH的表达抑制胶质瘤细胞的增殖。
综上所述,miR-22在胶质瘤细胞中表达下调,并通过直接靶向调控MTDH的表达发挥抑瘤效应,miR-22/MTDH轴的证实为胶质瘤的治疗提供了新的治疗靶点。
[1]AMBROS V. microRNAs: tiny regulators with great potential[J]. Cell, 2001, 107(7): 823–826.
[2]TANG H, DENG M, TANG Y, et al. miR-200b and miR-200c as prognostic factors and mediators of gastric cancer cell progression[J]. Clin Cancer Res, 2013,19(20): 5602-5612.
[3]TANG H, KONG Y, GUO J, et al. Diallyl disulfide suppresses proliferation and induces apoptosis in human gastric cancer through Wnt-1 signaling pathway by up-regulation of miR-200b and miR-22[J]. Cancer Lett, 2013, 340: 72-81.
[4]LING B, WANG G X, LONG G, et al. Tumor suppressor miR-22 suppresses lung cancer cell progression through posttranscriptional regulation of ErbB3[J]. J Cancer Res Clin Oncol, 2012, 138(8): 1355-1361.
[5]LI B, SONG Y, LIU T J, et al. miRNA-22 suppresses colon cancer cell migration and invasion by inhibiting the expression of T-cell lymphoma invasion and metastasis 1 and matrix metalloproteinases 2 and 9[J]. Oncol Rep, 2013, 29(5): 1932-1938.
[6]XIONG J, YU D, WEI N, et al. An estrogen receptor alpha suppressor, microRNA-22, is down-regulated in estrogen receptor alpha-positive human breast cancer cell lines and clinical samples[J]. FEBS J, 2010, 277(7): 1684-1694.
[7]SONG S J, ITO K, ALA U, et al. The oncogenic microRNA miR-22 targets the TET2 tumor suppressor to promote hematopoietic stem cell self-renewal and transformation[J]. Cell Stem Cell, 2013, 13(1): 87-101.
[8]POLISENO L, SALMENA L, RICCARDI L, et al. Identification of the miR-106b 25 microRNA cluster as a proto-oncogenic PTEN-targeting intron that cooperates with its host gene MCM7 in transformation[J]. Sci Signal, 2010, 3(117): 29.
[9]TOKUNAGA E, NAKASHIMA Y, YAMASHITA N, et al. Overexpression of metadherin/MTDH is associated with an aggressive phenotype and a poor prognosis in invasive breast cancer[J]. Breast Cancer, 2014, 21(3): 341-349.
[10]ZHU K, DAI Z, PAN Q, et al. Metadherin promotes hepatocellular carcinoma metastasis through induction of epithelial-mesenchymal transition[J]. Clin Cancer Res, 2011, 17(23): 7294-7302.
[11]WANG N, DU X, ZANG L, et al. Prognostic impact of Metadherin-SND1 interaction in colon cancer[J]. Mol Biol Rep, 2012, 39(12): 10497-10504.
[12]ZHOU J, LI J, WANG Z, et al. Metadherin is a novel prognostic marker for bladder cancer progression and overall patient survival[J]. Asia Pac J Clin Oncol, 2012, 8(3): e42-e48.
[13]SRINIVASAN S, PATRIC I R, SOMASUNDARAM K. A ten-microRNA expression signature predicts survival in glioblastoma[J]. PLoS One, 2011, 6(3): e17438.
[14]VAN DEN BENT M J. Anaplastic oligodendroglioma and oligoastrocytoma[J]. Neurol Clin, 2007, 25(4): 1089-1109.
[15]BUTOWSKI N A, SNEED P K, CHANG S M. Diagnosis and treatment of recurrent high-grade astrocytoma[J]. J Clin Oncol, 2006, 24(8): 1273-1280.
[16]ZHANG J, YANG Y, YANG T, et al. microRNA-22, downregulated in hepatocellular carcinoma and correlated with prognosis, suppresses cell proliferation and tumourigenicity[J]. Br J Cancer, 2010, 103(8): 1215-1220.
[17]MENG X, BRACHOVA P, YANG S, et al. Knockdown of MTDH sensitizes endometrial cancer cells to cell death induction by death receptor ligand TRAIL and HDAC inhibitor LBH589 co-treatment[J]. PloS One, 2011, 6(6): e20920.
