从胚胎干细胞到视网膜
2014-12-06曹明哲陈舒怡
曹明哲 陈舒怡
胚胎干细胞(embryonic stem cell,ES细胞)是从胚胎发育初期囊胚的内细胞团(inner cell mass)分离出来,在体外培养形成的一类特殊的细胞。它们具有强大的增生能力,同时还具有形成机体所有类型细胞的巨大分化潜力。这两个特性使得ES细胞从发现之初就成为医学和生物学研究领域广受青睐的细胞[1-5]。近年来,诱导多能干细胞(induced pluripotent stem cell,iPS细胞)研究的飞速进展进一步推动了ES/iPS细胞的应用前景[6-11]。眼睛是人类认知世界的窗口,正常视功能是人们进行日常生活不可或缺的感官功能,每天有成千上万的人由于遗传、生理或环境等因素失去视力,严重影响患者的生活质量。医学的发展使得人类的平均寿命在不断提高,随之而来的是老年病发病率的不断攀升,青光眼、色素性视网膜炎、年龄相关视网膜黄斑变性等视网膜退行性疾病在老年人群中尤其普遍,严重影响老年人群的生活质量[12-13]。视网膜是人体再生能力很差的一类组织,成年机体无法自我更新那些病变中丢失的视网膜细胞,导致视网膜退行性病变的不可逆性。因此,引入外源细胞替代丢失的视网膜神经元成为恢复患者视觉的为数不多的潜在手段之一。此外,相对于血液系统、内脏器官,眼睛的移植排斥反应要弱得多。而且,眼科手术对全身干扰较小,并发症相对轻微,这些优点使得眼睛成为细胞替代治疗尝试的理想器官。要实现细胞替代治疗,探索合适、充足的供体细胞来源是重要的第一步。近年来,人们在探索将ES/iPS细胞体外定向诱导分化为视网膜神经元,甚至整个视网膜方面已取得多项进展。在此篇综述中,首先简要概括哺乳动物视网膜的组织结构、发育过程和调控机制,然后,重点阐述近年来科研工作者探索ES/iPS细胞体外诱导分化为视网膜细胞和组织的研究进展。
一、神经视网膜的结构和发育
哺乳动物的视网膜组织由神经视网膜和视网膜色素上皮层两大部分组成:视网膜色素上皮层是单层细胞结构,主要对神经视网膜起支持、营养和保护作用;神经视网膜层由多层细胞构成,是眼睛接收和初步处理光学信息的关键神经组织。神经视网膜层由七大类细胞构成:视锥细胞、视杆细胞、水平细胞、双极细胞、无长突细胞、Müller胶质细胞和视网膜神经节细胞。这七种细胞和它们的细胞连接有规律地排列形成三个细胞层和两个神经突触层:感受光学信号的视锥和视杆两种光感受器的细胞体形成最外面的外细胞核层(outer nuclear layer);对光感受器传来的光神经信号进行初步处理的三种中间神经元(水平细胞、双极细胞和无长突细胞)以及起支持作用的Müller胶质细胞的细胞体构成内细胞核层(inner nuclear layer);最内面靠近玻璃体的是神经节细胞层(ganglion cell layer);外细胞核层与内细胞核层细胞之间的神经突触构成外网层(outer plexiform layer);内细胞核层的中间神经元与神经节细胞之间的神经突触构成内网层(inner plexiform layer)。哺乳动物视网膜高度有序的组织排列从结构上保障了光信号的有效接收、传递和处理。
从发育角度来看,复杂的视网膜组织是中枢神经系统在身体头部位置向两侧的延伸:在神经胚芽阶段,中脑部位的神经管向两侧外伸,形成管状结构的视泡(optic vesicle)。当视泡接近胚胎表面外胚层的时候,组织迁移模式发生改变,开始向内凹陷,形成双层结构的视杯(optic cup)。视杯的外层是视网膜色素细胞层,内层是神经视网膜层。在视杯内凹的同时,与其相邻的胚胎外胚层也相应地向内凹陷,形成晶状体小泡(lens vesicle)。晶状体小泡继续内凹并与表面外胚层脱离,最终将形成晶状体,而晶状体小泡脱离后剩下的胚胎外胚层将发育成角膜上皮。这样,整个眼睛的大体结构就确立起来[14-17]。在视杯阶段,神经视网膜层是由假复层结构的视网膜前体细胞组成。视网膜前体细胞增生快速,并具有分化为所有类别视网膜细胞的潜能。视网膜的六种神经元与一种神经胶质细胞的分化是按照一定的时段顺序进行的,但彼此的分化时段又有一定的重合:视网膜神经节细胞在各类哺乳动物中都是最先分化的视网膜神经元;接着是无长突细胞、水平细胞和视锥细胞;最后是视杆细胞、双极细胞和Müller细胞。现普遍接受的观点认为,视网膜前体细胞在发育过程中逐步经历各种‘感受状态(competent state)’阶段。所谓的‘感受状态’是指视网膜前体细胞可以接受环境信号刺激向某种细胞发育的状态,也就是说,视杯发育早期的视网膜前体细胞只能被诱导分化成视网膜神经节细胞、无长突细胞等早期视网膜细胞,而视网膜发育晚期的前体细胞只能被诱导分化为视杆细胞、Müller细胞等晚期分化视网膜细胞。视网膜前体细胞的这种‘感受状态’表明视网膜细胞的增生和分化是受内源因素和外部环境共同调控的。各种遗传学、细胞和分子生物学研究也证实视网膜前体细胞的增生与分化是受各种转录因子和信号传导通路调控的[18-23]。对于视网膜发育基本过程和调控机制的深入了解有利于我们探寻眼科疾病的发病机制和治疗新途径(图1)。
二、ES/iPS细胞体外诱导分化成视网膜神经元

图1 视网膜发育过程
ES细胞具有强大的分化潜能:将小鼠ES细胞注射入早期胚胎中形成嵌合体,再将其移植入代孕母鼠子宫中后,ES细胞可以分化为包括视网膜组织在内的各种组织和细胞。然而,若要在体外将ES细胞特异性地诱导分化为视网膜神经元,如何在体外模拟体内视网膜细胞分化各阶段的环境是解决问题的关键。最初,人们尝试将ES细胞与胚胎发育阶段的视网膜组织共培养以模拟体内视网膜前体细胞分化环境[24-25],或与间充质细胞共培养[26],或过表达视网膜前体细胞关键调控转录因子,期待激活细胞的视网膜细胞转录基因组活性[27]。然而,这些方法所得到的细胞虽然表达某些视网膜细胞特异性基因,但是细胞形态和功能等方面与体内视网膜细胞相差很大。在人们探索诱导ES细胞向视网膜细胞分化的同时,多个研究组成功地在体外将ES细胞定向分化为神经细胞[28-30]。这些实验提示,在ES细胞分化初期抑制Wnt和Nodal信号通路可以促进神经外胚层的发育。视网膜是神经管在胚胎发育早期向两侧延伸继续发育而形成的神经组织。如果参照体内神经组织发育不同阶段对信号通路的需求,将体外初步发育的神经外胚层先向中脑组织命运状态诱导,再进一步诱导分化成视网膜细胞,有可能提高诱导分化效率。正是基于这样的思路,Ikeda等[31]通过向悬浮培养的小鼠ES细胞聚集团添加Dkk1来抑制Wnt信号通路,LeftyA来抑制Nodal信号通路,将ES细胞诱导分化为Six3+的中脑细胞。随后,他们再添加activin和血清,将Six3+中脑细胞继续培养,终于获得Rx+、Pax6+的视网膜前体细胞。如果将这些ES细胞分化而来的视网膜前体细胞与发育阶段的视网膜组织共培养,这些细胞可以分化为各种视网膜细胞,证明他们的前体细胞特性。紧接着,用类似的方法,Lamba等[32]将人ES细胞在体外也成功诱导分化为视网膜前体细胞。在人视网膜前体细胞的诱导方案中,LeftyA被Noggin取代来抑制BMP信号通路活性,另外IGF-1被用来激活胰岛素样信号通路。在这样的培养条件下,人ES细胞表达视网膜前体细胞特异性基因,包括 ET、Rx、Six3、Pax6、Lhx2、Optx2、Chx10和Sox2。同时,有些细胞表达视网膜神经元特异性蛋白,如无长突细胞特异性Hu C/D、神经节细胞特异性NF-M、双极细胞特异性α-PKC、光感受器特异性Crx、视锥细胞特异性S-Opsin、视杆细胞特异性Nrl和Rhodopsin。
虽然结合细胞聚集团悬浮培养,以及抑制Wnt和TGF-β信号通路可以有效地将ES细胞诱导分化为视网膜前体细胞,但是,在这些培养条件下,视网膜前体细胞分化为成熟视网膜细胞的效率非常低下。体外培养和小鼠遗传学实验都表明Notch信号通路抑制视网膜光感受器的发育[33-34]。为了提高ES细胞向光感受器分化的效率,Osakada等[35]对ES细胞向视网膜前体细胞诱导培养条件进行了优化。他们将经过Dkk1、LeftyA、activin和血清诱导分化的ES细胞通过细胞分选富集Rx+视网膜前体细胞,再添加DAPT来抑制Notch信号通路的活性。在DAPT的作用下,有20﹪的Rx+视网膜前体细胞分化为Crx+的光感受器前体细胞。如果将Crx+的光感受器前体细胞继续培养,约一半的细胞发育为视锥细胞,但是视杆细胞的比率非常低。为了提高视杆细胞的分化效率,Osakada等[35]向培养体系中添加了retinoic acid、aFGF、bFGF、taurine 和Shh多种促进视杆细胞发育的因子。在这些因子的作用下,有近20﹪的细胞最终分化为Rhodopsin+的视杆细胞。采用相似的培养体系,人和猴子的ES细胞可以被诱导分化为视网膜前体细胞和光感受器[35-36]。为了探索更适合临床治疗应用的人视网膜光感受器细胞制备方法,Takahashi研究组尝试用小分子化合物替代在细菌中合成的重组蛋白,来诱导视网膜细胞分化。他们用Casein激酶抑制剂-CKI-7替代Dkk1抑制Wnt信号通路,用SB-431542替代LeftyA抑制Nodal通路,在光感受器细胞分化阶段只保留retinoic acid和taurine两种小分子。研究结果表明,CKI-7和SB-431542两个小分子化合物完全可以取代Dkk1和LeftyA诱导视网膜前体细胞的分化。这种条件下得到的视网膜前体细胞在retinoic acid 和taurine的作用下也可以分化为光感受器细胞[37]。实际上,悬浮培养的ES细胞本身也会产生Dkk和Lefty,即使没有外源的Wnt和Nodal抑制剂,一部份的ES细胞也可以沿着视网膜发育的进程向视网膜细胞命运发展[38]。
ES细胞以其多能性而广受青睐,在体内它可以形成整个机体,然而,在体外ES细胞的分化大多限于单个细胞个体。2011年,Sasai研究小组在原有的视网膜细胞诱导分化的结果基础上,继续摸索优化培养条件,利用并不复杂的培养体系使小鼠ES细胞在体外自我组织形成了与体内视网膜组织极其相似的组织,成为ES细胞体外分化研究的突破性进展。他们发现在培养体系中添加细胞外基质成分,如Matrigel、Laminin或entactin,可以显著促进小鼠ES细胞向Rx+视网膜前体细胞分化。将这些Rx+细胞继续培养,原本形态均一的ES细胞团开始形成中空并具极性的神经上皮结构。令人惊讶的是,如果继续培养,中空的神经上皮开始向内凹陷形成与体内胚胎发育期的视杯十分相似的组织构造 :外层是 Mitf+、Pax6+、Coup-TF2+的单层视网膜色素上皮细胞,内层是增生活跃的Rx+、Pax6+、Six3+、Chx10+神经视网膜前体细胞层。更加令人惊讶的是,如果将这些视杯样组织分离出来继续培养,视杯样组织将发育成和新生小鼠的视网膜组织类似的包含有六种视网膜神经元(视网膜神经节细胞、无轴突细胞、水平细胞、双极细胞和两种感光细胞)和Müller胶质细胞,并且分层排列的组织结构[39]。不久以后,同一个研究小组成功地证明人的ES细胞在体外同样也可以自主组织形成视网膜组织[40]。人ES细胞体外自主形成视网膜组织的培养条件与小鼠ES细胞培养条件略有不同,形态发生进程不尽相同,所需时间也要长的多,这也显示出物种差别也影响组织体外发育进程。
三、利用ES/iPS细胞治疗视网膜疾病
英国的Ali研究组证明外源移植的视网膜细胞可以整合入小鼠视网膜组织中,分化为形态结构完全正常的视杆细胞。他们的研究表明,选择合适发育阶段的供体细胞是移植成功的决定因素之一。对于视网膜感光细胞来说,只有已经退出细胞周期但尚未终末分化的视杆前体细胞才能够成功整合入视网膜外细胞核层并分化为成熟视杆细胞[41]。接着,他们证明这些移植的视杆细胞与受体小鼠的双极细胞和水平细胞形成神经突触连接,能够对暗光刺激形成神经电生理反应,所形成的电生理信号能够一直传至大脑视觉中枢,形成视觉反射[42-43]。与视杆细胞类似,成功视锥细胞移植也需要选择刚刚退出细胞周期的视锥前体细胞[44]。最近有研究表明,成熟的视杆细胞也可以被成功移植并整合入体内视网膜外细胞核层中[45],这大大扩展了可被移植的供体细胞范围。光感受器移植实验有力地证明细胞移植治疗视网膜感光细胞退行性疾病的技术可行性。
如前所述,多个研究已实现在体外将人ES细胞高效定向诱导分化为视网膜前体细胞,并能进一步形成视网膜光感受器。结合ES细胞体外培养技术、光感受器前体细胞移植技术,人们开始测试是否可以用ES细胞治疗光感受器退行性疾病。出于伦理考虑,这些探索性实验多是在正常小鼠或光感受器退行性病变模型小鼠中进行。Reh研究小组用他们之前发表的诱导方法[32]将人ES细胞在体外分化为视网膜细胞,然后移植入小鼠眼内。如果进行玻璃体腔移植,体外分化的人视网膜细胞可以整合入小鼠视网膜各个细胞层中,并表达相应层细胞的标志性基因,但光感受器的整合分化在这种移植方式下都比较低,如果移植入视网膜下腔,体外分化的人视网膜细胞大多整合入外细胞核层,并分化为成熟的光感受器细胞[46]。但奇怪的是,由小鼠ES细胞体外分化的光感受器细胞反而不能整合入小鼠视网膜组织中[47]。这两个实验结果的差异可能反映了物种的差异,也可能是由于体外培养方法或移植方式的差别造成的。但是,如果用体外3D培养的方法先培养出视网膜组织,再从培养视网膜组织中纯化光感受器前体细胞,这样获得的小鼠细胞可以有效地整合入小鼠外细胞核层中[48]。异体细胞移植都会面临免疫排斥反应,人ES细胞来源十分有限,且存在伦理颈瓶。这两方面的问题极大限制ES细胞替代治疗应用前景。Yamanaka研究组诱导多能干细胞(iPS)的开创性的研究成果缓解了困扰ES细胞研究的医学伦理问题和移植免疫排斥问题[6-7]。现在人们已经能够将包括血液、内脏器官、神经组织,甚至是尿液中提取的细胞诱导重编程为多能干细胞[8-11],使得这项技术的应用越来越广泛。在人们探索出将ES细胞诱导分化为视网膜细胞或组织,以及光感受器移植治疗视网膜退行性疾病的有效方案后,人们将这些研究成果也应用于iPS细胞上,证实iPS细胞同样可以被有效地诱导分化为视网膜细胞和组织[36-38,49-51],并用来治疗视网膜退行性疾病[49,52],这大大扩展了应用ES/iPS细胞治疗视网膜疾病的前景(图2)。
四、总结
ES/iPS细胞由于其强大的增生和分化能力成为细胞替代疗法的理想的供体细胞。通过长期的探索,现在人们已经能够将ES/iPS细胞诱导分化为视网膜细胞,甚至是整个视网膜组织。现有的研究已经显示由ES/iPS细胞体外形成的视网膜细胞具有细胞替代治疗视网膜退行性疾病的潜力。然而,要实现ES/iPS细胞替代疗法治疗视网膜退行性疾病,仍有许多问题需要解决。例如,对于特定的视网膜细胞,体外诱导分化的效率仍有待提高,特别是视网膜神经节细胞至今仍缺乏高效诱导方案,虽然,光感受器细胞已可以被成功移植并整合入视网膜组织中,但人光感受器细胞的整合效率仍然低下,视网膜神经节细胞的整合结果更加差强人意,ES/iPS细胞替代疗法伴随的风险是残留的干细胞会导致眼内肿瘤的发生,如何掌握体外分化时程,纯化筛选视网膜细胞,监测排除干细胞是实现临床应用必须考虑的问题。
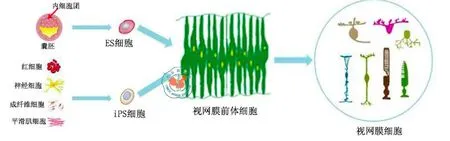
图2 ES/iPS细胞可以逐步诱导分化为视网膜前体细胞,进而发育形成各种视网膜神经元
1 Evans MJ ,Kaufman MH.Establishment in culture of pluripotential cells from mouse embryos[J].Nature,1981,292(5819):154-156.
2 Martin GR.Isolation of pluripotent cell line from early mouse embryos cultured in medium conditioned by teratocarcinoma stem cells[J].Proc Natl Acad Sci U S A,1981,78(12):7634-7638.
3 Bradley A,Evans M, Kaufman MH,et al.Formation of germ-line chimaeras from embryo-derived teratocarcinoma cell lines[J].Nature,1984,309(5965):255-256.
4 Thomson JA,Itskovitz-Eldor J,Shapiro SS,et al.Embryonic stem cell lines derived from human blastocysts[J].Science,1998,282(5391):1145-1147.
5 Daley GQ.Prospects for stem cell therapeutics: myths and medicines[J].Curr Opin Genet Dev,2002,12(5):607-613.
6 Takahashi K,Yamanaka S.Induction of pluripotent stem cells from mouse embryonic and adult fibroblast cultures by defined factors[J].Cell,2006,126(4):663-676.
7 Takahashi K,Tanabe K,Ohnuki M,et al.Induction of pluripotent stem cells from adult human fibroblasts by defined factors[J].Cell,2007,131(5):861-872.
8 Hanna J,Markoulaki S,Schorderet P,et al.Direct reprogramming of terminally differentiated mature B lymphocytes to pluripotency[J].Cell,2008,133(2):250-264.
9 Aoi T,Yae K,Nakagawa M,et al.Generation of pluripotent stem cells from adult mouse liver and stomach cells[J].Science,2008,321(5889):699-702.
10 Stadtfeld M,Brennand K,Hochedlinger K.Reprogramming of pancreatic beta cells into induced pluripotent stem cells[J].Curr Biol,2008,18(12):890-894.
11 Kim JB,Zaehres H,Wu G,et al.Pluripotent stem cells induced from adult neural stem cells by reprogramming with two factors[J].Nature,2008,454(7204):646-650.
12 de Jong PT.Age-related macular degeneration[J].N Engl J Med,2006,355(14):1474-1485
13 Varma R,Lee PP,Goldberg I,et al.An assessment of the health and economic burdens of glaucoma[J].Am J Ophthalmol,2011,152(4):515-522.
14 Martinez-Morales JR,Wittbrodt J.Shaping the vertebrate eye[J].Curr Opin Genet Dev,2009,19(5):511-517.
15 Chow RL,Lang RA.Early eye development in vertebrates[J].Annu Rev Cell Dev Biol,2001,17:255-296.
16 Adler R,Canto-Soler MV.Molecular mechanisms of optic vesicle development: complexities,ambiguities and controversies[J].Dev Biol,2007,305(1):1-13.
17 Fuhrmann S.Eye morphogenesis and patterning of the optic vesicle[J].Curr Top Dev Biol,2010,93:61-84.
18 Esteve P,Bovolenta P.Secreted inducers in vertebrate eye development: more functions for old morphogens[J].Curr Opin Neurobiol,2006,16(1):13-19.
19 Agathocleous M,Harris WA.From progenitors to differentiated cells in the vertebrate retina[J].Annu Rev Cell Dev Biol,2009,25:45-69.
20 Cayouette M,Poggi L,Harris WA.Lineage in the vertebrate retina[J].Trends Neurosci,2006,29(10):563-570.
21 Cepko CL,Austin CP,Yang X,et al.Cell fate determination in the vertebrate retina[J].Proc Natl Acad Sci U S A,1996,93(2):589-595.
22 Harada T,Harada C,Parada LF.Molecular regulation of visual system development: more than meets the eye[J].Genes Dev,2007,21(4):367-378.
23 Xiang M.Intrinsic control of mammalian retinogenesis[J].Cell Mol Life Sci,2013,70(14):2519-2532.
24 Zhao X,Liu J,Ahmad I.Differentiation of embryonic stem cells into retinal neurons[J].Biochem Biophys Res Commun,2002,297(2):177-184.
25 Sugie Y,Yoshikawa M,Ouji Y,et al.Photoreceptor cells from mouse ES cells by co-culture with chick embryonic retina[J].Biochem Biophys Res Commun,2005,332(1):241-247.
26 Hirano M,Yamamoto A,Yoshimura N,et al.Generation of structures formed by lens and retinal cells differentiating from embryonic stem cells[J].Dev Dyn,2003,228(4):664-671.
27 Tabata Y,Ouchi Y,Kamiya H,et al.Specification of the retinal fate of mouse embryonic stem cells by ectopic expression of Rx/rax,a homeobox gene[J].Mol Cell Biol,2004,24(10):4513-4521.
28 Watanabe K,Kamiya D,Nishiyama A,et al.Directed differentiation of telencephalic precursors from embryonic stem cells[J].Nat Neurosci,2005,8(3):288-296.
29 Ying QL,Stavridis M,Griffiths D,et al.Conversion of embryonic stem cells into neuroectodermal precursors in adherent monoculture[J].Nat Biotechnol,2003,21(2):183-186.
30 Aubert J,Dunstan H,Chambers I,et al.Functional gene screening in embryonic stem cells implicates Wnt antagonism in neural differentiation[J].Nat Biotechnol,2002,20(12):1240-1245.
31 Ikeda H,Osakada F,Watanabe K,et al.Generation of Rx+/Pax6+ neural retinal precursors from embryonic stem cells[J].Proc Natl Acad Sci U S A,2005,102(32):11331-11336.
32 Lamba DA,Karl MO,Ware CB,et al.Efficient generation of retinal progenitor cells from human embryonic stem cells[J].Proc Natl Acad Sci U S A,2006,103(34):12769-12774.
33 Yaron O,Farhy C,Marquardt T,et al.Notch1 functions to suppress cone-photoreceptor fate specification in the developing mouse retina[J].Development,2006,133(7):1367-1378.
34 Jadhav AP,Mason HA,Cepko CL.Notch 1 inhibits photoreceptor production in the developing mammalian retina[J].Development,2006,133(5):913-923.
35 Osakada F,Ikeda H,Mandai M,et al.Toward the generation of rod and cone photoreceptors from mouse,monkey and human embryonic stem cells[J].Nat Biotechnol,2008,26(2):215-224.
36 Boucherie C,Mukherjee S,Henckaerts E,et al.Brief report:self-organizing neuroepithelium from human pluripotent stem cells facilitates derivation of photoreceptors[J].Stem Cells,2013,31(2):408-414.
37 Osakada F,Jin ZB,Hirami Y,et al.In vitro differentiation of retinal cells from human pluripotent stem cells by small-molecule induction[J].J Cell Sci,2009,122(17):3169-3179.
38 Meyer JS,Shearer RL,Capowski EE,et al.Modeling early retinal development with human embryonic and induced pluripotent stem cells[J].Proc Natl Acad Sci U S A,2009,106(39):16698-16703.
39 Eiraku M,Takata N,Ishibashi H,et al.Self-organizing optic-cup morphogenesis in three-dimensional culture[J].Nature,2011,472(7341):51-56.
40 Nakano T,Ando S,Takata N,et al.Self-Formation of Optic Cups and Storable Stratified Neural Retina from Human ESCs[J].Cell Stem Cell,2012,10(6):771-785.
41 MacLaren RE,Pearson RA,MacNeil A,et al.Retinal repair by transplantation of photoreceptor precursors[J].Nature,2006,444(7116):203-207.
42 Pearson RA,Barber AC,Rizzi M,et al.Restoration of vision after transplantation of photoreceptors[J].Nature,2012,485(7396):99-103.
43 Barber AC,Hippert C,Duran Y,et al.Repair of the degenerate retina by photoreceptor transplantation[J].Proc Natl Acad Sci U S A,2013,110(1):354-359.
44 Lakowski J,Baron M,Bainbridge J,et al.Cone and rod photoreceptor transplantation in models of the childhood retinopathy Leber congenital amaurosis using flow-sorted Crx-positive donor cells[J].Hum Mol Genet,2010,19(23):4545-4559.
45 Gust J,Reh TA.Adult donor rod photoreceptors integrate into the mature mouse retina[J].Invest Ophthalmol Vis Sci,2011,52(8):5266-5272.
46 Lamba DA,Gust J,Reh TA.Transplantation of human embryonic stem cell-derived photoreceptors restores some visual function in Crx-deficient mice[J].Cell Stem Cell,2009,4(1):73-79.
47 West EL,Gonzalez-Cordero A,Hippert C,et al.Defining the integration capacity of embryonic stem cell-derived photoreceptor precursors[J].Stem Cells,2012,30(7):1424-1435.
48 Gonzalez-Cordero A,West EL,Pearson RA,et al.Photoreceptor precursors derived from three-dimensional embryonic stem cell cultures integrate and mature within adult degenerate retina[J].Nat Biotechnol ,2013,31(8):741-747.
49 Lamba DA,McUsic A,Hirata RK,et al.Generation,purification and transplantation of photoreceptors derived from human induced pluripotent stem cells[J].PloS one,2010,5(1):e8763.
50 Chen M,Chen Q,Sun X,et al.Generation of retinal ganglion-like cells from reprogrammed mouse fibroblasts[J].Invest Ophthalmol Vis Sci,2010,51(11):5970-5978.
51 Hirami Y,Osakada F,Takahashi K,et al.Generation of retinal cells from mouse and human induced pluripotent stem cells[J].Neurosci Lett,2009,458(3):126-131.
52 Tucker BA,Park IH,Qi SD,et al.Transplantation of adult mouse iPS cell-derived photoreceptor precursors restores retinal structure and function in degenerative mice[J].PloS one,2011,6(4):e18992.
