我院2014年第二季度药品不良反应事件监测数据分析
2014-12-04钟燕于杰
钟燕 于杰
随着药品不良反应(ADR)监测报告工作不断完善与深入,根据《药品不良反应报告和监测管理办法》的要求,本院对2014年第二季度药品不良反应监测报告工作进行总结性分析,为指导临床合理用药提供保障,现报道如下[1]。
1 资料与方法
1.1 一般资料 收集本院2014年4月-2014年6月整理上报的102例药品不良反应患者,其中严重的有1例,一般的有101例。
1.2 方法 运用Excel和SPSS软件对102例ADR监测数据的临床表现、药品不良反应事件中的药物种类、用药途径、患者的年龄和性别等情况进行分析[2]。
2 结果
2.1 药品不良反应的分类和临床表现 本院102例不良反应事件患者多为皮肤及附件的损害,占48%,这主要是因为其所表现的症状易于发现;其次为消化系统反应,这主要是因为患者主诉方便,见表1。
2.2 药品不良反应涉及的药物种类 本院102例ADR患者涉及的药物主要为抗感染药物,占44%,这与抗感染药物广泛应用有关,其中左氧氟沙星、头孢唑林和阿奇霉素较多,左氧氟沙星的不良反应主要表现为皮肤反应,可能原因为左氧氟沙星在静滴时速度过快引起,建议静滴左氧氟沙星每100 mL应在1 h左右。阿奇霉素主要表现为胃肠道反应,可能原因与药物应用时间较长有关,阿奇霉素半衰期较长,建议最长用药时间不要超过7 d。头孢唑啉为青霉素类,主要为皮肤反应。其次为中成药和抗肿瘤药物,中成药主要体现为七叶皂苷钠和红花针;抗肿瘤药物为顺铂,在应用过程中应注意,见表2。
2.3 不同的给药途径与ADR的关系 本院102例不良反应患者的药品给药方式,静脉给药为91例(89%),肌肉给药为1例(1%),口服为9例(9%),其他1例(1%)。这主要是因为静脉给药,药物直接进入血液,无首过效应,故其药效和不良反应较口服给药迅速而强烈;其次,静脉滴注对药物的质量要求高,药物本身的pH值、微粒、内毒素、赋形剂等都有可能成为ADR的诱因,尤其是输液中的不溶性微粒可造成局部循环障碍,引起血管栓塞和局部供血不足,进而导致组织缺氧,产生水肿和静脉炎等[3-5]。因此,世界卫生组织提倡在临床药物治疗中应遵循口服优先原则,尽量减少静脉滴注,确实需要静脉给药者,应尽量避免剂量过大、浓度过高、速度过快,尤其是对一些刺激性较大的药物更应慎重。因此,建议临床医生根据患者病情,能口服给药达到治疗目的的,原则上就不使用静脉给药,能以小剂量给药的,不要以大剂量一次给药,从而减少不必要的药品不良反应的发生。

表1 ADR的分类和临床表现

表2 ADR涉及的药物种类
2.4 ADR与患者年龄及性别的关系 从本图中可以看出,ADR所报告的102例中,50岁以上患者所占比例最大,明显高于其他人群,这与老年人患有多种疾病,合并用药较多,身体各脏器功能减退、药物代谢速度减慢,对药物的耐受程度及安全幅度明显下降,易发生药物蓄积有关。其次为婴幼儿,这类人群器官发育不完全,也易造成器官蓄积。男女患者不良反应发生率相比,相差不大,无分析可比性。所以老年人和婴幼儿患者一定要遵循个体化原则,注意药物的相互作用及可能出现的ADR及时处理,减少ADR的发生,见图1。
3 讨论
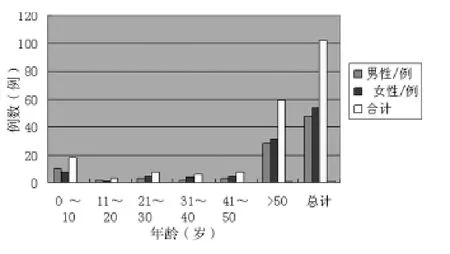
图1 患者各年龄段及性别分布构成比
3.1 药品不良反应产生的主要原因 (1)患者本身特异质反应,这就要求医护人员在问病史时一定要明确患者是否有过敏的药物,需要做皮试的药物一定要做皮试。(2)药品方面的问题。(3)不合理用药,在本院主要问题是用药时间较长,导致血药浓度大幅增高引起不良反应,例如某患者,阿奇霉素用药7 d后,出现胃肠道不适,分析原因可能为阿奇霉素半衰期>40 h,用药7 d造成血药浓度增高,引起不良反应。(4)药物配置不规范,由于药品配置过程和配置环境等综合因素,也可能造成药品的不良反应。(5)一些药品输液速度过快也可能引起药品的不良反应[6-8]。
3.2 预防及对策 药品不良反应关乎患者的生命安全,要加强药品管理,管理好院内用药过程,首先,要端正态度,提高认识,认真学习药品处方集和药品说明书,对有特殊用药要求的药品要认真掌握。第二,要进一步净化配液环境,尽量减少人为因素;提高药品的贮存环境。第三,要及时对本院不良反应事件进行分析,为临床提供有价值的信息。
综上所述,药品不良反应(ADR)是指在疾病诊断、预防和治疗过程中,按药品剂量和药品给药方法要求常规用药但发生治疗目的无明显相关性的损伤性反应[8-11]。开展药品不良反应监测不仅应国家卫生部门要求,更重要的是预防药品不良反应和事件的发生,扩散,避免医疗事故的发生,避免医院的经济损失,为临床合理安全用药提供指导。
[1]卫生部.药品不良反应报告和监测管理办法[Z].卫生部令第81号,2011-05-04.
[2]王南松,周学琴,王立军.459例药品不良反应报告分析[J].中国医院药学杂志,2009,29(13):1137-1138.
[3]郑策,梅丹,王兰,等.关注制剂辅料的ADR[J].中国药学杂志,2005,40(9):44-45.
[4]严瑾,邵蓉.中美药品不良反应/事件监测报告内容对比与启示[J].广东药学院学报,2014,30(1):70-76.
[5]宁卉,周秋峰,庄洁.某三甲医院2012年244例药品不良反应报告分析[J].药品评价,2013,8(18):85-87.
[6]朱安祥,尤传萍,汪涛.366例药品不良反应报告分析[J].中国医院用药评价与分析,2014,14(4):81-83.
[7]黄德芳,刘伟光.本院106例药品不良反应的临床分析[J].国际医药卫生导报,2009,15(5):104-106.
[8]谢华,王荣,贾正平,等.药品不良反应监测分析及医院合理用药对策[J].中国医院用药评价与分析,2013,13(8):35-38.
[9]陈海云.474例抗肿瘤药品不良反应/事件报告分析[J].中国药物警戒,2013,10(11):78-79.
[10]胡伟,慈静.2011-2012年420例药品不良反应报告分析[J].中国医院用药评价与分析,2014,14(3):43-45.
[11]肖凌,赵继红,沈司京.268例药品不良反应报告分析[J].中国医院用药评价与分析,2013,13(8):48-50.
