HBXIP与血管异常增生性皮肤病进展
2014-12-04唐嫕文张理涛
唐嫕文,张理涛
(1.天津中医药大学,天津300193;2.天津市中医药研究院附属医院,天津300120)
乙型肝炎X相互作用蛋白(HepatitisBX-interacting protein,HBXIP),是一种保守的细胞组成型蛋白,最初于1997年由Melegari等[1]采用酵母双杂交技术从肝癌细胞株HepG2中发现。其在所有的脊椎动物物种中都发现有密切的同源基因,并且在心、肝、肾、胰腺和骨骼肌等组织中广泛表达。
结构与功能:Garcia-Saez等[2]发现HBXIP是一个二聚体,由两个亚基和10个反向平行链组成。HBXIP由91个氨基酸编码,分子质量为9.6 ku,通过与乙型肝炎X蛋白(Hepatitis B X protein,HBx)C末端结合,来负调控HBX蛋白的活性,并改变乙型肝炎病毒(Hepatitis B virus,HBV)的病毒复制周期[3-4]。HBXIP还能够与人ATP依赖的RNA/DNA解旋酶hSuv3p结合,而HBXIP的结合部位对于该酶线粒体的导入与结构稳定是非常重要的[5]。
1 HBXIP在细胞周期中的作用
HBXIP在细胞周期中能够促进细胞增殖,而其过表达又可造成细胞变异。
1.1 HBXIP促进细胞增殖 经学者研究发现[6-9]HBXIP促进细胞的增殖主要表现在以下4个环节:(1)HBXIP是 survivin的辅助因子,HBXIP与survivin形成survivin-HBXIP复合体,此复合体与pro-caspase-9连接,抑制pro-caspase-9的激活,并且防止其与Apaf1结合,从而通过线粒体/细胞色素c途径选择性抑制细胞凋亡;(2)survivin-HBXIP复合体有助于有丝分裂检验点蛋白BubR1着丝,从而促进有丝分裂;(3)端粒能维持染色体末端稳定性,防止其降解、融合、重排和DNA丢失。端粒随DNA复制进行性短缩而最终细胞死亡,然而端粒酶活性升高可以维持端粒长度,使细胞具有永生性。端粒酶的水平由端粒酶催化亚基和端粒酶逆转录酶在转录和转录后调节。HBXIP显著刺激人类端粒酶催化亚单位基因(Human telomerase catalytic subunit gene,hTERT; 又 叫 做 Human telomerase reverse transcriptionase)和端粒酶活性的增加,由此维持端粒长度,促进细胞增殖;(4)HBXIP可增加细胞核内p65/NF-κB蛋白水平,进而发挥核因子κB(Nuclear factor-kappa B,NF-KB)促转录调控的作用从而促进细胞增殖。
1.2 HBXIP过表达可造成细胞变异 HBXIP在有丝分裂和细胞分裂中起着关键作用。HBXIP和HBX定位于有丝分裂细胞中的微管,部分定位于中心体,并且能直接作用于中心体裂解。研究人员推测HBXIP是一种肌动蛋白调节器,使中心体沿着微管轨道运动[10]。在细胞分裂的早中期,HBXIP的表达使细胞表现为单极主轴,在末期中心体复制以及形成双极纺锤体时,HBXIP过表达则促进了三极和多极主轴的形成。HBx蛋白异常调节HBXIP的功能,造成中心体的过度复制和有丝分裂纺锤体的多极化,导致染色体分离缺陷,从而产生遗传不稳定—恶性肿瘤的标志[11]。HBXIP过表达时可上调细胞周期蛋白D1、细胞周期蛋白E的表达,并且下调p21、p27的表达,从而促进细胞由G1期进入S期[12]。
研究证明HBXIP在肝癌、乳腺癌、脑胶质瘤细胞和非小细胞肺癌这些恶性肿瘤中表达为阳性[13]。在肝癌中,HBXIP通过激活磷脂酰肌醇-3-激酶/蛋白激酶B(Phosphoinositide 3-kinases/protein kinase B,PI3K/Akt)信号通路来促进肝癌细胞的增殖。HBXIP通过其过表达来上调细胞周期素D1的表达并参与促进肝癌细胞G0/G1期向S期的转换[14]。在乳腺癌中,HBXIP可以通过磷酸化细胞外信号调节激酶 1/2(Phosphorylation-extracellular regulated kinase 1/2,p-ERK1/2) 或 NF-κB 信号来上调 CD46,CD55和CD59以保护乳腺癌细胞免受补体依赖性细胞毒性(Complement-dependentcytotoxcity,CDC)的杀伤[15],并且能够通过刺激 NF-κB介导的白细胞介素8(Interleukins-8,IL-8)的表达来促进乳腺癌迁移[16],还可以通过在乳腺癌细胞中与信号转导和转录激活因子4抗体(Signal transducer and activator of transcription,STAT4)交互激活重组人S100钙结合蛋白 A4(S100 calcium-binding protein A4,S100A4)启动子,导致S100A4升高;通过诱导染色体缺失的磷酸酶和张力蛋白同源物基因(Phosphatase and tensin homolog deleted on chromosome ten,PTEN,即Mutated in multiple advanced cancers 1,MMAC1)的DNA甲基化,激活了PTEN/PI3K/AKT的信号,随后带动了S100A4的表达,从而促进乳腺癌细胞的生长和迁移[17]。
2 HBXIP与血管异常增生的关系
2.1 与血管异常增生有关的细胞因子 许多细胞因子能刺激或抑制血管增生,与血管增生有关的细胞因子见表1。
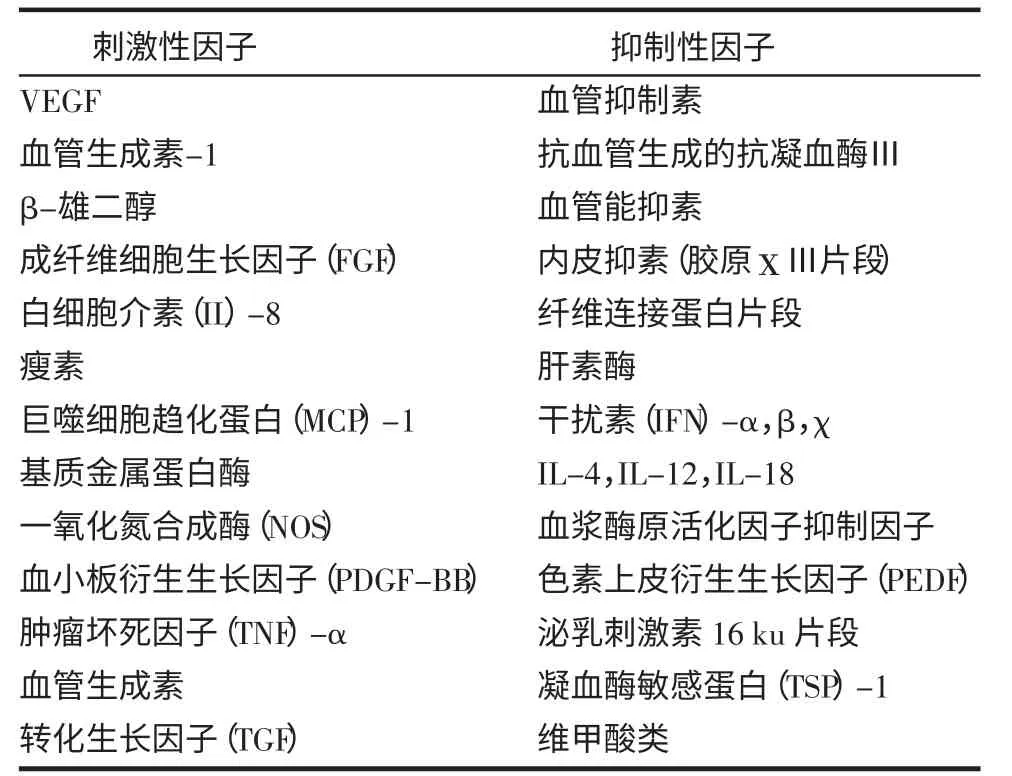
表1 血管生成的刺激性和抑制性调节因子
2.2 HBXIP与血管异常增生 在一项以人脐静脉内皮细胞(Human umbilical vein endothelial cells,HUVEC)为模型的研究中,研究人员发现HBXIP的过度表达促进了HepG2细胞诱导的内皮细胞迁移、增殖、血管生成,这可能与脐静脉内皮细胞的内皮型一氧化氮合成酶磷酸化增加有关[18]。
3 与血管异常增生相关的皮肤病
3.1 银屑病 有关银屑病的病因及发病机制目前尚不清楚,普遍认为其是一种发生在多基因遗传基础上的炎症增生性皮肤病。最新研究表明真皮血管系统尤其是真皮乳头微血管的异常增生是银屑病最早发生的病理过程,对于银屑病的发生发展有着重要的影响[19-20]。真皮表浅微细血管扩张是银屑病组织病理的特征之一,浅部毛细血管进入真皮乳头,在乳头顶尖可见许多血管的片断,活体毛细血管镜证实这是毛细血管襻顶部的过度扭曲和盘绕。微血管组化染色的定量图像分析证实银屑病皮损的浅部微细血管内皮比非皮损部位增加4倍[21]。研究证明微血管的改变发生在皮损发展的早期,临床上表皮尚未见明显异常,但电镜下已可见到真皮乳头毛细血管扩张和走向异常。激光多普勒流量仪显示进展的银屑病斑块边缘皮肤血流增加[22]。内皮细胞增殖加上新生血管形成等事实均表明银屑病毛细血管的异常性依赖于血管生成。研究人员已从银屑病表皮鉴定出若干血管生成因子,包括缺氧诱导因子(Hypoxia-inducible factors)、血管生成素和促血管生成因子(Angiopoietins and pro-angiogenic cytokines),如 IL-17,IL- 8、肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)、 转 化 生 长 因 子(Transforming growth factor-α,TGF-α)、胸腺嘧啶磷酸酶和血管内皮生长因子(Vascular endothelial growth factor,VEGF)[23]。TGF-α由T淋巴细胞和角质形成细胞产生,能刺激角质形成细胞产生过多的VEGF而导致血管生成。TNF-α作用于内皮时,也促进VEGF增加,从而加速血管生成[24]。近年来,一些治疗银屑病的生物制剂如英夫利西单抗(infliximab,抗TNF-α单克隆抗体)亦显示出抗血管生成活性。英夫利西单抗不仅能更强结合TNF-α,而且通过激活补体和抗体依赖性的细胞毒性作用,特异性溶解产生TNF-α的活性细胞,如单核细胞、巨噬细胞和T细胞。在Canete等[25]的研究中,9例活动性关节炎性银屑病患者仅给予大剂量英利西单抗(5 mg/kg)静脉滴注,初始及8周后分别取皮损和滑膜组织作切片检查,结果发现:滑膜 CD31、VEGF、VEGFR-2 均显著减少,由此可反推出血管异常增生是银屑病中很重要的发病因素。在银屑病中,血管异常增生的机制有以下5个方面:(1)促血管生成因子表达增加;(2)抗血管生成因子表达下降;(3)血管生成素协同诱导血管生成;(4)基底膜和细胞外基质降解;(5)内皮细胞黏附[26]。
关于VEGF在银屑病中表达的报道表明由角质形成细胞分泌的VEGF对于银屑病皮损部位血管异常起着决定作用[27-28]。
3.2 其他皮肤病 血管异常增生也是其他许多皮肤病病理过程的一个组成部分:(1)基底细胞癌:有研究表明VEGF在决定基底细胞癌的生长速度和侵袭性方面起着重要的作用[29];(2)鳞状细胞癌:VEGF的表达与肿瘤的分化程度显著相关[30];(3)扁平苔藓:皮损部位的VEGF染色显示均阳性[31];(4)结节性痒疹:皮损表皮上层的角质形成细胞可明显表达VEGF[32];(5)增生性瘢痕:VEGF在增生性瘢痕中大量表达[33];(6)皮肤恶性黑素瘤:VEGF在皮肤恶性黑素瘤组织中高表达[34];(7)皮肤血管瘤:在增殖期血管瘤中,VEGF的表达明显增高[35]。
4 展望
HBXIP与血管异常增生性皮肤病(如银屑病)皆与血管异常增生有着密切的关系,那么,在血管异常增生性皮肤病中,是否因为HBXIP促进了血管生成刺激性调节因子,或者抑制了血管生成抑制性调节因子,从而促进了银屑病等血管异常增生性皮肤病的进展?研究人员采用蛋白质印迹和ELISA测定法检查在HepG2细胞中的VEGF蛋白的表达水平,并在培养基中分泌培养,发现过度的HBXIP不能导致VEGF水平的分泌和增加[36],因此HBXIP可能通过别的途径使血管增生。
尽管经文献检索,未见到证实HBXIP与血管异常增生性皮肤病相关的研究资料。但上述文献的阐述使我们有理由相信,HBXIP与银屑病等血管异常增生性疾病之间很可能存在相关性。可以设想:如果能够发现HBXIP对血管异常增生性皮肤病的作用靶点,那么将对新的治疗方法的产生提供理论上的依据。
[1]Melegari M,Scaglioni PP,Wands JR.Cloning and characterization of a novel hepatitis B virus X binding protein that inhibits viral replication[J].J Virol,1998,72:1737-1743.
[2]Garcia-Saez I,Lacroix FB,Blot D,et al.Structural characterization of HBXIP:the protein that interacts with the anti-apoptotic protein survivin and the oncogenic viral protein HBx[J].J Mol Biol,2011,14:331-340.
[3]Bok K,Prikhodko VG,Green KY,et al.Apoptosis in murine norovirus-infected RAW264.7 cells is associated with downregulation of survivin[J].J Virol,2009,83:3647-3656.
[4]Lamers F,Vander Ploeg I,Schild L,et al.Knockdown of survivin(BIRC5)causes apoptosis in neuroblastoma via mitotic catastrophe[J].Endocr Relat Cancer,2011,18:657-668.
[5]Minczuk M,Mroczek S,Pawlak SD,et al.Human ATP-dependent RNA/DNA helicase hSuv3p interacts with the cofactor of survivin HBXIP[J].FEBS J,2005,19:5008-5019.
[6]Chen H,Guan H,Lu H,et al.Genetic Dissection of IOP Regulation[J].Invest Ophthalmol Vis Sci,2010,51:2149.
[7]Marusawa H,Matsuzawa S,Welsh K,et al.HBXIP functions as a cofactor of survivin in apoptosis suppression[J].EMBO J,2003,22:2729-2740.
[8]Marusawa H,Fujii R,Zhu C,et al.Survivin and HBXIP collaborate in the kinetochore localization of BubR1linked to spindle checkpoint[J].ACR Meeting Abstracts,2004:183.
[9]Wang FZ,Sha L,Qiao L,et al.Promotion of Transcriptional Activity of NF-KB Mediated by HBXIP in Hepatoma Cells[J].Progress in Biochemistry and Biophysics,2007,34:1197-1201.
[10]Fujii R,Zhu C,Wen Y,et al.HBXIP,cellular target of hepatitis B virus oncoprotein,is a regulator of centrosome dynamics and cytokinesis[J].Cancer Res,2006,66:9099-9107.
[11]Hanahan D,Weinberg RA.The hallmarks of cancer[J].Cell,2000,100:57-70.
[12]Wang FZ,Sha L,Ye LH,et al.Promotion of cell proliferation by HBXIP via upregulation of human telomerase reverse transcriptase in human mesenchymal stem cells[J].Acta Pharmacol Sin,2008,29:83-89.
[13]Zhang H,Xu F,Xie T,et al.β-elemene induces glioma cell apoptosis by downregulating survivin and its interaction with hepatitis B X-interacting protein[J].Oncol Rep,2012,28:2083-2090.
[14]Wang FZ,Fei HR,Lian LH,et al.Hepatitis B x-interacting protein induces HepG2 cell proliferation through activation of the phosphatidylinositol 3-kinase/Akt pathway[J].Exp Biol Med,2011,236:62-69.
[15]Cui W,Zhao Y,Shan C,et al.HBXIP upregulates CD46,CD55 and CD59 through ERK1/2/NF-KB signaling to protect breast cancer cells from complement attack[J].FEBS Lett,2012,6:766-771.
[16]Hu N,Zhang JL,Cui WJ,et al.miR-520b Regulates Migration of Breast Cancer Cells by Targeting Hepatitis B X-interacting Protein and Interleukin-8[J].Cell Biology,2011,286:13714-13722.
[17]Liu SP,Li LL,Zhang YY,et al.Oncoprotein HBXIP uses two pathways to up-regulate S100A4 in promotion of growth and migration of breast cancer cells[J].Cell Biology,2012,287:30228-30239.
[18]Wang F,Fei H,Qi B,et al.Overexpression of hepatitis B xinteracting protein in HepG2 cells enhances tumor-induced angiogenesis[J].Mol Cell Biochem,2012,364:165-171.
[19]Singh TP,Schön MP,Wallbrecht K.Involvement of IL-9 in Th17-associated inflammation and angiogenesis of psoriasis[J].PLoS One,2013,8:1371.
[20]Detmar M,Brown LF,Claffey KP,et al.Overexpression of vascular permeability factor/vascular endothelial growth factor and its receptors in psoriasis[J].J Exp Med,1994,1:1141-1146.
[21]林熙然.抑制血管生成与银屑病的中西医结合治疗研究 [J].中国中西医结合皮肤性病学杂志,2006,5(4):187-191
[22]Creamer D,Sullivan D,Bicknell R,et al.Angiogenesis in psoriasis[J].Angiogenesis,2002,5:231-236.
[23]Heidenreich R,Röcken M,Ghoreschi K.Angiogenesis drives psoriasis pathogenesis[J].Int J Exp Pathol,2009,3:232-248.
[24]Krueger G,Ellis CN.Psoriasis recent advances in understanding its pathogenesis and treatment[J].J Am Acad Dermatol,2005,53:94-100.
[25]Canete JD,Pablos JL,Sanmarti R,et al.Antiangiogenic effects of anti-tumor necrosis factor alpha therapy with infliximab in psoriaticarthritis[J].Arthritis Rheum,2004,50:1636-1641.
[26]张彩萍,崔盘根.银屑病微血管异常增生机制及治疗对策[J].国际皮肤性病学杂志,2006,32(1):23-25.
[27]Qin J,Chen X,Yu-Lee LY,et al.Nuclear receptor COUP-TFII controls pancreatic islet tumor angiogenesis by regulating vascular endothelial growth factor/vascular endothelial growth factor receptor-2 signaling[J].Cancer Res,2010.70:8812-8821.
[28]Wang F,Fei H,Qi B,at el.Overexpression of hepatitis B xinteracting proteinin HepG2 cells enhances tumor-induced angiogenesis[J].Mol Cell Biochem,2012,364:165-171.
[29]Bowden J,Brennan PA,Umar T,et al.Expression of vascular endothelial growth factor in basal cell carcinoma and cutaneous squamous cell carcinoma of the head and neck[J].J Cutan Patho,2002,10:585-589.
[30]Loggini B,Boldrini L,Gisfredis S,et al.CD34 microvessel densityand VEGF expression in basal and squamous cell carcinoma[J].Pathol Res Pract,2003,11:705-712.
[31]Couses LM,Fingleton S,Metrlsinus LM.Matrix metallo protein asesin hibitors and cancer:trials and tribulations[J].Science,2002,295:2387-2392.
[32]孙令,赵晔,王傲雪.血管内皮生长因子在结节性痒疹皮损表皮的表达[J].中国皮肤性病学杂志,2000,14(6):385-386.
[33]Wu WS,Wang FS,Yang KD,et al.Dexamethasone induction of keloid regression through effective suppression of VEGF expression and keloid fibroblast proliferation[J].J Invest Dermato,2006,126:1264-1271.
[34]Liu B,Earl H,Baban D,et al.Melanoma cell lines express VEGF receptor KDR and respond to exogenously added VEGF[J].Biochem Biophy Res Commun,1995,217:721-727.
[35]Kandalaft LE,Motz GT,Busch J,et al.Angiogenesis and the tumor vasculature as antitumor immune modulators:the role of vascular endothelial growth factor and endothelin[J].Curr Top Microbiol Immunol,2011,344:129-148.
[36]Wang FZ,Fei HR,Lian LH,et al.Hepatitis B x-interacting protein induces HepG2 cell proliferation through activation of the phosphatidylinositol 3-kinase/Akt pathway[J].Molecular Biology,2011,236:62-69.
